中国北方汉族男性血管内皮生长因子受体2基因+4422(AC)n多态性与HiHiLo训练敏感性的关联研究
2011-05-11聂晶胡扬王景玲衣龙燕乌云格日勒
聂晶 胡扬 王景玲 衣龙燕 乌云格日勒
1 江西师范大学(南昌 330022)
2 北京体育大学
3 山东省射击射箭训练基地
4 内蒙古师范大学
血管内皮生长因子受体2(VEGFR2)是由美国学者Bruce等在1992年从人脐静脉内皮细胞cDNA文库中应用与已知受体酪氨酸激酶(RTK)同源引物通过PCR扩增而获得[1]。它与VEGF结合后,通过引起自身胞内激酶区特定酪氨酸自身磷酸化而活化,进而激活一系列下游信号分子,从而启动核内VEGF基因的表达,完成VEGF促血管内皮细胞增殖、诱导新生血管形成等作用。已有研究发现,有氧耐力运动均能上调VEGFR2 mRNA水平,且VEGFR2蛋白表达增加与耐力运动导致肌组织毛细血管增生高度相关[2-8]。还有文献报道,VEGFR2 mRNA表达的显著上调仅出现在耐力训练敏感组(即VO2max明显提高)[9]。这些结果提示VEGFR2基因在有氧耐力运动中扮演了重要的角色,且mRNA表达的差异可能与基因多态性有关。
+4422(AC)n多态性位于人类VEGFR2基因第2内含子上,其功能意义尚不清楚。但有学者发现,该位点与某些病理表型有关联,而且携(AC)11等位基因者VEGFR2启动子活性明显强于携(AC)12等位基因者,提示该多态可能是一个功能位点,会影响基因表达[10]。而能否利用该重复多态性来预测低氧训练效果,目前尚未见此方面的报道。本研究通过30天高住高练低训(HiHiLo),探讨VEGFR2基因+4422(AC)n多态性与低氧训练敏感性的关联,以期为解释低氧训练效果的个体差异以及制定个性化的低氧训练方案提供科学依据。
1 对象和方法
1.1 研究对象
本研究选取71名中国北方汉族平原地区健康男性受试者,无低氧环境居住史,大多数来自北京体育大学体育系和运动系的中长跑、足球等耐力性项目专业,年龄21.10±1.37岁,身高177.93±5.26厘米,体重69.80±7.80公斤,运动年限4.29±2.12年。
1.2 实验方法
1.2.1 低氧训练方案
HiHiLo方案:低氧睡眠+低氧训练+常氧专项训练,共30天。其中低氧睡眠7 d/周,每晚至少10 h(晚21:00~次日晨7:00),氧浓度为14.8%~14.3%(模拟海拔2800~3000 m);低氧训练3次/周,低氧训练方式为常压低氧环境(氧浓度为15.4%~14.8%,模拟海拔2500~2800 m)蹬功率自行车30 min(60 r/min),以个体75%VO2max强度为基础,运动过程中调节功率车负荷,使受试者SpO2维持在87%~93%。其余时间在常氧环境下进行专项训练。
1.2.2 VO2max的测定
分别在HiHiLo前后测试1次。实验方法为递增负荷运动实验,受试者以90W为起始负荷,以60转/分的频率蹬功率自行车,每2 min递增30W。VO2max的判定标准为HR超过180次/分,呼吸商超过1.1,耗氧量不再增加,不能继续坚持运动。测试仪器为德国Cortex-MetalyzerⅡ型心肺功能测试系统。
1.2.3 脉搏血氧饱和度(SpO2)的测定
分别在HiHiLo前后VO2max测试结束后的第2天测定。测定采用的运动方式为低氧环境下(15.4%O2,海拔约2500米)蹬功率自行车,运动强度为HiHiLo前个体75%VO2max,转速为60转/分。测试时,先让受试者坐功率车上安静,待HR、SpO2稳定后,开始采集安静5分钟每分钟的SpO2值;然后以递增负荷方式热身5分钟后间歇,等HR恢复至90~100次/分时,开始按规定负荷蹬功率车15分钟,停止后恢复5分钟(前2分半钟反方向蹬,后2分半钟转为安静)。记录运动15分钟和恢复5分钟期间每分钟的SpO2。测试仪器为美国产脉搏血氧饱和度测试仪(NONIN 8500)。
1.2.4 基因多态性分析
用Promega试剂盒提取全血DNA。采用PCR结合荧光标记复合STR-genescan方法检测(AC)n多态重复次数。+4422(AC)n多态性在NCBI的SNPs库中,编号为rs3034659。参考NC_000004.10序列,应用primer5.0自行设计引物,使用荧光标记FAM标记上游5’端。上引物:5’-FAM aag gct aat aca act ctt ca -3’(20bp);下引物:5’-cag gtg gct gta ctg gtt-3’(18bp)。PCR 反应体系(15 μl) :DNA 模 板 0.5 μl,Taq 酶(0.15 μl,5 U/μl),dNTP(0.3 μl, 10 mM),Mg2+(0.9 μl,25 mM),上下引物各 1.5 μl(0.05 μg/μl),buffer 1.5 μl,灭菌双蒸水补齐。PCR反应条件:95 ℃预变性5 min;变性94 ℃40 s,退火56 ℃40 s,延伸72℃40 s,共35个循环;72 ℃延伸15 min。PCR反应产物使用ABI-377DNA分析仪确定片段长度,用genescan3.7软件分析扩增产物,并对纯合子进行测序鉴定其重复次数。
1.3 统计学分析
采用△(训练后-训练前)表示训练敏感性。所有数据处理采用SPSS13.0软件统计包完成。采用卡方检验和精确率检验受试者基因型频率是否符合H-W平衡定律,以确认研究样本的群体代表性;用K-S检验训练前后生理指标数据是否符合正态分布;所有受试者低氧训练前后指标的变化采用配对t检验;基因型之间各生理指标的初始值采用独立样本t检验,训练敏感性采用协方差处理。显著性水平设为P < 0.05,非常显著性水平设为P < 0.01。
2 结果
2.1 VEGFR2基因+4422(AC)n多态性基因型和等位基因分布频率
经genescan3.7软件分析后,VEGFR2基因+4422(AC)n多态性出现四种基因型,分别为(AC)11/(AC)11型43人,频率为60.56%;(AC)11/(AC)12型21人,频率为29.58%;(AC)12/ (AC)12型5人,频率为7.04%;(AC)11/(AC)13型2人,频率为2.82%。(AC)11等位基因频率为76.76%,(AC)12等位基因频率21.83%,(AC)13等位基因频率1.41%。经卡方检验,结果显示:χ2(df=3)= 1.27,P = 0.74,表明该人群符合H-W平衡定律,具有群体代表性。
2.2 HiHiLo前后VO2max及定量负荷运动SpO2的变化
经过30天HiHiLo ,68名受试者(3人由于测试有误,数据被删去)VO2max和rVO2max较训练前显著性提高,分别增加了5.72±11.24%和6.81±11.22%;71名受试者定量负荷运动中和恢复期SpO2也较训练前显著性升高,分别提高了1.45±1.87%和1.20±1.48%,安静状态下SpO2未出现显著性变化(表1,图1)。
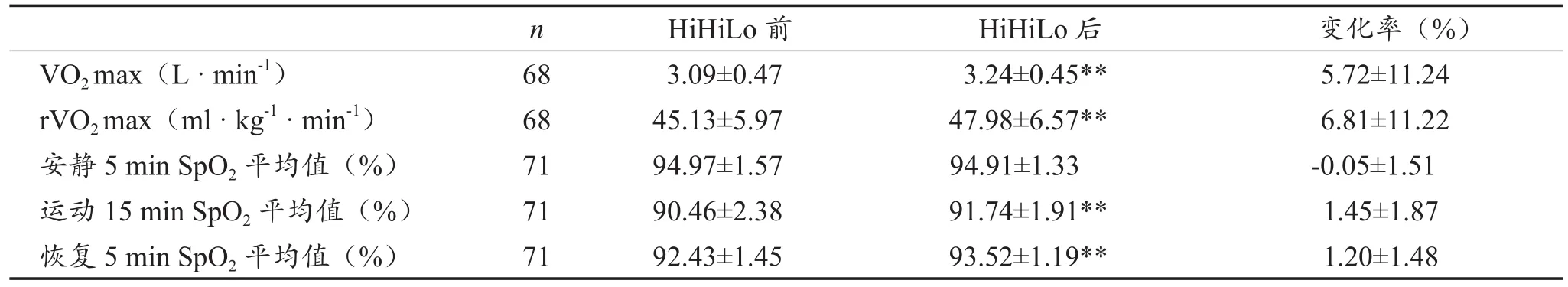
表1 HiHiLo后VO2max及定量负荷下SpO2的变化
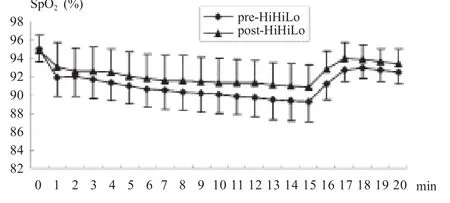
图1 HiHiLo后定量负荷下SpO2的变化
2.3 HiHiLo后各基因型VO2 max的变化
由于(AC)12/(AC)12和(AC)11/(AC)13两种基因型人数均≤5,以下各指标只对(AC)11/(AC)11和(AC)11/(AC)12进行比较。表2显示,HiHiLo前,各基因型的VO2max和rVO2max无显著性差异;经过30天HiHiLo ,(AC)11/(AC)11基因型rVO2max的训练敏感性显著高于(AC)11/(AC)12基因型(P < 0.05);且(AC)11/(AC)11基因型VO2max的训练敏感性也有高于(AC)11/(AC)12基因型的趋势(P < 0.1)。
2.4 HiHiLo后各基因型定量负荷下SpO2的变化
表3显示,不同基因型者在定量负荷运动下SpO2初始值无显著差异;HiHiLo后,各基因型定量负荷运动下SpO2训练敏感性也未见显著差异。

表2 HiHiLo后各基因型VO2max的变化

表3 HiHiLo后各基因型定量负荷下SpO2变化
3 讨论
3.1 HiHiLo后运动能力的变化
本研究结果显示,30天HiHiLo后,受试者VO2max的绝对值和相对值均较训练前显著提高 (P < 0.01),分别增加了5.72±11.24%和6.81±11.22%,表明该训练方法明显提高了机体有氧运动能力,这与Stray-Gundersen等学者的报道相一致[11]。但也有学者研究发现,4周HiHiLo后,运动员VO2max的提高并无统计学意义[12]。造成以上结果不同的原因可能与受试者个体差异、运动项目之间的差异、低氧环境以及训练方法的差异有关。
目前,对SpO2的监测已被广泛应用于运动训练领域中,它在一定程度上可以反映机体缺氧的状况。本研究发现,HiHiLo后,受试者在进行相同负荷运动中及运动后恢复期SpO2均较训练前显著升高(P < 0.01),表明机体缺氧状况明显改善,运动能力有所提高。造成此结果的原因可能主要还是与低氧刺激有关。有文献报道,间歇性低氧暴露后,在低氧安静时以及低氧运动时SpO2较暴露前显著增加[13,14]。
3.2 VEGFR2基因+4422(AC)n多态性与VO2 max、SpO2 的关联
在低氧环境中,肌组织通过毛细血管新生,缩短血管与组织细胞之间的氧气弥散距离,扩大弥散面积,增加对细胞的供氧量,这是机体在组织水平上对低氧习服适应的重要机制。而VEGFR2在血管新生中发挥了重要作用[15,16]。有文献报道,VEGFR2基因敲除的小鼠由于缺乏血管生成的能力而死亡[17]。因此,推测VEGFR2基因可能与低氧适应能力有关。而这种适应能力的好坏直接关系着训练的效果。迄今为止,人类基因组中已发现了一些与低氧适应能力有关的基因多态性,但对微卫星多态性的报道不多。该多态性又被称为短串联重复(STR),它们分布广泛,且其重复次数在个体间呈高度变异性,因而,也是目前在遗传分析中应用最广泛的遗传标记之一。
本研究首次报道了VEGFR2基因+4422(AC)n多态性与HiHiLo训练敏感性的关联。结果显示,HiHiLo后,(AC)11/(AC)11基因型rVO2max训练敏感性显著高于(AC)11/(AC)12基因型,且(AC)11/(AC)11基因型VO2max训练敏感性也有高于(AC)11/(AC)12基因型的趋势;在完成同等负荷的低氧运动中,SpO2敏感性在不同基因型之间未出现显著差异。这表明VEGFR2基因+4422(AC)n多态性与HiHiLo后rVO2max的变化有关联,而与定量负荷运动下SpO2的变化无关联。其中(AC)11/(AC)11基因型者对HiHiLo训练更敏感,提示该多态性可以用于预测低氧训练效果。分析其关联原因可能是由于该多态位于内含子上,而内含子在基因剪切过程中发挥着重要的作用。尤其是靠近外显子的内含子区可能对于异源核RNA(hnRNA)→mRNA成熟过程中的选择性拼接有重要影响。它通过参与5’端加帽、3’端加PolyA的形成,从而提高mRNA的稳定性,提高基因表达的效率;而且在内含子中还可能含有某些转录因子的结合位点,从而调控基因表达。另外,在特定情况下,内含子也可以作为增强子或沉默子影响到基因的转录表达[18]。因此,(AC)11/(AC)11基因型者可能表现出较高的VEGFR2 mRNA表达,从而增强了与VEGF的结合活性,产生促血管生成的生物学效应,有利于提高组织摄氧能力,导致机体VO2max增加。已有文献报道,经过6周耐力训练后,VEGFR2 mRNA仅在VO2max明显升高组显著上调[9]。这可能也进一步提示了VEGFR2基因表达的差异会影响有氧能力表型(VO2max),而基因多态性可以解释这种个体差异。另一方面,该多态本身可能并不是功能位点,但与某个功能位点连锁不平衡。近年来有文献报道,VEGFR2基因的某些其他功能位点与临床病理表型有关联,可能是影响了 R2 与 VEGF 结合的有效性[19,20]。关于VEGFR2基因+4422(AC)n多态性与定量负荷低氧运动下SpO2变化无关联,可能是该多态并不决定此表型。但我国学者郑澜等发现,血清VEGF含量与动脉血氧分压显著相关[21]。推测可能与VEGF受体活性有关。随着低氧程度的增加,动脉血氧分压下降,VEGF受体活性增强,与血清VEGF结合后,产生促血管生成效应,而使血中VEGF含量下降,这将有利于机体缺氧状况的改善。因此,从理论上分析VEGFR2可能与低氧训练后SpO2变化有一定联系。但究竟本研究所选取的+4422(AC)n多态是不是功能位点,还需要进一步进行功能研究。而且,本研究中(AC)12/ (AC)12和(AC)11/(AC)13两种基因型分布频率偏低,因而有待于加大样本量进行验证。
另外,本研究也首次报道了VEGFR2基因+4422(AC)n多态性基因型及等位基因在中国北方汉族人群中的分布频率。本结果与Kariyazono等报道该基因多态性在144名日本人中的分布频率并不完全一致[10]。这可能与种族、地区的异质性以及样本量的大小有关,也有待于其它研究的进一步验证。
4 总结
VEGFR2基因+4422(AC)n多态性与HiHiLo后rVO2max训练敏感性有关联,而与定量负荷低氧运动下SpO2训练敏感性无关联。其中(AC)11/(AC)11基因型者对HiHiLo更敏感,提示VEGFR2基因+4422(AC)n多态性可以作为预测低氧训练效果的分子遗传学标记,但还有待于加大样本量进行验证。
[1]Terman BI,Dougher-Vermazen M,Carrion M,et al.Identification of the KDR tyrosine kinase as a receptor for vascular endothelial cell growth factor. Biochem Biophys Res Commun,1992,187(3):1579-1586.
[2]Gavin TP,drew JL,kubik CJ,et al. Acute resistance exercise increases skeletal muscle angiogenic growth factor expression. Acta Physiol(Oxf),2007,191(2):139-146.
[3]Gavin TP,Robinson CB,Yeager RC,et al. Angiogenic growth factor response to acute systemic exercise in human skeletal muscle. J Appl Physiol,2004,96(1):19-24.
[4]Gustafsson T,Ameln H,Fischer H,et al. VEGF-A splice variants and related receptor expression in human skeletal muscle following submaximal exercise. J Appl Physiol,2005,98(6):2137-46.
[5]Gustafsson T,Rundqvist H,Norrbom J,et al. The influence of physical training on the angiopoietin and VEGF-A systems in human skeletal muscle. J Appl Physiol,2007,103(3):1012-1020.
[6]Lloyd PG,Prior BM,Yang HT,et al. Angiogenic growth factor expression in rat skeletal muscle in response to exercise training. Am J Physiol Heart Circ Physiol,2003,284(5):H1668-1678.
[7]Milkiewicz M,Hudlicka O,Verhaeg J,et al. Differential expression of Flk-1 and Flt-1 in rat skeletal muscle in response to chronic ischaemia:favourable effect of muscle activity. Clin Sci Colch,2003,105(4):473-482.
[8]Motoyuki I,Seiji M,Subrina J,et al. Exercise training improves aging-induced downregulation of VEGF angiogenic signaling cascade in hearts. Am J Physiol Heart Circ Physiol,2006,291(3):H1290-H1298.
[9]Timmons JA,Jansson E,Fisher H,et al. Modulation of extracellular matrix genes reflects the magnitude of physiological adaptation to aerobic exercise training in humans. BMC Biology,2005,3(2):19-28.
[10]Kariyazono H,Ohno T,Khajoee V,et al. Association of vascular endothelial growth factor(VEGF) and VEGF receptor gene polymorphisms with coronary artery lesions of Kawasaki disease. Pediatric Research,2004,56(6):953-959.
[11]Stray-Gundersen J,Levine BD. “Living high-training high and low” is equivalent to “living high-training low”for sea level performance. Med Sci Sports Exerc,1997,29:S136.
[12]刘海平,胡扬,孔兆伟. HiHiLo与LoHi两种低氧训练效果的比较研究. 体育科学,2006,26(4):58-61.
[13]Muza SR,Young AJ,Sawka MN,et al. Ventilation after supplemental oxygen administration at high altitude.Wilderness Environ Med,2004,15(1):18-24.
[14]Ricart A,Casas H,Casas M,et al. Acclimatization near home? Early respiratory changes after short-term intermittent exposure to simulated altitude. Wilderness Environ Med,2000 ,11(2):84-88.
[15]Shalaby F,Rossant J,Yamaguchi TP,et al. Failure of blood-island formation and vasculogenesis in Flk-1-deficient mice. Nature,1995,376(6335):62-66.
[16]Wise LM,Veikkola T,Mercer AA,et al. Vascular endothelial growth factor(VEGF)-like protein from orf virus NZ2 binds to VEGFR2 and neuropilin-1. PNAS,1999,96(6):3071-3076.
[17]Abbott BD,Buckalew AR. Placental defects in ARNT-knockout conceptus correlate with localized decreases in VEGF-R2,Ang-1,and Tie-2. Dev Dyn,2000,219(4):526-538.
[18]Meloni R,Albanese V,Ravassard P,et al.A tetranucleotide polymorphic microsatellite,located in the first intron of the tyrosinehydroxylase gene,act as a transcription regulatory element in vitro. Hum Mol Genet,1998,7(3):423-438.
[19]Wang Y,Zheng Y,Zhang W,et al. Polymorphisms of KDR gene are associated with coronary heart disease. J Am Coll Cardiol,2007,50(8):760-767.
[20]Zhang WL,Sun K,Wang Y,et al. Interaction of the Ile297 variant of vascular endothelial growth factor receptor-2 gene and homocysteine on the risk of stroke recurrence. Circulation,2007,116(Suppl):521.
[21]郑澜,陆爱云,周志宏. 低氧运动大鼠血清血管内皮生长因子与动脉血氧分压的相关研究. 体育科学,2004,24(7):28-30.
