冷空气激发前后运动性哮喘患者外周气道功能的变化
2011-05-11逯勇黄克武张洪玉常晓红张君武宝梅彭晶晶
逯勇 黄克武 张洪玉 常晓红 张君 武宝梅 彭晶晶
北京市呼吸与肺循环疾病实验室,北京呼吸疾病研究所
首都医科大学附属北京朝阳医院呼吸与危重症医学科(北京 100020)
近年来的研究表明,炎症细胞浸润和气道结构重塑不仅发生在支气管患者的大、中气道,同样发生于外周气道[1-3]。目前有关哮喘患者外周气道病变的研究主要来自于尸体解剖和通过纤维支气管镜取得的标本[4-6]。外周气道病变是哮喘的普遍现象还是病情发展的产物,目前尚不清楚;而外周气道病变在运动性哮喘(exercise-induced asthma,EIA)发病中的意义,目前也尚无定论。基于强迫振荡原理(FOT)的脉冲振荡法肺功能(IOS)检测,能区分阻塞发生的部位(中心或外周)、严重程度及呼吸力学特征,且在检测过程中无需受试者主动配合[7]。冷空气气道激发试验属于间接气道激发试验,通过受试者过度通气含有4.5~5.5%二氧化碳的冷空气(-12℃ ~ -15℃),以改变受试者气道表面的渗透压和温度,从而诱发肥大细胞、嗜酸性粒细胞等炎症细胞释放组胺、白三烯、前列腺素等炎症因子,导致气道收缩。相对于组胺、乙酰甲胆碱激发试验等直接气道激发试验,冷空气激发试验所引起的病理生理改变与运动性哮喘发作时的实际改变更加近似[8]。本研究通过对EIA患者过度通气冷空气后FEV1和R5-R20、R20等IOS指标的变化,探讨冷空气激发前后运动性哮喘患者外周气道功能的变化。
1 对象和方法
1.1 研究对象
EIA组:20例EIA患者来自2008年9月至2009年4月在北京朝阳医院健康呼吸中心或呼吸科门诊就诊的患者,年龄35.8±10.3岁,男性11例,女性9例。根据支气管哮喘防治指南[8],通过病史、既往气道高反应性或可逆性气道阻塞的客观依据作出支气管哮喘诊断,至少满足下列条件之一:(1)运动激发试验后FEV1下降≥10%;(2)乙酰甲胆碱激发试验后FEV1下降≥20%;(3)吸入沙丁胺醇后FEV1提高≥12%。所有患者均为非急性发作期患者,试验前FEV1≥70%预计值;所有患者均有运动诱发哮喘的病史;皮肤点刺试验对20种常见过敏原中的至少一种呈阳性反应。所有患者均无吸烟史,4周内无哮喘急性发作史和急性上呼吸道感染史。
健康对照组:10名普通人,心肺功能正常,无吸烟史,近4周内无上呼吸道感染史,年龄33.0±8.3岁,男女各5例。
1.2 方法
1.2.1 实验流程
按照入选和排除标准选取研究对象,先行常规肺功能检查,取FEV1≥70%预测值者,签署知情同意书后进入试验。嘱所有受试者择期停用茶碱类、β2受体激动剂、抗胆碱药物12小时,停用吸入糖皮质激素、抗组织胺药物48小时后于9am~12am再次就诊。再次就诊时采用德国Jaegere公司生产的脉冲振荡肺功能测定仪(Master Screen IOS)行IOS和常规肺功能测定。如受试者FEV1< 70%预测值则退出试验,对FEV1≥70%预测值的受试者采用德国康讯公司生产的冷空气激发试验系统(Ganshorn CAP),嘱受试者以25倍FEV1为每分钟通气量目标(相当于MVV的70%)过度通气4分钟,吸入气体温度为-12 ℃~ -15℃,含有21%氧、4.5~5.5%二氧化碳和平衡氮气。在过度通气冷空气结束后第5、10、15、20、30分钟分别行IOS和常规肺功能检测,以冷空气激发后FEV1下降≥10%作为冷空气激发试验阳性标准[9]。
1.2.2 试验方法
脉冲振荡肺功能(IOS)测定:采用德国Jaegere公司生产的脉冲振荡肺功能测定仪(Master Screen IOS)行脉冲振荡肺功能检测。患者坐位,头呈水平位或稍微上仰,夹鼻夹,含口件,手掌压住腮帮,自主平静呼吸,呼吸平稳后,开始记录一分钟,重复测定3次,取其平均值。记录受试者基础状态的中心气道阻力(R20)、外周气道阻力(R5-R20)等指标。
肺容量测定:采用德国Jaegere公司生产的脉冲振荡肺功能测定仪(Master Screen IOS)行FEV1、FVC测定。受试者首先正常呼吸,记录3~5个潮气呼吸后缓慢呼气至ERV位,接着缓慢吸气至肺总量(TLC)位,然后尽最大力量快速呼气至没有气体再呼出(呼气时间至少持续6秒),再用力快速完全吸气回到TLC位。至少重复3次操作得到3次可接受的流速-容量环,如果2个FVC或FEV1的最大变异值在0.15 L之内可以接受。
以上操作标准参照美国胸科协会/欧洲呼吸协会(ATS/ERS)2005年制定的肺功能测试标准化操作指南[10]。
1.3 统计学分析
2 结果
2.1 基本资料
表1显示,EIA组与健康对照组受试者在年龄、性别构成、FEV1、FEV1%及在冷空气激发试验中达到的分钟通气量(以FEV1的倍数表示)均无显著性差异(P > 0.05);EIA组FEV1/ FVC%低于健康对照组,两组比较差异有统计学意义(P < 0.05)。
2.2 冷空气激发试验中两组受试者的通气功能比较
表1显示,EIA组冷空气激发后FEV1降低百分比显著高于健康对照组(P < 0.05)。EIA组中有15例(占75%)患者冷空气激发试验达到阳性标准,健康对照组中有1例阳性,占10%。
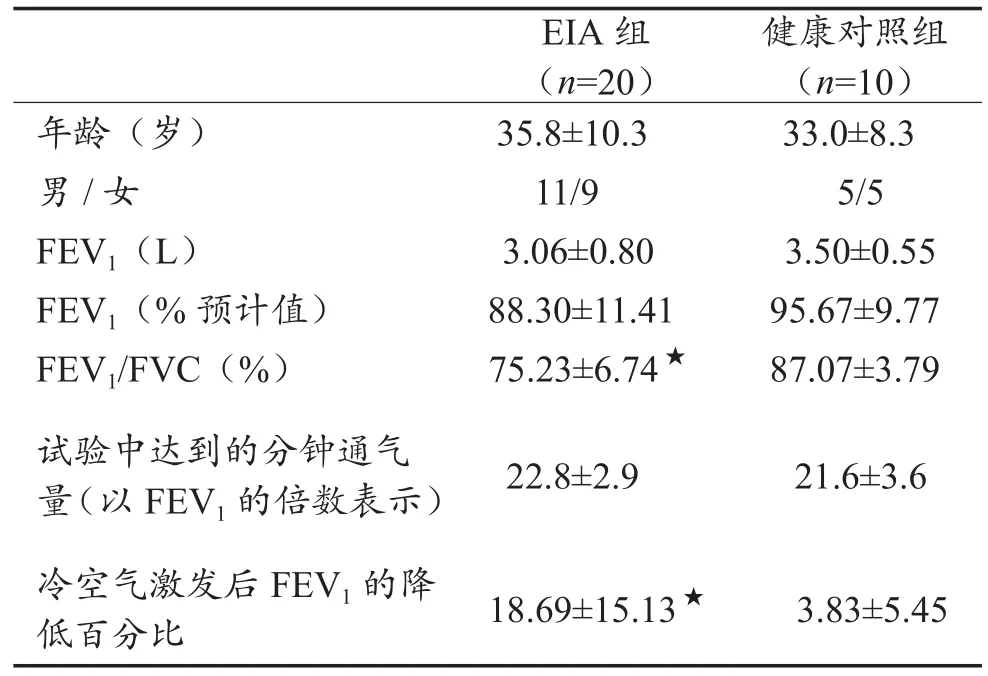
表1 两组受试者的基本资料及冷空气激发后通气功能比较
2.3 冷空气激发试验中两组受试者的气道阻力比较
表2显示,冷空气激发试验前,EIA组受试者R5-R20明显高于健康对照组;而R20两组间无显著性差异。冷空气激发试验前后对比,EIA组受试者R5-R20、R20激发后均较激发前明显升高;健康对照组受试者激发后R5-R20较激发前明显升高,而R20激发前后无明显变化。
EIA组外周气道阻力在激发前后的变化[Δ(R5-R20)]相较中心气道阻力变化(ΔR20)有显著性差异。健康对照组激发后中心气道阻力变化(ΔR20)和外周气道阻力变化[Δ(R5-R20)]相比差异不明显。
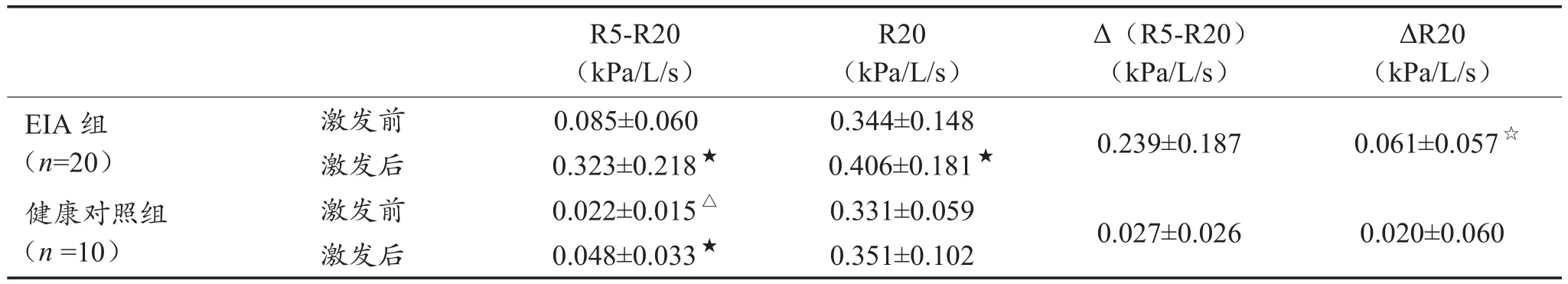
表2 两组受试者在冷空气激发试验中的气道阻力比较
3 讨论
相对于只涉及某一种刺激因子的组胺或乙酰甲胆碱药物激发试验而言,冷空气激发试验等间接气道激发试验可以诱发组胺、白三烯、前列腺素等一系列炎症因子的释放,其对EIA患者的检测敏感性较高[11,12]。本实验EIA组患者中,阳性率达到75%,与文献报道相近,提示冷空气激发试验对EIA是一种敏感的辅助诊断方法。通过物理刺激诱发多种炎症因子释放的过程也与EIA发生的实际病理生理改变更为相近。
本研究的结果显示,EIA组患者在临床控制状态(FEV1、FEV1/FVC等指标大致在正常范围)下,即存在明显的外周气道功能异常,表现为R5-R20(反映外周气道功能)明显高于对照组;而此时EIA组和健康对照组的R20(反映中心气道阻力)并无显著差异。冷空气激发试验对EIA组受试者R20、R5-R20的影响均有统计学意义,激发后Δ(R5-R20)(反映外周气道阻力的变化程度)与ΔR20(反映中心气道的阻力变化程度)相比有显著性差异。冷空气激发试验对健康对照组受试者R20的影响无统计学意义,而激发后R5-R20显著升高,激发后中心气道阻力变化和外周气道阻力变化程度差异不明显。
外周气道包括直径< 2 mm的小气道与肺实质[13]。既往曾因外周气道阻力仅占总肺阻力的20%认为该部位的阻塞对肺脏力学性质以及通气的影响很小,而将此区称为“静区”。同时由于缺乏特异性的指标和取材的困难,使得哮喘气道炎症和结构重塑的研究仅局限于中央气道,而外周气道病变在哮喘发病中的作用被大大低估了。最大流量-容积曲线(MEFV)是最常用的测定小气道功能的方法,用力呼气中段流量、用力肺容积50%、25%的最大呼气流速(FEF50、FEF25)等指标被认为是比较好的反映小气道功能的指标[14],但由于其检测需要受试者的主观配合,测试结果容易受到测试时的人为因素和非生理性瞬间改变的影响,从而掩盖轻度的小气道功能变化;同时,这些指标异常可能是小气道病变的结果,也可能是肺组织弹性功能减退的结果。脉冲振荡法肺功能(IOS)检测可区分中心及外周气道阻力,测定时受试者只需平静呼吸,测试结果较少受到用力呼吸引起的支气管舒缩效应以及人为因素的影响,在诊断气道阻塞性疾病方面有较高的敏感性,有助于疾病的早期诊断和评估[7,15]。本研究结果显示,在常规肺功能达到临床控制指标的稳定期EIA患者,中心气道阻力接近正常对照,而其外周气道阻力仍高于对照组,提示临床控制的EIA患者仍存在外周气道病变。
两组受试者进行冷空气气道激发试验的研究结果显示,EIA患者激发后外周气道阻力变化程度明显高于中心气道阻力变化,而对照组受试者冷空气激发后外周气道阻力与中心气道阻力变化程度无明显差异。这与King等的报道一致:周边轻度阻塞的患者行乙酰甲胆碱气道激发试验时,外周气道的反应明显高于中心气道,而且是决定气道高反应的重要因素[16]。这些均提示EIA患者的外周气道可能存在与中心气道相似且更为严重的气道炎症,使外周气道对致敏原的反应增强,导致外周气道敏感性强于中心气道。
综上,本研究结果提示,冷空气激发试验对于EIA是一种敏感的辅助诊断方法;EIA患者普遍存在外周气道病变;EIA患者冷空气激发试验时外周气道的收缩反应强于中心气道,外周气道病变在EIA的发病中发挥着重要作用。
[1]Howarth PH. Small airways and asthma. An important therapeutic target? Am J Respir Crit Care Med,1998,157:S173-S207.
[2]Green M. Treating large and small airways. Int J Clin Pract Suppl,1998,96 :2-4.
[3]Bjermer L. History and future perspectives of treating asthma as a systemic and small airways disease. Respir Med,2001,95:703-719.
[4]Carroll N,Elliot J,Morton A,et al. The structure of large and small airways in nonfatal and fatal asthma. Am Rev Respir Dis,1993,147:405-410.
[5]Saetta M,Di Stefano A,Rosina C,et al. Quantitative structural analysis of peripheral airways and arteries in sudden fatal asthma. Am Rev Respir Dis,1991,143 :138-143.
[6]Kraft M,Djukanovic R,Wilson S,et al. Alveolar tissue inf l ammation in asthma. Am J Respir Crit Care Med,1996,154:1505-1510.
[7]Goldman MD,Saadeh C,Ross D. Clinical applications of forced oscillation to assess peripheral airway function.Respir Physiol Neurobiol,2005,148(1-2):179-194.
[8]中华医学会呼吸病学分会哮喘学组.支气管哮喘防治指南(支气管哮喘的定义、诊断、治疗和管理方案).中华结核和呼吸杂志,2008,31:177-185.
[9]Hurwitz KM,Argyros GJ,Roach JM,et al. Interpretation of eucapnic voluntary hyperventilation in the diagnosis of asthma. Chest,1995,108 :1240-1245.
[10]Laszlo G . Standardization of lung function testing :Helpful guidance from the ATS/ERS Task Force. Thorax,2006,61(9):744-6.
[11]Holzer K,Anderson SD,Douglass J. Exercise in elite summer athletes:Challenges for diagnosis. J Allergy Clin Immunol,2002,110 :374-80.
[12]Haby MM,Peat JK,Mellis CM,et al. An exercise challenge for epidemiological studies of childhood asthma:validity and repeatability. Eur Respir J,1995,8:729-36.
[13]Weibel ER. Morphometry of the Human Lung. New York,Academic Press,1963. 79-92.
[14]穆魁津,穆魁敏,何权瀛.等.缓解期哮喘儿童呼吸功能测定. 中华结核和呼吸杂志,1983,6:149-151.
[15]Oostveen E,MacLeod D,Lorino H,et al. The forced oscillation technique in clinical practice:methodology,recommendations and future developments. Eur Respir J,2003,22(6):1026-1041.
[16]King GG,Dowine SR,Verbanck S,et al. Effects of methacholine on small airway function measured by forced oscillation technique and multiple breath nitrogen washout in normal subjects. Respir Physiol Neurobiol,2005,148(1-2):165-7.
