伯乐树ISSR分子标记体系的建立
2011-05-09谢正成楼雄珍姚理武黄华宏林二培骆文坚陈春梅
谢正成,楼雄珍,姚理武,黄华宏*,林二培,骆文坚,陈春梅
(1. 浙江省庆元县林业局,浙江 庆元 323800;2. 浙江农林大学,浙江 临安 311300;3. 浙江省林业种苗管理总站,浙江 杭州 310020)
伯乐树ISSR分子标记体系的建立
谢正成1,楼雄珍2,姚理武1,黄华宏2*,林二培2,骆文坚3,陈春梅1
(1. 浙江省庆元县林业局,浙江 庆元 323800;2. 浙江农林大学,浙江 临安 311300;3. 浙江省林业种苗管理总站,浙江 杭州 310020)
从浙江省庆元县等地采集23份野生伯乐树单株叶片为试验材料,采用单因素对比试验和正交优化试验研究了模板DNA、Taq DNA聚合酶的用量,以及Mg2+、dNTP、引物浓度和退火温度对PCR扩增的影响,建立伯乐树适宜的ISSR-PCR扩增体系,即20μL体系中含90 ng模板DNA,1×PCR buffer,1.0 mmol/L Mg2+,0.15 mmol/L dNTP,0.5μmol/L引物,0.75U Taq DNA聚合酶,退火温度为50℃。
伯乐树;ISSR;分子标记
伯乐树(Bretschneidera sinensis)又名钟萼木,属伯乐树科,是我国特有的、古老的单种科和残遗种,零散分布于浙江南部、台湾、福建、湖南、湖北、广东、广西和四川等省,处于濒危状态,已被国家列为一级保护植物。它在研究被子植物的系统发育和古地理、古气候等方面都有重要科学价值。同时,其树姿挺拔,花果艳丽,且木材硬度适中,纹理直,结构细密,是优良的园林绿化树种和用材树种。目前,有关伯乐树的研究较少,仅限于生物学特性[1~2]、群落特征[3]、种子贮藏与育苗[4~7]以及组织培养[8~9]等方面,而利用分子技术对其进行系统研究尚未见报道。
Zietkiew icz等于1994年创建的简单重复序列区间(Inter-Simple Sequence Repeat, ISSR)[10]标记已广泛应用于植物品种鉴定[11]、遗传多样性分析[12~13]、指纹图谱和分子遗传图谱构建[14~16]等研究。实验中ISSR标记会受到多种反应条件的影响,不同物种对反应的要求也不尽相同[17~18]。因此,在运用该技术进行分析时,首先需要建立效果好且稳定的反应体系。本文以我国特有的珍稀濒危树种伯乐树为材料,对影响ISSR扩增效果的主要因素模板DNA、Taq DNA聚合酶的用量,Mg2+、dNTPs、引物的浓度,以及退火温度进行探讨,拟建立适用于伯乐树的最佳ISSR-PCR技术体系,从而为其天然群体遗传多样性分析奠定基础。
1 材料与方法
1.1 植物材料
试材为23份野生伯乐树单株叶片,分别编号为1~23,其中19份取自浙江的庆元、龙泉、景宁、泰顺等县,4份取自江西龙南的九连山,硅胶干燥保存。
1.2 主要仪器与试剂
PCR扩增反应在HYBAID公司生产的PCRexpress扩增仪上进行;电泳仪、电泳槽以及凝胶成像系统由Bio-Rad公司生产。PCR扩增所用的Taq DNA聚合酶(5 U/μL)、10×PCR 缓冲液、M gCl2(25 mmol/L)、dNTPs(各2.5 mmol/L)以及标准分子量DNA(DL2000)等购自宝生物工程(大连)有限公司;引物由南京金斯瑞生物科技有限公司合成;电泳所用主要试剂Tris、琼脂糖等购自上海生工生物工程技术服务有限公司。
1.3 方法
1.3.1 伯乐树DNA的提取及检测 采用改进后的CTAB微量法提取伯乐树基因组DNA。用NanoDrop微量分光光度计测量所提DNA纯度和浓度,同时用1.0%的琼脂糖凝胶电泳法检测DNA是否降解。
1.3.2 PCR扩增及实验设计 以来自浙江庆元的1号伯乐树叶片DNA为模板,综合考虑ISSR技术在银杏[11]、茶树[15]、五针松[17]等植物上各成分的用量,设定原始反应体系:20μL体系中10×PCR 缓冲液2.0μL、Mg2+2.5 mmol/L、dNTPs 0.125 mmol/L、引物0.5μmol/L、Taq 酶1.0 U、DNA 50 ng。
根据预备实验的结果,以扩增较好的通用引物UBC817、823、824、834作为基因组DNA扩增引物,采用单因素实验设计方法,对ISSR反应体系中的DNA模板、Mg2+、dNTPs、引物浓度、Taq DNA聚合酶5种主要成分进行分析(20μL反应体系中各成分优化设计方案见表1)。在此基础上,进一步对这5种成分开展正交优化,选用L16(45)正交表,设计方案见表2。另外,对影响PCR结果的退火温度也进行对比筛选。
扩增反应程序:94℃预变性5 min,94℃变性30 s,退火温度(依引物而定)40 s,72℃延伸90 s,35个循环,72℃延伸10 min,4℃保存。

表1 单因素优化设计方案Table 1 Single factor design for PCR

表2 ISSR-PCR正交试验设计[L16(45)]Table 2 Orthogonal design for ISSR-PCR
1.3.3 ISSR-PCR产物检测 用1.0%的琼脂糖凝胶电泳检测,EB染色,在Bio-Rad凝胶成像系统进行观察和拍照。
2 结果与分析
2.1 基因组DNA的提取结果
所提伯乐树DNA的OD260/OD280值为1.80~2.09,表明DNA纯度较好。经1.0%琼脂糖凝胶电泳检测,发现点样孔清晰,条带完整(图1),无RNA污染。因此,本实验提取DNA质量较好,适合用于ISSR-PCR扩增。

图1 8个伯乐树样品DNA的电泳结果Figure 1 Electrophoresis results of eight DNA samples ofB. sinensis
2.2 模板DNA用量对ISSR反应的影响
从图2可以看出,实验中各模板用量都获得了比较清晰的扩增产物。同时,随着DNA用量增大,主要条带亮度有所增强,且弱带也逐渐清晰,当用量为30~120 ng时,扩增效果相对理想。
2.3 Mg2+浓度对ISSR反应的影响
Taq DNA聚合酶是Mg2+依赖性酶,Mg2+浓度对其催化活性和催化产物有明显影响。从图3可看出,Mg2+浓度在0.625~5.0 mmol/L均有扩增产物。浓度为0.625时,表现部分条带缺失,在3.125~5.0 mmol/L时,出现条带模糊,而在1.25~2.5 mmol/L有较好的扩增,但比较发现1.25和1.875 mmol/L处扩增条带更清晰稳定,且比原始反应体系中的用量(2.5 mmol/L)低。
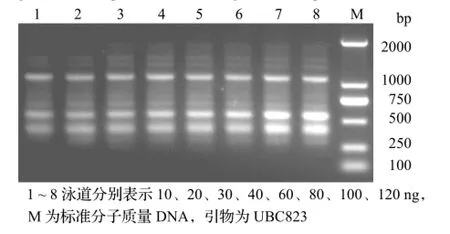
图2 不同模板DNA用量对PCR反应的影响Figure 2 Effect of different concentration of DNA template on PCR
2.4 dNTPs浓度对ISSR反应的影响
dNTPs 是PCR 的原料,浓度过高或过低都会对扩增结果产生影响。图4显示:dNTPs 浓度在0.025~0.225 mmol/L时,都得到了扩增产物,但在0.025 mmol/L时出现扩增谱带部分缺失,在0.2、0.225 mmol/L时出现条带模糊,比较而言,在0.1~0.15 mmol/L时扩增条带更为清晰且稳定。

图3 不同Mg2+浓度对PCR反应的影响Figure 3 Effect of different concentration of Mg2+on PCR

图4 不同dNTP浓度对PCR反应的影响Figure 4 Effect of different concentration of dNTPs on PCR
2.5 引物浓度对ISSR反应的影响
引物浓度也是影响PCR扩增效果的重要因素。实验中设置了0.1~0.9μmol/L共9个梯度。从图5可看出,在9个浓度下都得到扩增,其中在0.1和0.9μmol/L时扩增不理想,出现部分主要条带弱且模糊,在0.2~0.8 μmol/L皆得到了4个主要条带,且大小一致,而引物浓度为0.4、0.5μmol/L时表现相对清晰。
2.6 Taq酶用量对ISSR反应的影响
Taq DNA聚合酶的用量是PCR反应中最为重要的影响因子之一,当用量过多易产生非特异性扩增,而用量太低又得不到扩增产物。由图6可知,当Taq DNA聚合酶的用量为0.25U时没得到扩增,而在0.5~2.0U主要条带都被扩增出来,且大小一致。
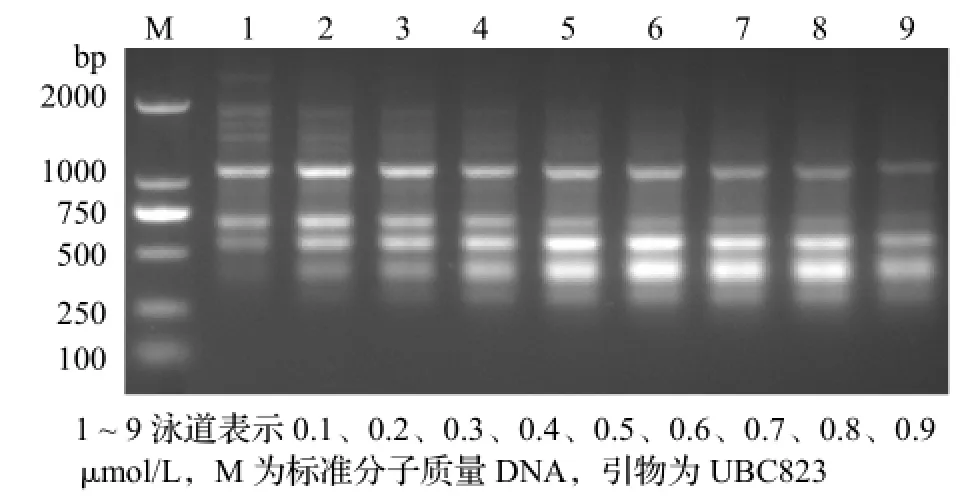
图5 不同引物浓度对PCR反应的影响Figure 5 Effect of different concentration of prime on PCR
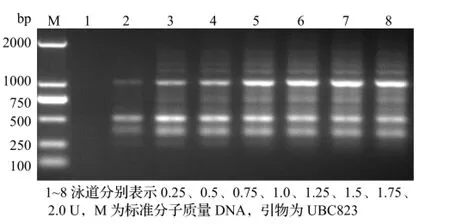
图6 Taq酶用量对PCR反应的影响Figure 6 Effect of different concentration of Taq DNA polymerase on PCR
2.7 ISSR反应体系的正交优化结果
在单因素试验的基础上,同时考虑ISSR-PCR主要反应成分间的交互作用,进一步进行正交优化实验。图7为以UBC817为引物的正交试验结果。从图中可看出,处理9、10得到的条带相对清晰,杂带少且稳定。而其他处理表现出条带模糊或缺失,或是出现非特异性扩增,都不符合预期的目标。综合考虑单因素对比试验结果,选择处理9作为最佳的反应体系。
2.8 退火温度对ISSR反应的影响
除反应体系中的各成分外,ISSR-PCR扩增程序中的变性、退火、延伸温度和时间,以及循环数也会影响PCR结果,其中以退火温度的影响较大。图8所示为引物UBC834在不同退火温度下的扩增结果。从42.1~56.7℃的14.6℃温度间隔里,在退火温度为42.1~46.4℃时,扩增出的一些条带亮度弱且模糊不清,48.4、50.3℃时扩增出的条带清晰明亮,而高于52.3℃时出现条带模糊且部分条带缺失。本实验选择50℃为引物834的适宜退火温度。
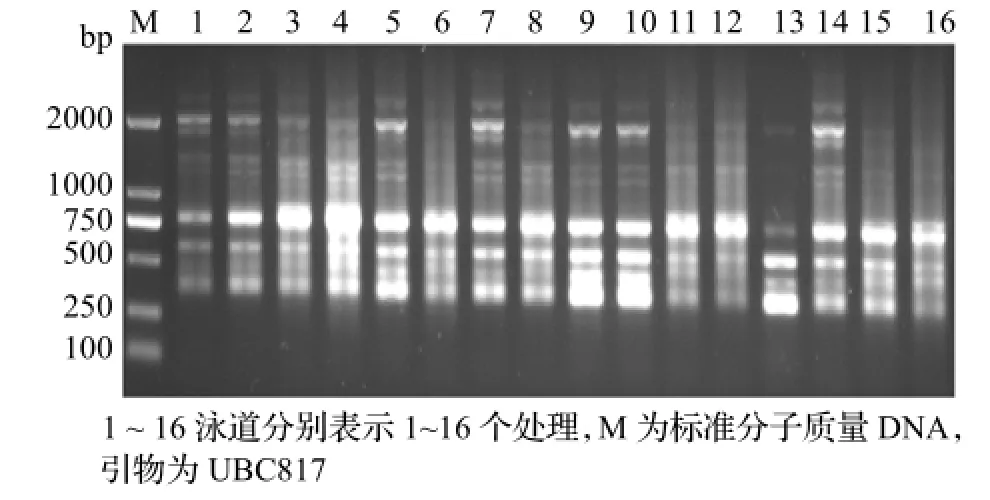
图7 正交试验PCR产物电泳结果Figure 7 Electrophoresis of orthogonal design PCR products

图8 不同退火温度对PCR反应的影响Figure 8 Effect of different annealing temperature on PCR
2.9优化体系的应用
利用上述实验得到优化体系对23份野生伯乐树单株进行ISSR扩增,扩增结果如图9所示,引物UBC823将所有23个单株的带型完全扩增出来,谱带清晰且稳定,表明建立的伯乐树ISSR反应体系是有效可靠的。

图9 引物UBC823对23个伯乐树个体扩增的ISSR带型Figure 9 ISSR profiles generated by prime UBC823 from 23 samples
3 讨论
能否得到高质量的DNA是成功进行分子标记分析的关键一步。伯乐树分布僻远,野外采样时多使用硅胶干燥方法保存,同时由于其叶片含较多的多糖、多酚等成分,使得高质量DNA的获得存在一定难度。实验中采取一般的CTAB法提取,不仅抽提效率低,且多数样品DNA溶液呈黄褐色,PCR时得不到扩增产物。因此,需在常规的CTAB法上作适当改进,首先在液氮研磨时须加入一定量的PVP粉末以抗氧化,且转移要迅速,防止材料暴露过久;其次料液比要控制适当,1 m L提取液加40~50 mg样本即可。
建立稳定的ISSR-PCR反应体系,一般可采用单因素或两因素的完全试验设计[19~20],对各影响因素进行单因素多水平的比较研究,也可采用正交试验设计[21~22],以有效分析不同因素间的交互作用,但缺点是处理水平设置不宜过多。本实验综合了两种试验设计的优点,先对影响PCR结果的主要反应成分进行单因素多水平对比分析,确定各因素水平范围后,再开展正交优化试验,获得了伯乐树适宜的ISSR-PCR扩增体系:20μL体系中含90 ng模板DNA,1.0 mmol/L Mg2+,0.15 mmol/L dNTP,0.5μmol/L引物,0.75U Taq DNA聚合酶。
[1] 黄健锋,陈定如. 珍稀植物伯乐树和半枫荷的生物学特性及园林应用[J]. 广东园林,2008,30(1):46-49.
[2] 王娟,刘仁林,廖为明. 伯乐树生长发育节律与物候特征研究[J]. 江西科学,2008,26(4):552-555,634.
[3] 乔琦,邢福武,陈红锋,等. 广东省南昆山伯乐树群落特征及其保护策略[J]. 西北植物学报,2010,30(2):377-384.
[4] 乔琦,陈红锋,邢福武. 中国特有珍稀植物伯乐树种子的类型和贮藏[J]. 种子,2009,28(12):25-27.
[5] 李坊贞,刘仁林,刘燕. 伯乐树种子萌发与根组织分化规律的研究[J]. 赣南师范学院学报,2008,3:95-98.
[6] 伍铭凯,杨汉远,龙舞,等. 伯乐树种子育苗试验[J]. 贵州林业科技,2006,30(4):39-41,38.
[7] 卢清华,欧斌,赖福胜,等. 伯乐树播种育苗试验[J]. 林业科技开发,2007,21(2):94-95.
[8] 郭治友,龙应霞,肖国学. 钟萼木的组织培养和快速繁殖[J]. 植物生理学通讯,2007,43(1):127.
[9] 欧阳献,李火根. 伯乐树组织培养快繁技术研究[J]. 安徽农业科学,2009,37(28):1 3484-1 3485.
[10] Zietkiew icz E,Rafalski A,Labuda D. Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification [J]. Genomics, 1994(20):176-183.
[11] 沈永宝,施季森,赵洪亮. 利用ISSR DNA标记鉴定主要银杏栽培品种[J]. 林业科学,2005,41(1):202-204.
[12] 李建辉,金则新,李钧敏. 濒危植物长叶榧群体不同年龄级遗传多样性的ISSR和RAPD分析[J]. 浙江大学学报(理学版),2010,37(1):104-111.
[13]邱英雄,傅承新,何云芳. 乐昌含笑不同类型鉴定的ISSR-PCR分析[J]. 林业科学,2002,38(6):49-52.
[14] 宣继萍,章镇,房经贵,等. 苹果品种ISSR指纹图谱构建[J]. 果树学报,2002,19(6):421-423.
[15] 黄福平,梁月荣,陆建良,等. 应用RAPD和ISSR分子标记构建茶树回交1代分子遗传图谱[J]. 茶叶科学,2006,26(3):171-176.
[16] Kojima T,Nagaoka T,Nodak K,et al. Genetic linkage map of ISSR and RAPD markers in Einkorn wheat in relation to that of RFLP markers[J]. Theor Appl Genet,1998(96):37-45.
[17] 吕艳芳,刘桂丰,姜静,等. 五针松胚乳ISSR-PCR反应体系的建立[J]. 植物研究,2003,23(4):429-432.
[18] 冯富娟,王凤友,刘彤. 红松ISSR-PCR实验系统影响因素[J]. 植物学通报,2004,21(3):326-331.
[19] 刘国彬,龚榜初,罗正荣. 锥栗自然居群ISSR-PCR分析技术的建立[J]. 果树学报,2009,26(1):103-107.
[20]张春平,何平,胡世俊,等. 濒危植物峨眉野连ISSR反应体系的建立与优化[J]. 广西植物,2009,29(1):39-43.
[21] 桂腾琴,孙敏,乔爱民,等. 正交设计优化果梅ISSR反应体系[J]. 果树学报,2009,26(1):108-112.
[22] 王钱洁,秦永华,陈厚彬,等. 香蕉ISSR反应体系的建立[J]. 华南农业大学学报,2010,31(1):13-16.
Establishment of ISSR-PCR Reaction System for Bretschneidera sinensis
XIE Zheng-cheng1,LOU Xiong-zhen2,YAO Li-wu1,HUANG Hua-hong2,LIN Er-pei2,LUO Wen-jian3,CHEN Chun-mei1
(1. Qianyuan Forestry Bureau of Zhejiang, Qianyuan 323800, China; 2. Zhejiang A & F University, Lin’an 311300, China; 3. Zhejiang Forestry Seed and Seedling Administration, Hangzhou 310020, China)
The aim of this study was to establish and optim ize the amp lification system of ISSR-PCR forBretschneidera sinensis. 23 samples ofB. sinensisleaf were collected from Qingyuan of Zhejiang province for the test. The influencing factors of ISSR-PCR, such as DNA template, Taq DNA polymerase, M g2+, dNTPs, primer and annealing temperature were optim ized by test of single factor and orthogonal design. The results indicated that suitable ISSR-PCR system forB. sinensiswas established, namely 20 μL reaction system containing 90 ng template DNA, 1×PCR buffer, 1.0 mmol/L M g2+, 0.15mmol/L dNTPs, 0.5 μmol/L primers, 0.75U Taq DNA polymerase. The optimal annealing temperature was 50℃。
Bretschneidera sinensis; ISSR; marker system
S718.4
A
1001-3776(2011)01-0011-05
2010-07-06;
2010-11-17
浙江省重大科技专项“浙江省珍稀濒危林木种质资源收集保存与利用关键技术研究及基因库建设”(2006C12059-4)和浙江省科技重点项目“浙江省珍稀濒危树种现代保育关键技术研究”(2006C22064)
谢正成(1964-),男,浙江庆元人,高级工程师,主要从事森林培育研究;* 通讯作者。
