阿法骨化醇治疗骨质疏松的疗效
——基于骨密度、生化指标和骨折率的Meta分析
2011-05-05李洪超张心科金雪晶初云波符一男马爱霞
李洪超张心科金雪晶初云波符一男马爱霞
阿法骨化醇治疗骨质疏松的疗效
——基于骨密度、生化指标和骨折率的Meta分析
李洪超1张心科1金雪晶1初云波1符一男1马爱霞2
目的:系统评价阿法骨化醇治疗骨质疏松的疗效。方法:以“阿法骨化醇”或“alphacalcidol”为主题词,检索国内外1980~2010年期间发表的相关文献;以Jadad评分标准结合Cochrane简单评价方法评价纳入的研究质量,以Review Manager 5.0.25进行Meta分析。结果:共检索到中文文献107篇,英文文献99篇,符合纳入标准的中文文献有12篇,英文文献13篇;25篇纳入的文献共分拆成29项随机对照研究。阿法骨化醇防治男性骨量流失的效果优于其他药物,而对女性没有明显优势;阿法骨化醇对继发性骨质疏松患者血磷、碱性磷酸酶和骨折率的疗效显著优于其他药物,而对骨密度(BMD)和血钙的疗效没有显著差异,在其他适应证方面没有明显优势。0.5μg/d剂量对BMD和血磷的影响显著。联合用药时,阿法骨化醇组疗效明显优于对照组;阿法骨化醇与安慰剂或空白组比较,在血钙和骨折率指标上有显著的优势;与钙剂比较,在BMD、血磷和碱性磷酸酶上显著优于后者,但其中有联合用药的影响;与其他药物比较,在BMD、血磷、血钙、碱性磷酸酶这四个指标上疗效相当,在骨折率指标上劣于二膦酸盐。结论:本研究证据为较高强度。研究显示,阿法骨化醇对男性骨质疏松患者和继发性骨质疏松有较好疗效;0.5μg/d和0.1μg/d剂量优于其他剂量组;联合用药比单用药疗效更好。阿法骨化醇和安慰剂、空白或钙剂比较,总体上疗效更优;与他药物比较,在BMD、血磷、血钙、碱性磷酸酶四个指标上疗效相当,在骨折率指标上劣于二膦酸盐。
阿法骨化醇 骨质疏松 骨密度 血钙 血磷 碱性磷酸酶 骨折率 系统评价
原发性骨质疏松症是以骨量减少、骨组织显微结构退化为特征,以导致骨的脆性增高而骨折危险性增加的一种全身骨病[1]。具体表现为骨矿物质和基质比例减少;骨吸收和骨形成失衡;骨力学强度降低,使载荷承受力降低而易于发生细微骨折或完全骨折。世界卫生组织(WHO)以骨密度是否低于年轻成人骨量峰值2.5个标准差以上来判断是否有严重骨质疏松[2];日本卫生福利部则建立了以骨量减少、骨折、年龄、腰痛和(或)背痛,以及血钙、血磷、血清碱性磷酸酶为指标的多维评分体系来诊断绝经后骨质疏松[3]。我国骨质疏松的诊断原则主要参考WHO的标准并增加了骨折的指标;若无骨密度峰值资料,则参考日本1996年改版的标准,以骨量流失25%以上及一处或多处骨折来评估严重骨质疏松[1]。
全球骨质疏松患者超过2亿人,1/3的女性和1/8的男性会出现骨质疏松,髋部、前臂和脊椎骨折的综合众生风险约为40%,相当于心血管疾病的风险。根据2003~2006年由卫生部科教司组织的全国骨质疏松流行病学调查估计,中国2006年50岁以上人群中约有6944万人(男1534万,女5410万)患有骨质疏松症,约21390万人存在低骨量(男10043,女11347);60岁以上老年人骨质疏松症发病率明显升高,女性尤其突出[4]。此外,2003年国家卫生部发布的居民慢性疾病患病率调查结果显示,我国骨质疏松症患病率已达8.8%,在所有慢性疾病的患病率中位列第三,仅次于高血压和胃肠炎的患病率,严重影响着人民群众的健康。
目前用于治疗骨质疏松的药物主要有维生素D及其类似物,如阿法骨化醇(alphacalcidol,ALF)和骨化三醇(calcitriol)等,二膦酸盐如阿伦膦酸盐(alendronate)、利塞膦酸盐(risedronate)等,以及降钙素(calcitonin),也可以使用荷尔蒙补充疗法。阿法骨化醇是最早用于骨质疏松防治的药物,其药理作用为减少甲状旁腺细胞的增殖,抑制甲状旁腺激素(PTH)的分泌;增加小肠对钙的吸收,提高血钙水平;反馈性抑制PTH的分泌,从而减少骨钙的流失。近年来出现了很多关于阿法骨化醇的临床试验,但普遍存在方法学缺陷、样本量太小的问题,研究的可靠性不高。国外对阿法骨化醇的Meta分析中罕有纳入中文文献的。因此,为评价阿法骨化醇临床疗效,本研究通过系统评价的方法对国内外公开发表的研究进行Meta分析。
一、材料和方法
(一)文献检索策略
以“阿法骨化醇”或“alphacalcidol”为主题词,检索国内外1980~2010年期间发表的相关文献。以Jadad评分标准结合Cochrane简单评价方法评价纳入的研究质量,以Review Manage 5.0.25进行Meta分析。
(二)文献纳入标准和排除标准
1.纳入标准
(1)随机对照试验(观察期超过3个月)的研究。
(2)研究对象:骨量减少、绝经后和原发性骨质疏松患者、继发性骨质疏松患者以及(肾病等引起的)继发性甲状旁腺功能亢进症患者等患有阿法骨化醇适应证的患者。
(3)干预措施:试验组为阿法骨化醇单用药或联合用药(联用雷洛昔芬或不同形式的钙剂)对照组为安慰剂或空白、钙剂、阿法骨化醇的不同剂量或不同给药途径,其他抗骨质疏松药如阿伦膦酸盐、雷洛昔芬、阿仑膦酸盐以及依替膦酸盐、维生素D等。
(4)产出指标:主要产出指标包括以下任意一项:①骨密度(BMD),包括全身、腰椎(Lumbar spine)、股骨颈(Femoral neck)、掌骨(Metacarpus)、髋部(Hip)、股骨大转子(Trochanter)、全颈(Total neck)、Ward’s三角(Ward’s triangle)、跟骨、尺骨、桡骨末端(Ultra dista radius)以及桡骨末端1/3距离处(Distal 1/3 radius等;②生化指标,包括血钙(Serum Calcium)、血磷(Serum Phosphorus)、血清碱性磷酸酶(Serum Alkaline Phosphatase, ALP);③骨折率。
(5)完整的基线数据,包括产出数据或变化值(与基线的差值),以均值和标准差表示;若无基线数据则需要有基线可比性说明。试验组和对照组样本数据,随访时间。
2. 排除标准
(1)研究为非随机对照试验,如回顾性研究、观察性研究或综述等;
(2)重复发表的研究仅保留最近年份的;
(3)无所需产出指标,或产出以百分比变化值表示;
(4)动物实验研究。
(三)数据提取
根据Cochrane系统评价员手册推荐的指南,结合本研究目的和质量评价要求使用Microsoft Excel 2010制作数据提取表。提取数据主要包括:
(1)文献情况:作者、发表年份和研究设计等。
(2)方法学质量评价指标:是否随机、是否盲法、失访/退出描述情况、是否分配隐藏和基线可比性等。
(3)研究对象:受试者纳入和排除标准、样本量、失访和退出人数、年龄和性别比等。
(4)干预措施:药物、剂量、给药途径和疗程等。
(5)研究结果:骨密度,生化指标产出(或变化值)数据,骨折发生率。
(四)方法学质量评价
以随机、盲法、失访/退出、分配隐藏和基线可比性五项指标评价纳入研究的方法学质量。其中,随机、盲法和失访/退出用Jadad评分标准(表1)进行评价,5分为高质量研究,3~4分为较高质量研究,1~2分为低质量研究。分配隐藏和基线可比性按照简单方法评价。分配隐藏分为四级:方法正确(Adequate)为A级,不清楚(Unclear)为B级,方法不正确(Inadequate)为C级,未实施(Not Used)为D级。基线可比性分为三级:报道并可比性良好为A级,不清楚为B级,基线不可比(有显著差异)为C级。因为Jadad评分标准更加细化,因此Meta分析过程中以Jadad得分为分组依据而不考虑分配隐藏和基线可比性,分配隐藏和基线可比性仅作为衡量各项研究可能发生偏倚的危险程度。
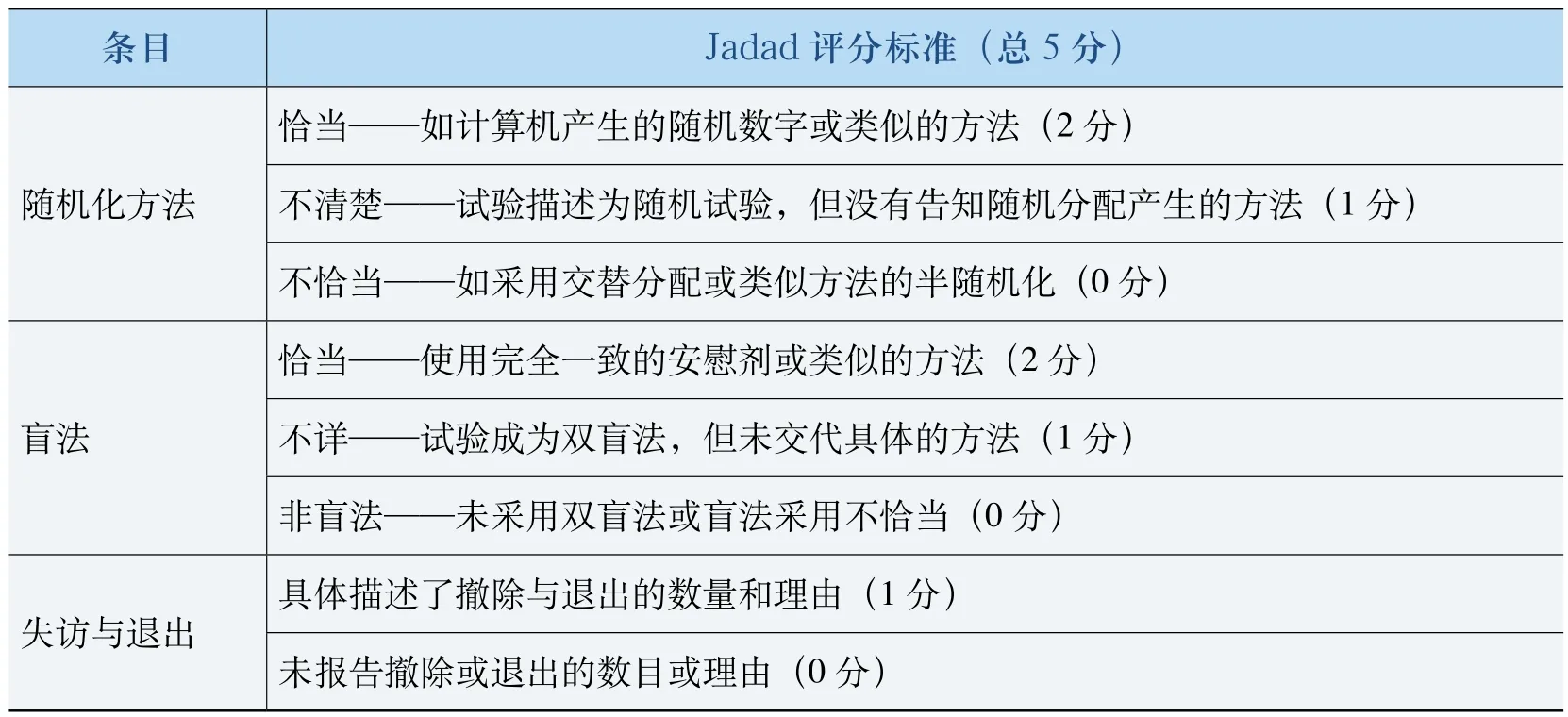
表1 Jadad评分标准
(五)统计方法
使用Cochrane Collaboration提供的Review Manager (RevMan) 5.0.25进行Meta分析,除研究中具体说明以ITT原则分析外,其余均使用PP原则进行分析。如果计数资料中事件发生数为0,RevMan自动调整为0.5;若两组事件发生数均为0,则手动调整为1,敏感性分析表明结果不影响统计显著性检验。
参考WHO和日本的骨质疏松诊断原则,以骨密度(BMD)、血钙(Ca)、血磷(P)、碱性磷酸酶(ALP)和骨折率作为产出指标合并分析。根据研究间临床异质性来源和特征,按疾病类型、性别、疗程、干预、治疗模式、对照类型和研究质量划分亚组,分析阿法骨化醇的疗效。
1.效应量和置信度
对BMD、Ca、P和ALP四项连续型变量,采用标准均数差(SMD)作为效应量;骨折率为二分类变量,使用风险比(RR)作为效应量合并分析。合并效应量检验的显著性水平(α)为0.05,异质性检验显著性水平为0.1。总体和各亚组估计值以点估计值和95%置信区间(95%CI)表示。
2.异质性分析
纳入的研究若存在明显的临床异质性,如研究对象、干预措施、疗程等显著不同,则原则上不直接合并而分亚组分析。亚组内,统计学一致性采用卡方检验和I2统计量判断是否有异质性,若P>0.10,则认为没有异质性,若P<0.10,则认为研究间具有异质性;若I2<25%则异质性较小,25%<I2<50%则存在中度异质性,若I2>50%则认为各研究间存在实质性的异质性。
3.模型选择
最新的研究[5]认为,首先使用固定效应模型合并分析,当异质性检验显著时再使用随机效应模型的做法是错误的。统计模型的选择,即使用固定效应模型还是随机效应模型不应该基于统计学异质性分析结果(特别是当统计学检验效能较低的时候),而应当仅仅基于纳入的研究是否具有相同的效应(common effect)。原则上,使用固定效应模型必须满足两个条件:一是纳入的所有研究都具有相同的效应;二是Meta分析的目的是为同一人群计算效应值(effect size)。也就是说,所有变量(例如研究者、剂量、干预措施等)对于各项研究的影响是一致的,并且得出效应值只能应用于所纳入研究的受试者同一总体人群。然而一般的系统评价中,所纳入的文献都是收集的研究者独立进行的随机试验,受试者和干预措施等因素都会有很大的不同,会对结果产生显著的影响而不会有同样的效应,因而随机效应模型更加合适。即使在异质性检验结果不显著的情况下也应当考虑研究间的变异。在本研究中,由于对纳入研究的受试者没有严格的设定,各研究间的异质性很大,因此在选择模型时,按照上述原则当同效应和无统计学异质性同时满足或者有特殊情况(例如按照Cochrane系统评价员手册,变化值数据和产出数据仅能用固定效应模型合并)时才使用固定效应模型,大部分情况下均使用随机效应模型。
4.敏感性分析
本研究中可能影响结果的主要因素(如低质量研究)都以亚组合并分析,当亚组内出现异质性时,以敏感性分析寻找异质源,评价异质性研究对结果的影响。
5.发表偏倚
以RevMan软件自动生成漏斗图来评价发表偏倚。当漏斗图呈现倒置的对称漏斗形时,认为没有发表偏倚;而出现非对称情况时,提示可能存在发表偏倚,但也可能是因为研究量较小等因素引起。
二、结果
(一)研究描述
1.文献检索结果
按照前述检索策略实施文献检索,共检索到中文文献107篇,英文文献99篇,符合纳入标准的中文文献有12篇,英文文献13篇;排除的文献类型有病例研究(n=10)、流行病学研究(n=5)、无临床对照研究(n=11)、药理研究(n=13)、动物实验(n=13)、综述(n=70)、非本目标药物(n=22)以及无相关指标数据的研究(n=37)等。根据研究的具体情况,25篇纳入的文献一共分拆成29项随机对照研究。
2.各研究的基本特征
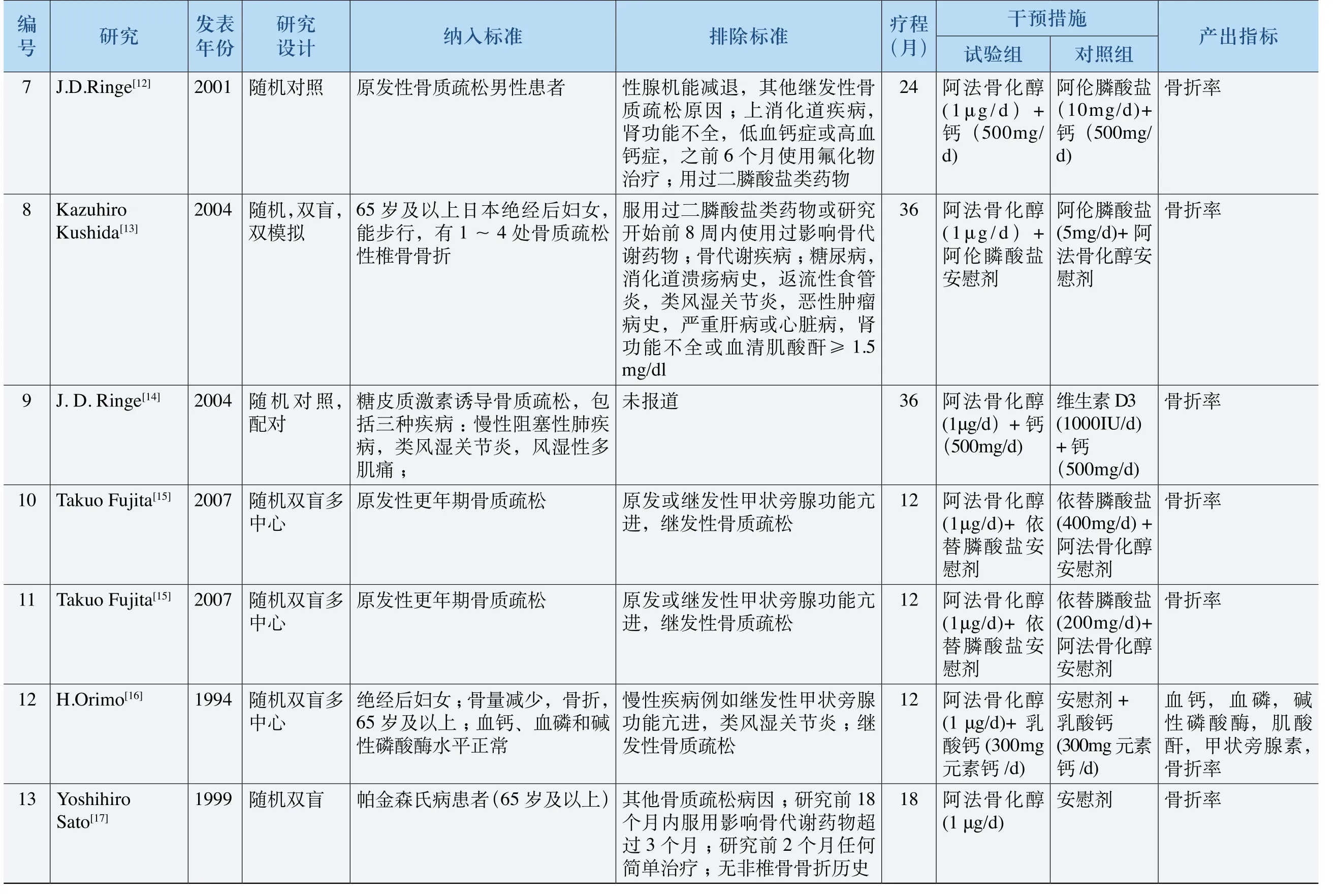
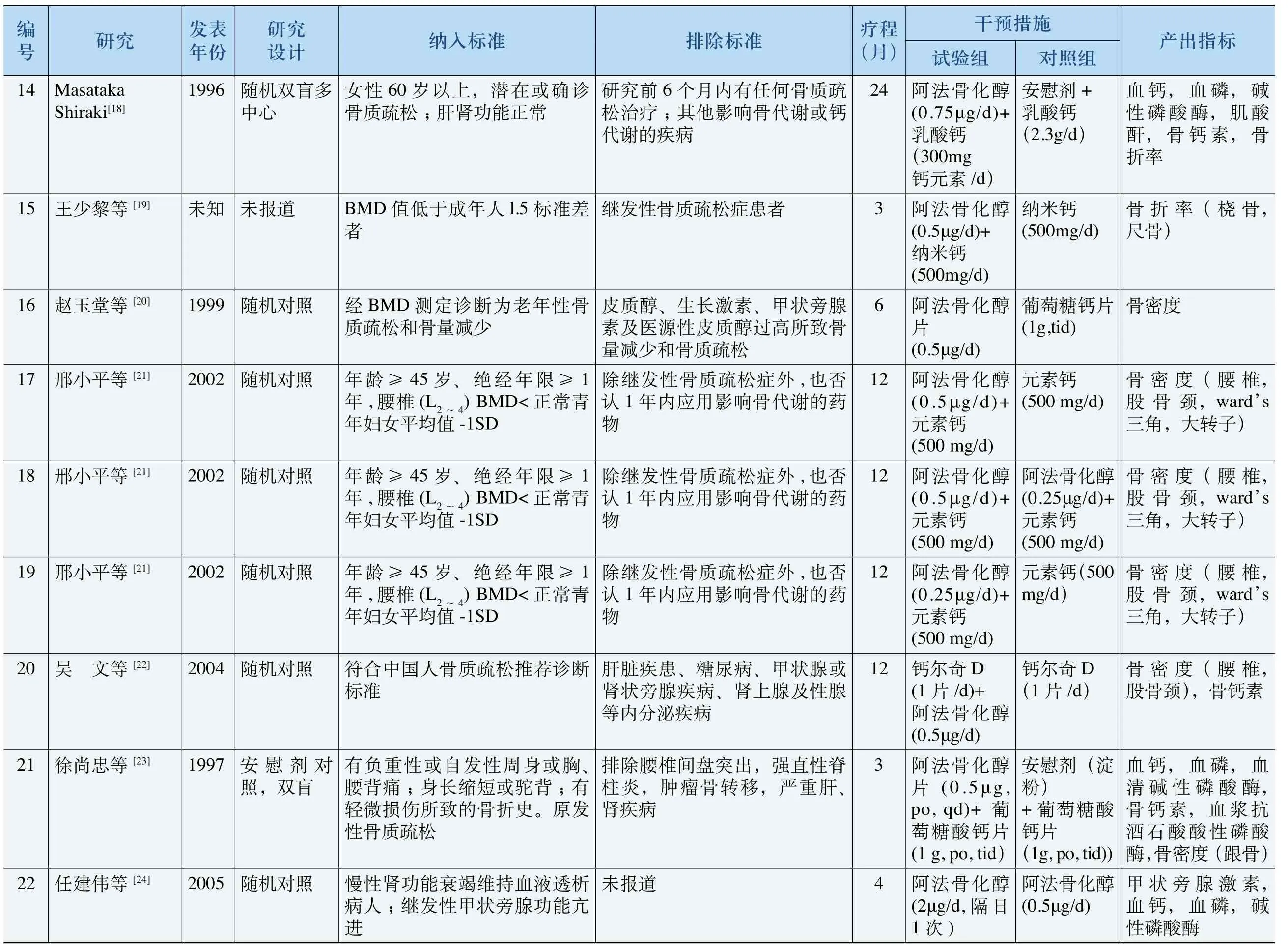
纳入的25篇拆分成29项随机对照研究的基本特征如下(详见表2):
(1)年份和试验设计:所纳入的29项随机对照试验发表于1997~2010年,一项发表年份未知。所有研究均为随机对照试验,其中安慰剂或空白对照一共7项,阳性对照一共22项。
(2)观察对象:19项试验研究对象为绝经后骨质疏松患者或老年性骨质疏松症患者,4项为继发性骨质疏松症患者,4项为慢性肾衰、终末期肾病、肾移植或伴有继发性甲状旁腺功能亢进症患者,1项甲状腺亢进症患者,1项帕金森氏病患者。
(3)干预措施:10项试验的试验组单用阿法骨化醇(或联用对照组药物的安慰剂),其余19项均为联合用药(1项联用雷洛昔芬,其余均为不同形式的钙剂);对照组药物除安慰剂和空白外还包括阿仑膦酸盐、依替膦酸盐、维生素D以及阿法骨化醇的非正常剂量。疗程从3个月到36个月不等。
(4)产出指标:主要包括骨密度,一系列生化指标如血钙、血磷、碱性磷酸酶、Ⅰ型胶原N末端肽(NTX)、骨特异性碱性磷酸酶(BAP)、骨钙素(BGP),以及骨折率等。
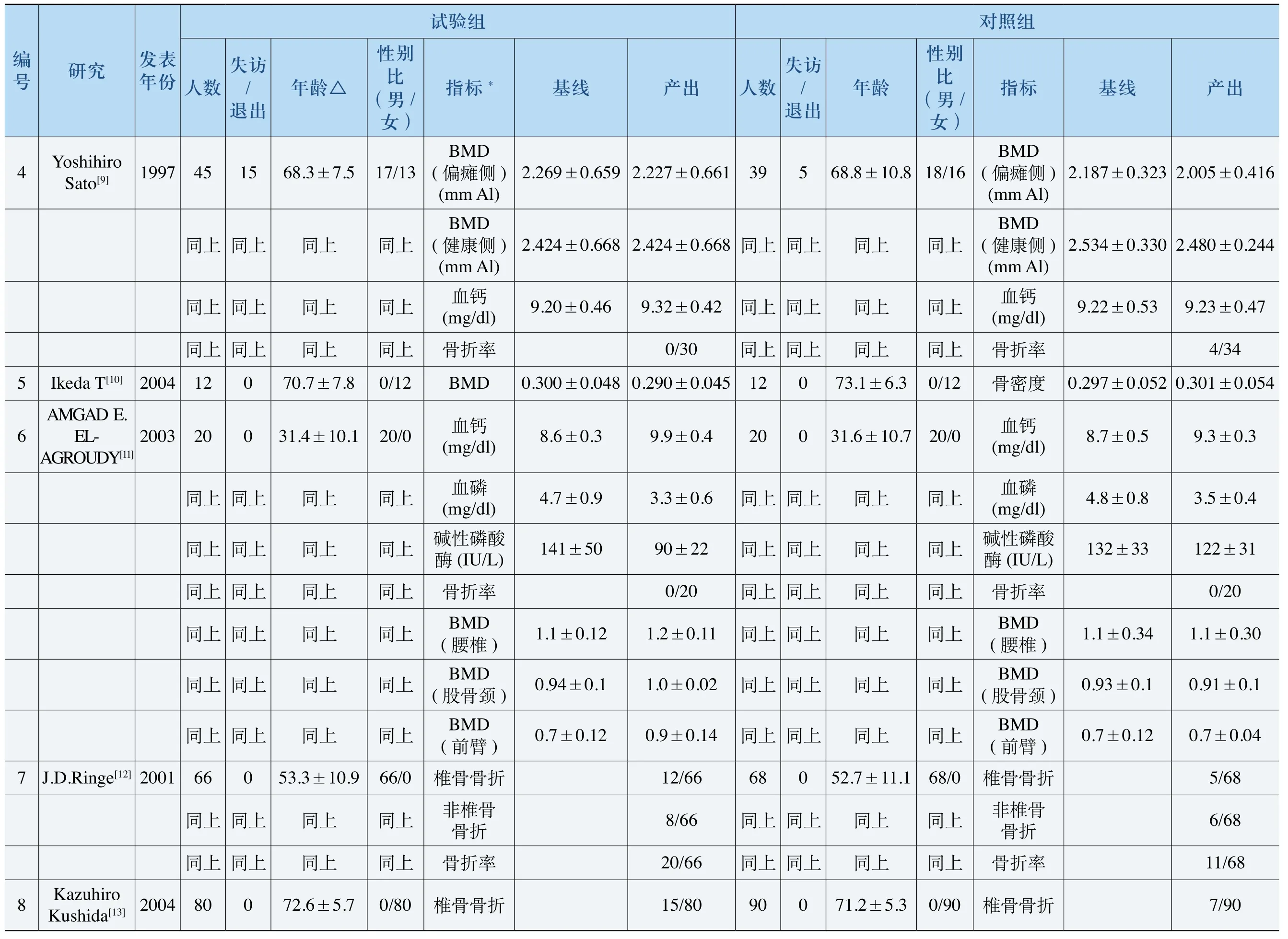
(二)纳入研究的质量评价
所纳入的29项研究中,所有研究都是随机对照试验。其中8项研究(6篇文献[7,16-18,21,27])描述了正确的随机化方法,3项研究(2篇文献[6,29])使用了错误的随机化方法,其余18项研究仅仅提到使用随机分组而未描述具体的随机化方法。4项研究(3篇文献[9,13,15])采用双盲法并描述了正确的设盲方法,1项研究[23]报道使用双盲法但未描述具体的方法,其余所有研究均未提到使用何种盲法或者未使用盲法。8项研究[19,20,22,24-27,30]没有报告失访或退出的数量或理由,其余研究均详细报道了失访或退出的例数和理由。
除以上Jadad评分指标外,统计了分配隐藏和基线可比性的情况。4项研究[7,16-18]使用了正确的分配隐藏方法,其余研究均未报道是否实施分配隐藏;除7项研究[20,22,23,26-28,30]未报道基线可比性统计结果外,其余研究均明确报道了基线各指标(年龄、性别比、骨折率和BMD基线水平等)的可比性。本研究分析的所有指标均有良好的基线可比性,各研究的详细指标见表3(本表中只包含了各研究中最常用的指标)。
根据Jadad评分标准,各研究质量评分见表4(加入分配隐藏和基线可比性的简单评价结果以供参考)。
(三)阿法骨化醇的疗效评价
参考我国和WHO以及日本的骨质疏松诊断标准,以骨密度、血钙、血磷、碱性磷酸酶和骨折率作为评价阿法骨化醇疗效的主要指标,结合骨质疏松患者特点和临床治疗措施情况,将不同疾病、不同性别比、不同疗程、不同剂量、不同用药模式和对照组情况等6方面划分成不同亚组进行评价。各亚组的研究指标见表5。
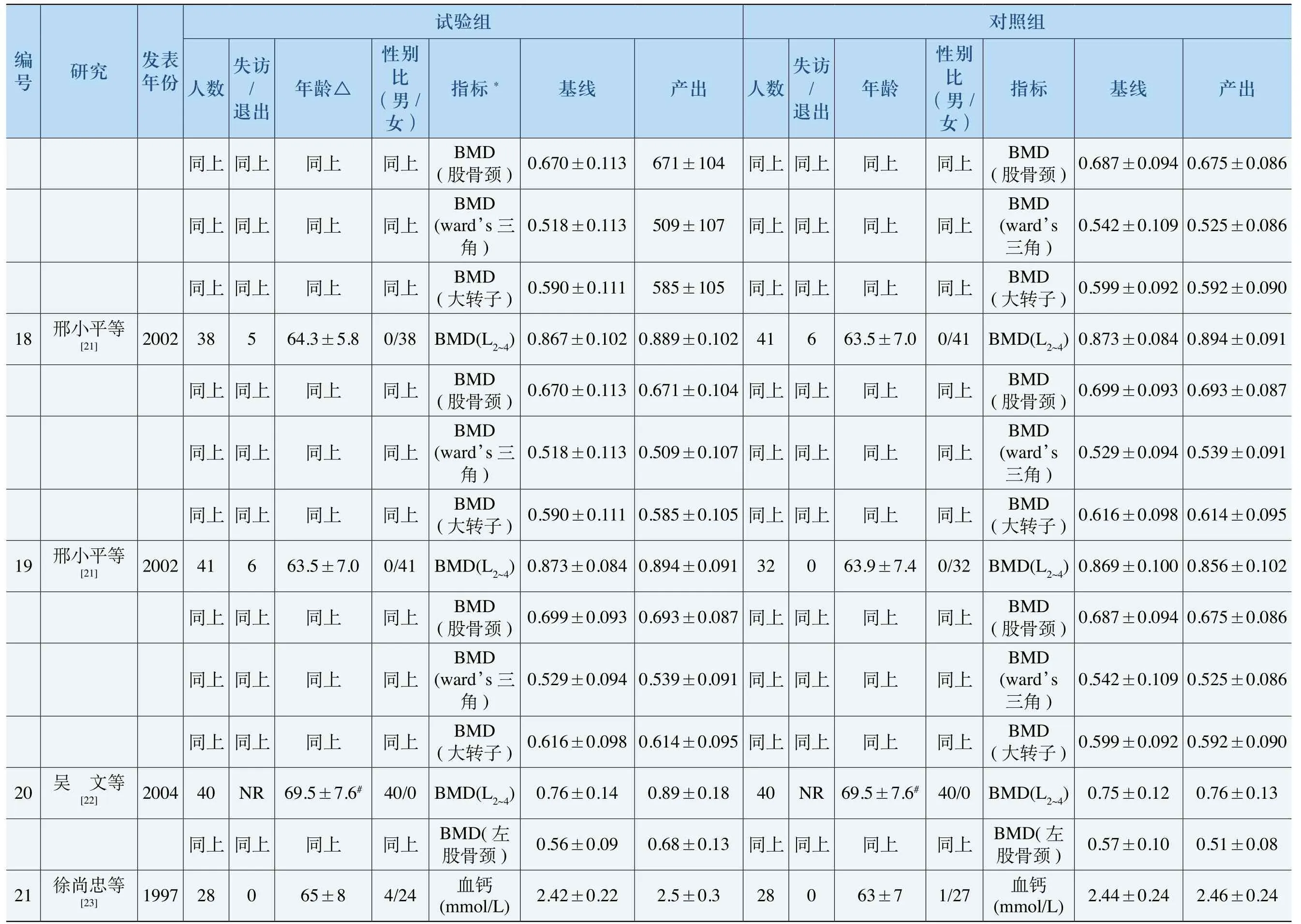
碱酸,素标,肌腺指磷,旁出血酶状产 率 率 率 率 率 ,酸甲率率折折折折折钙磷,折 折骨骨骨骨骨血性酐骨 骨盐阿安盐组盐D3(500mg/ /d)盐)+醇阿(5mg/d)+醇酸g/d)+素化 酸/ d酸+元素0IU/d)照膦(500mg膦伦0m膦酸化骨剂膦m g化骨剂剂钙 剂施 对 伦 骨剂替生钙d)钙法慰 替0 0法慰/d)慰酸 慰措 阿(1 /法慰 维(100 +依(400mg/d) +醇阿安依( 2阿安 安乳(300mg钙安预干 醇 醇 醇钙 醇依安 醇依安 醇乳 醇组化)+骨/d 00mg化)+盐酸化化) /d化验骨/d骨化)+盐 化) +盐(300mg骨试法μ g瞵剂骨/d酸 骨/ d酸 骨g/d)+阿(1 μ钙素(5法μg g/d)阿(1钙d)阿(1阿安伦慰 阿(1μg/d)+法法μg膦剂阿(1替慰 阿( 1替慰法μg膦剂法 法钙阿(1 μ酸元程月)(500mg/d)疗24 36 36 12 12 12 18(骨, 究代,亢亢腺继18超何性病血物 病管瘤肾史发疾高化物 研骨尿食肿,≥1.5能能旁; 前物任历继道症或氟 或响糖性性病药功功状炎 究药月折用类 物影;流恶脏酐 腺 腺 甲节 研谢个骨准 他化钙使 药过病返,心酸其消血旁松盐旁松 性关 ;代2骨标类用月酸 疾,炎或肌 状疏 状疏 发湿 因骨前椎除 ,上低个膦 盐使谢史节病清 甲质 甲质 继风 病响究非排 退;减因全,6酸内代病关肝血二性骨 性骨 如类松 松影研疏用;;膦周能原 二8;溃风严全 发性前过发性 例,不之疏骨疡湿重或无机松能继发用继发 病进质 质服月疗腺疏功症,; 过前用始药化,史能服开谢消炎病功mg/dl物道类,不 道 或继 或继 疾亢骨 骨内个治疗报发, 发, 性能性 他月3单性质肾钙治未原进 原进 慢功发 其个过简,女松 包疾多,折碱 )上妇疏 ,肺性者质松性湿骨和 以患后骨 疏塞风 松 松 少血,磷 及性经处 质阻, 疏 疏 减、 岁准标 男 绝4骨性炎 质 质 量钙常入 松 本 导慢节 骨 骨 骨血(65者纳 疏 日1~诱:关 期 期 ;;正女上水上有 素病湿平患质折年年病骨以,骨 激疾风 更 更 妇以酶 氏性及行骨 质种类; 性 性 后及酸 森发岁步65能性椎皮三,痛 发 发 经岁磷 金原糖括病肌 原 原 绝6 5性 帕盲多,照多照,盲究计 双盲对盲盲,拟研设 对双双双多双机机模 机对 机心 机心 机心 机随随双 随配 随中 随中 随中 随份发表年2001200420042007200719941999究ge[14] J.D.Ringe[12] shida[13] ujita[15] ujita[15] ]研Kazuhiro in o[16 Ku . R J. D Takuo F Takuo F H.Orim Yoshihiro Sato[17]编号7 8 9 1 0 11 12 13
碱酸骨 , , ,,,s血, ),,肌, 骨 椎 ) 椎 ) 椎 ) 椎素 酶抗酸骨素碱标桡腰ard’s腰ard’s腰ard’钙 , 浆磷跟 ,指 磷,素转转转 腰骨 磷酸血性 激磷出 血酶钙 ( (,w子度颈大 (,w子度颈大 (,w子(度颈大 度), 血磷 (腺血,性素酸密,酸骨酶,酸度产率旁,钙磷 ) 度 , , , 颈酸,率 折骨 密 密骨角 密骨角 密骨角 密骨 钙碱钙石,骨 状钙磷血性酐折 骨尺 骨 骨股三 骨股三 骨股三 骨股 血清骨酒酶 甲血性醇组+ D淀酸 醇片化钙照钙g/d) /d)剂钙化g/d)+糖g/d)葡(1g,tid)(500骨5μ钙钙.3g/d)奇/d)剂糖 骨萄慰酸元(500 m施对钙mg阿(0元(5素纳(500米元mg/d)法法.2素 素 尔片(萄00 m措 安乳慰)+葡片钙安粉 钙 阿(0.5μg/d)预化g/d)+(2(1 ,(1g, po, tid))干醇 醇 醇/d)化/d(300mg /d)化)+纳(500mg/d)醇)+醇)+醇醇 醇 醇日组化化/d D化μg葡片化隔验骨/d骨化g/d)+ g/d)骨 骨. 5 d)+钙酸骨阿(2μg/d )骨5μ钙素阿(0.5μg钙阿片(0.5μg骨μg阿(0元(500试法. 7酸 法 法 法. 5钙mg/d)骨μg法.5阿(0元(500钙mg/d)骨5μ钙(500 m奇/d)+化) (0.5μg/d (0阿片p o阿(0乳元 米 素 素 阿( 0元法.2素 尔片法钙(1阿法, q糖g, po, tid),法钙萄(1次1程月)疗24 3 6 12 12 12 12 3 4(疏钙腺骨 否药 否药 否药 或腺 脊、质或旁致腺性 性肝骨谢状所,也的谢,也的谢,也的谢 状及 直重何代 者 甲高 外代 外代 外代 甲腺 强严准 任骨 患 、过 症骨 症骨 症骨 、上 ,,标 有响 症 素醇松 松响 松响 松响 病肾 出移除 内影 松 激质疏 疏影 疏影 疏影 尿、 突转排 月他长皮 质用 质用 质用 糖病 盘骨个其 疏 质病6;病 质 生性骨 骨应 骨应 骨应 、疾 间瘤疾疾性内、源和骨椎肿前疗醇医性内 性内 疾旁的患腺泌 腰,究治 性 少质及 继1发年 发年 发年 分 病 道谢继1继1脏状 除炎研松代 发 减内疾报继皮素量 除认物 除认物 除认物 肝肾等 排柱肾 未诊差骨青断、有发 析亢确准 性≥1≥1青 ≥1青常诊常胸;或背 透能标或常年 限正年< 限正常 限正原荐身驼史液功在正年<l.5年<。老推血腺准 潜能 人 为 经M D经M D经M D松 周或折 持旁标 ,功 年 断少 绝 绝 绝 疏 性短骨 维状入 上肾 成 诊减 、4) B-1SD、4) B-1SD、4) B-1SD质发缩的 竭甲纳 以肝定量 岁 值 岁 值 岁 值 骨 自长致 衰性岁; 于均均均 人 或身所松 能发60松低 测骨国D和值≥45 (L2~椎平≥45 (L2~椎平≥45 (L2~椎平 性;重痛损功继性质疏D BM松 龄,伤疏质龄,腰女 腰女 龄,肾;妇中妇疏腰女妇 合准 负背微骨 性人女骨B M者 经质 年年年 年年年 年年年 符标 有腰轻性 慢病进多对究计 盲照 照 照 照 照 剂盲 照研设双 道 对 对 对 对 对 慰,双对机心 报 机 机 机 机 机机随中 未 随 随 随 随 随 安照 随份发表年1996知未20022002[20]1999 [21]2002 [21] Masataka [22]2004 [23]1997 [19] [24]2005研究等等iraki[18]等等等等[21]等等黎平堂少平文平忠伟Sh玉小 小 小尚建王赵邢 邢 邢 吴 徐 任编号1 4 15 16 17 18 19 20 21 22

NTX :Ⅰ型胶原N 末端肽; BMD :骨密度;qd :一日一次;bid :一日二次;tid :一日三次;po :口服

表3 各研究详细指标数据
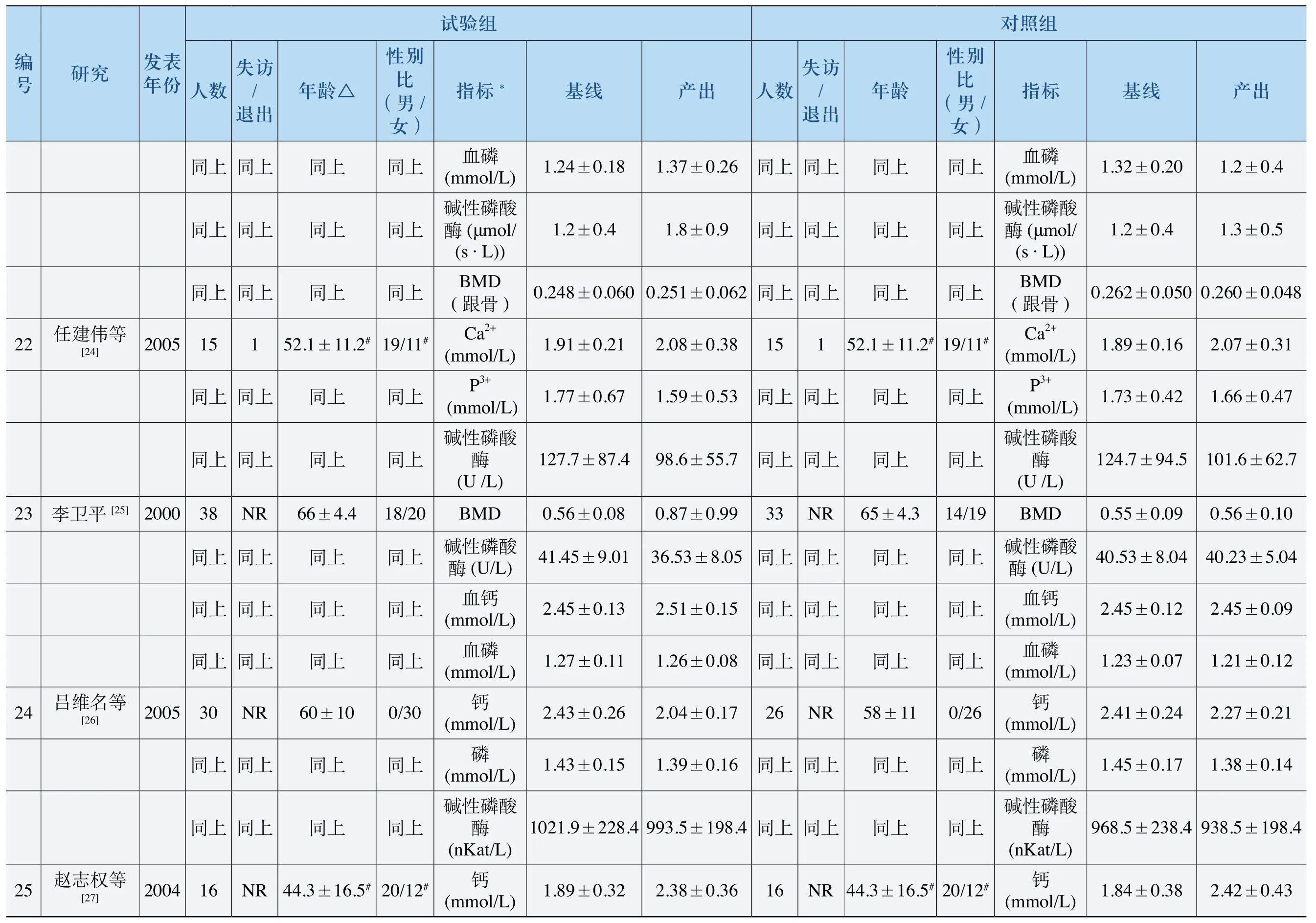
.1出0.30.4310.300.04产05±0.41680±0.244 9.23±0.474/3401±0.0549.3±3.5±2±0/205/68 6/68 11/68 7/9002.4线0.3232.00.330.0520.30.50.833120.341.1±0.120.7±基±0.539.228.7±4.8±132±1.1±0.93±0.10.91±00.7±2.187±2.534±0.297±BM瘫m Al)) BM康m Al))酸) ) D侧标折D侧折钙g/dl)组率度率磷D颈钙g/dl) D臂骨 骨折 率磷g/dl)骨指折性(IU/L)椎照血(m )血折D椎血偏密( (m健BM折腰BM骨BM前骨 骨对( (m骨骨( m (m碱酶骨(股( (椎非骨骨 椎/ )上 上 上 上 上 上 上 上 上 上 上性别比(男女同 同同31.6±10.72同 同同同 同 同68/0同同68.8±10.818/160/0上龄上.30/1273.1±6±11.1 .30/90上上 上上上 上 上 上上年同 同同 同 同同同 同 同52.7同同71.2±5出5上上访/退上上 上上上 上 上 上上同 同 同0 0同 同 同 同 同 同0同 同0失数上 上上 上上20上上 上 上 上上同同同同同同人同同 同6 8同 同9 0613927±0.66824±0.629.32±0.44512出0.40.60.11 0.02 0.14产0/300/20/668/66/66 /80 .2 .490±0.0.29.9±3.3±12 20 15 .11.0±线0.65920.66820.04800.30.95090±220.121.2±0.120.9±基2.269±2.424±9.20±0.460.300±8.6±4.7±1± 141.1±0.94±00.7±BM瘫m Al)) BM康m Al)) ) *酸D椎D侧D侧 钙g/dl)率D钙g/dl)磷g/dl)性(IU/L)率) )折 折组磷D颈D臂骨骨 率 骨标指验折BM折BM血( (m折BM骨健血( (m (m血骨BM (m腰(m碱酶前骨(骨股折骨(偏椎骨试(椎非 骨椎别比(男女/ )上 上 上/ 0上 上上上 上 上/ 0上 上性同 同同2 0同 同同同 同 同6 6同 同△0.10.9龄±7.517/13上 上上±7.80/12上 上上上 上 上 上上±5.70/80年.3 68同 同 同.7 7031.4±1同 同同同 同 同53.3±1同 同.6 72出15上 上上访/退上 上上上 上 上 上上失同 同 同0 0同 同 同 同 同 同0同 同0数45上 上上 上 上上上 上12上 上上同同同20同 同同同 同 同6 6同 同8 0人份1997200320012004发表年Yoshihiro ] Y[11]究D E.研Sato[9 a T[10]2004 Iked GA -UD inge[12] AM EL RO .R Kazuhiro Kushida[13] AG编号4 5 67J.D8

2§ 2§出29.00.13 0.110.102产68/1019/1129/1020.03±0.50.08±0.58/28 8/408.84±0.643.54±0.420.8± 6/421±14±0.035 0.856±线66-1±50§44.4150.110.37 0.100.370±0.0410.6基±0.499.31±0.513.61226±±2.461.89±0.418.99±0.513.62161.1±0.368±0.364±±0.100磷U/ml)0.610±酸折酸) )4)0.869组 标 率率率骨 率 磷 率D骨D骨D照 指 折 折 折钙g/dl)血磷g/dl)血 性( m骨 折 钙g/dl)血磷g/dl)性(IU/L)折BM桡BM尺BM D(L2~对骨骨骨( m (m椎骨( m血( m碱酶骨( ( B M碱酶别比(男女/ )上上性同同83/0/12568±97/126.30/42 .50/55 .50/55 .50/2667±910.30/5672.0±7.40/32龄上)#60.3±9.9136/65上.60/4271.1±7.318/25同8/28#年同70.9±372.9±772.9±772.9±772.5±772±11.6166(60~7063.9±7出13 23 31 2上 上访/退失同 同1 4 3 3 7 38 18 14 NR NR 0数1015 13 3 13上上同42人同43 55 55 56 32 0322/11022/1109§425 8 .1263683出.50.59§34§470.1014 0.130.102产32/10.13±0-0.11±2/25 1/409.36±0.63.50±0.55.7± 2/3729±0.0.60.889±线61-18±39.6130.090.397± 0.110.396±0.0450基9.41±0.423.58±0.525± 221.24±2.399.06±0.483.65±0.56140.1±0.365±0.368±0.601±*酸折酸4)0.867±0.102)标组率率率 磷U/ml)骨率率钙g/dl)磷D骨D折磷g/dl)折指性(m验折折钙g/dl)磷g/dl)性(IU/L)折D骨)骨 骨 骨血 血 骨 血 血B M桡B M尺B M D(L2~试(m (m椎骨( m (m碱酶骨( ( B M碱酶别比(男女/ )上上性8/65同同136/083△.7龄±86/132 ±86/132 ±7.00/38上上±7.20/38 ±2.917/26 ±6.20/54 ±6.20/53 ±6.20/23 ±7.30/57 0~±5.80/38年60.1±966 66 .9 70同 同.7 70 .5 70 .9 71 .9 71 .9 71 .1 7072±11.6#18/28#66(6 70)#.3 64出14 28 28 4上 上失访/退同 同1 3 3 3 1 30 16 20 NR NR 5数10313813838上上同 同3 8 43 54 53 23 57 3213638人份2004200720071999知1996表年未19992002994发究. e[14]等o等o Taku等黎Fujita[15] J. D Taku Fujita[15] o[16]1堂平研Ring H.Orim Yoshihiro Sato[17] Masataka Shiraki[18]少[19]玉[20]小[21]王赵邢编号9 1 0 11 12 13 14 15 16 17
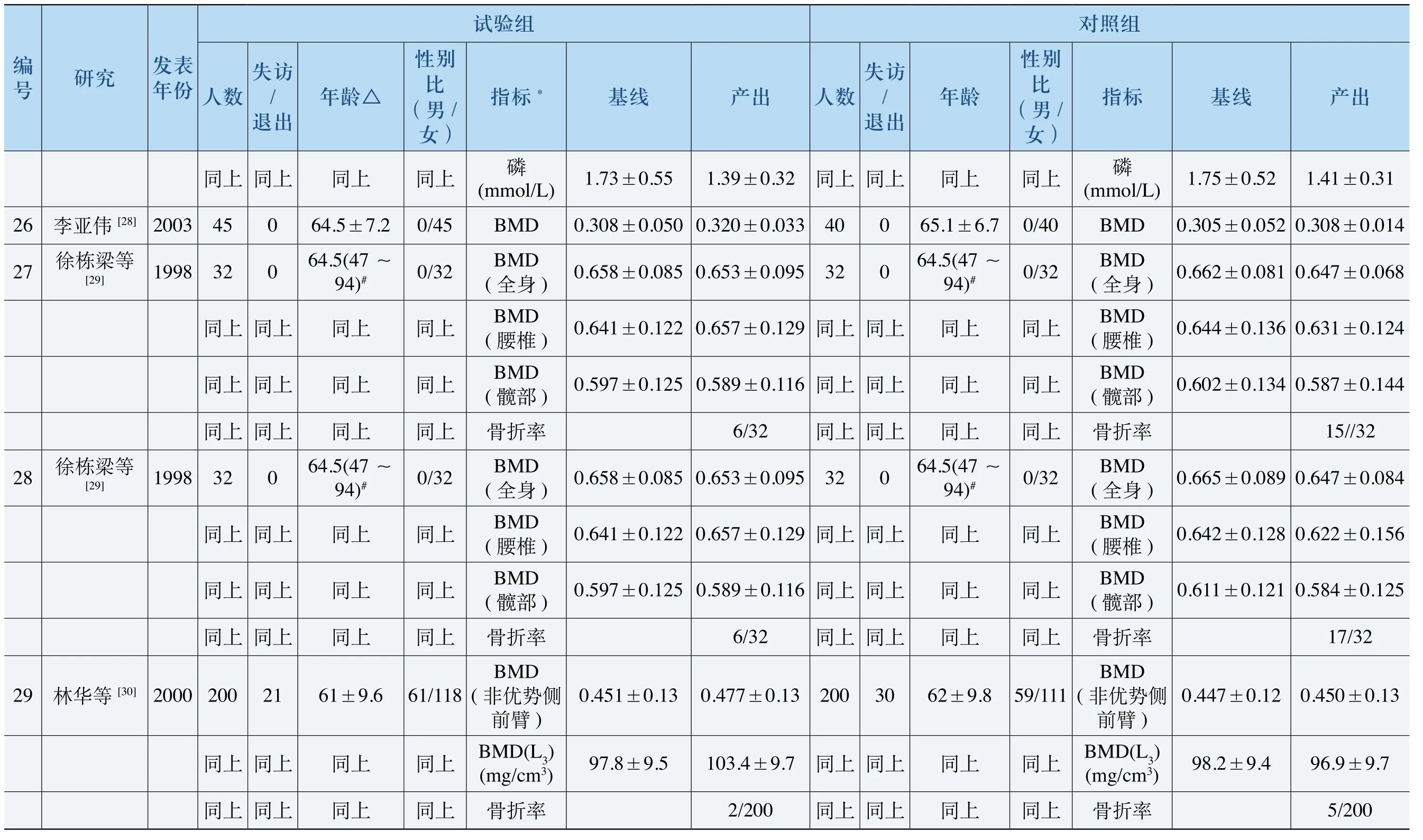
出0.0910.102产0.894±93±0.08739±0.0910.856±75±0.08625±0.08692±0.0900.51±0.082.46±0.2440.675±0.08690.525±0.08620.592±0.09030.640.580.614±0.09540.690.520.5线0.090.100.090.090.090.090.090.100.090.120.76±0.13基±0.084 ±0.100 .75± ±0.100.57±0.242.440.687±0.542±0.599±0.699±4)0.8730.529±0.616±4)0.8690.687±0.542±0.599±) ) ) ) ) )4)0左)组 标D颈D D子D颈D D子D颈D D子 钙照 指B M骨B M ard’s )角BM转D(L2~BM骨BM ard’s )角BM转D(L2~BM骨BM ard’s )角BM转D(L2~D(颈骨血mol/L)对股( ( w三 大( B M股( ( w三 大( B M股( ( w三 大( B M BM股(m / )上 上 上 上 上 上 上 上 上 上性别比(男女同 同 同 同 同 同 同 同 同40/0同.00/41 .40/32龄 上上上 上 上上 上上上 上年 同同同63.5±7同 同同63.9±7同同同±7.6# .5 69同63±71/27出上 上访/退上上 上上 上上上 上失同 同 同6同 同 同0同 同 同N R同0数 上 上 上 上 上上 上上上41上同同 同 同 同 同3 2同 同 同4 0同2 8人04 07 87 91 95 8 3出104107105 0.1020.0910.3产671±509±585±0.889±71±0.1.609±0.1.585±0.105 0.894±93±0.0.639±0.0.514±0.0.60.89±0.10.68±0.12.5±线0.1130.1130.1110.11300.11300.1110.50.09300.09400.0980基0.670±0.518±0.590±0.670±0.518±0.590±0.699±0.529±0.616±0.76±0.140.56±0.092.42±0.22) ) ) ) ) ) *三4)0.867±0.102三4)0.873±0.084三4)左)组D颈D D子D颈D D子D颈D D子 钙l/L)验 标B M骨B M ard’s )角BM转D(L2~BM骨BM ard’s )角BM转D(L2~BM骨BM ard’s )角BM转D(L2~D(颈骨血m o试 指 股( ( w大( B M股( ( w大( B M股( ( w大( B M BM股(m别比(男女/ )上 上 上 上 上 上 上 上 上/ 0上性同 同 同 同 同 同 同 同 同4 0同△龄 上上上±5.80/38上 上上±7.00/41上上上 上±84/24年 同 同 同.3 64同 同 同.5 63同同同69.5±7.6#同65出上 上访/退 上 上 上 上 上 上 上 上失同 同 同5同 同 同6同 同 同N R同0数 上上上 上 上上 上上38上上同 同 同 同 同 同4 1同 同 同4 0同2 8人份2002200220041997发表年究等等等等平平文忠研小[21]小[21] [22]尚[23]邢邢吴徐编号18 19 20 21
出0.40.562.75.04产1.2±1.3±60±0.0482.07±0.311.66±0.471.6±0.56±0.103±2.45±0.09 1.21±0.12 2.27±0.21 1.38±0.142.42±0.4394.510.28.4938.5±198.4线±0.200.4 0.0500.2±0.16 ±0.42 ±0.098.044023基1.321.2±1.891.73124.7±0.55 40.53±±0.122.45±0.071.23±0.242.41±0.171.458.5±±0.381.840.262±96酸)酸)酸)酸组 标 磷磷mol/ )) D骨 磷/ L D磷/ L钙 磷 磷照 指血mol/L)性(μ ·L BM跟Ca2+ mol/L) P3+ mol/L) BM性(U血mol/L)血mol/L)钙mol/L)磷mol/L)性酶 钙mol/L)对(m碱酶( s ( ( m (m碱性酶(U碱酶( m (m (m (m碱(nKat/L) (m / )上 上 上 上 上 上 上 上 上 上别比(男女性同 同 同 同 同 同同同0/26同同上龄2#上 上 上 上 上上上 上 上同年同同同同65±4.314/19同 同同±11 58同同6.5#20/152.1±11.2#19/11#44.3±1访/退出上 上 上 上 上 上上上 上 上失同 同 同1同 同N R同同 同N R同同N R数 上 上 上 上 上 上上上 上15上同同 同 同 同3 3同 同 同2 6同 同1 6人6 62 8 3 9 5 8 7 6 6出0.98.05198.4产1.37±0.21.8±51±0.0.22.08±0.31.59±0.50.87±0.9.53±2.51±0.1 1.26±0.0 2.04±0.1 1.39±0.1993.5±2.38±0.3线0.40.060087.498.6±55.79.0136基1.24±0.181.2±0.248±1.91±0.211.77±0.67127.7±0.56±0.085±41.42.45±0.13±0.111.272.43±0.261.43±0.1521.9±228.41.89±0.3210 *酸l/ D骨磷l/L)磷mo )) )酸)酸)酸组l/L)磷性(U标D血mo性(μ ·L BM磷Ca2+ mo钙l/L) P3+ mol/L)磷l/L) /L /L钙mo磷mo磷BM钙mo验血mo血mo l/L) l/L) (m性酶Kat/L) (s试指l/L)跟碱酶( ( m (m性酶( U碱碱酶( m (m (m (m碱(n (m别比(男女/ )上 上 上 上 上 上 上 上 上 上性同 同 同 同 同 同同同0/30同同△0龄 上 上 上 上 上 上上上 上 上年 同同 同±11.2#19/11#52.1同同±4.418/20 66同 同同60±1同同.3±16.5#20/12# 44出上 上访/退 上 上 上 上 上 上 上 上失同 同 同1同 同N R同 同同N R同同N R数 上 上 上 上 上 上上上15上上同 同 同 同 同3 8同 同 同3 0同 同1 6人份2005200020052004发表年[25]究等等等伟名权研建[24]平维[26]志[27]任卫李吕赵编号22 23 24 25
BMD :bone mineral density,骨密度;NR :未报道;L2~4 :第2~4 腰椎;L3 :第3 腰椎△ :年龄以“均值± 标准差”或“均值( 全距)”表示;* :在无特殊说明时,BMD 单位为g/cm2 ;# :未分组报告男女性别人数;§ :产出指标报告的是相对于基线的变化值

表4 各研究质量评价
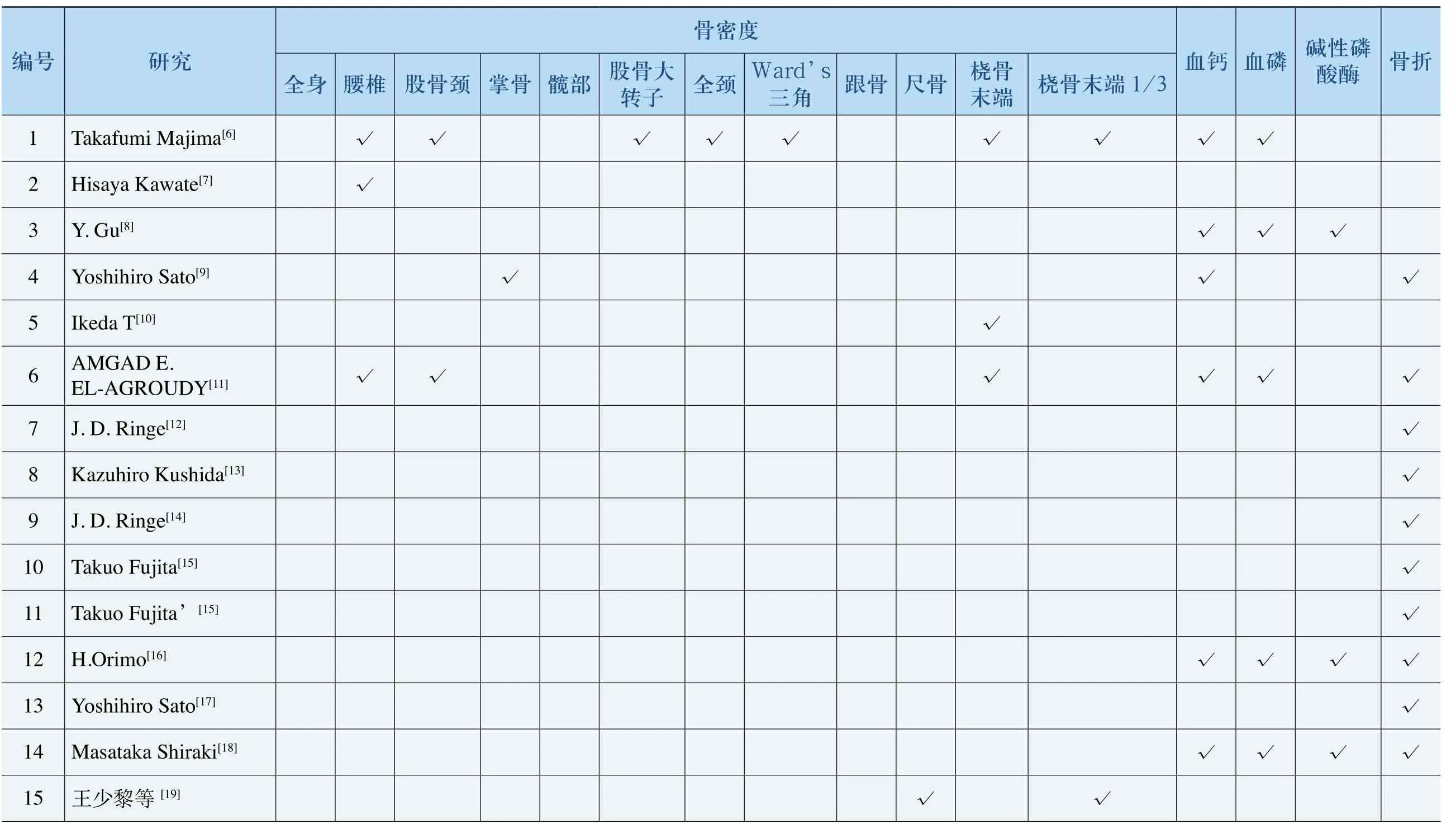
表5 各研究采用指标
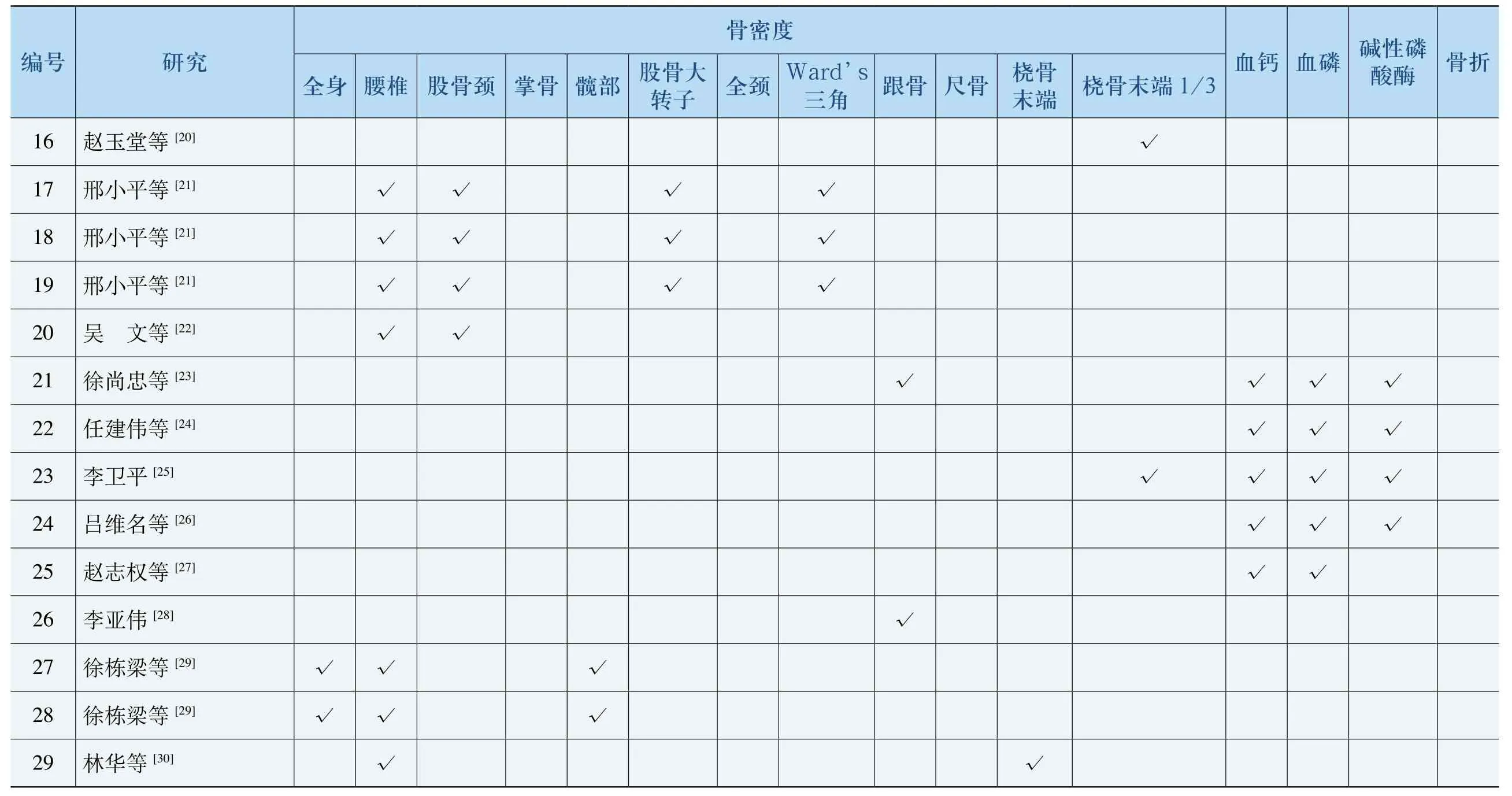
折骨磷性酶碱酸√√√√磷血√√√√√钙血√√√√√3 1/端末√√骨桡骨末端桡√骨尺骨跟√√’srd角Wa三 √√√度密骨颈全大骨子股转 √ √ √部髋√√骨掌颈骨 √√√√股椎腰 √√√√√√ √身全√√究研[20][21][21][21][22][23][24][26][27][29][29]等等等等等等等[25]等等[28]等等[30]堂平平平文忠伟平名权 伟梁梁 等玉小小小 尚建卫维志 亚栋栋 华赵邢邢邢吴徐任李吕赵 李徐徐 林号编1617181920212223242526272829
1.阿法骨化醇防止骨量流失治疗效果的Meta分析
一共17项研究包含不同位置的骨密度数据,以腰椎骨密度最多,其他位置骨密度报道较少,所以在具体处理中以腰椎骨密度为主要指标,没有腰椎骨密度则以其他位置的骨密度替代。为观察其他部位与腰椎骨密度分析结果是否一致,仅合并含有椎骨骨密度的研究观察结果,若合并结果不同,则寻找原因。此外,如在包含了4个以上研究的亚组内存在异质性,则寻找异质源,排除后做敏感性分析,观察结果。骨密度Meta分析结果见表6。

表6 骨密度Meta分析
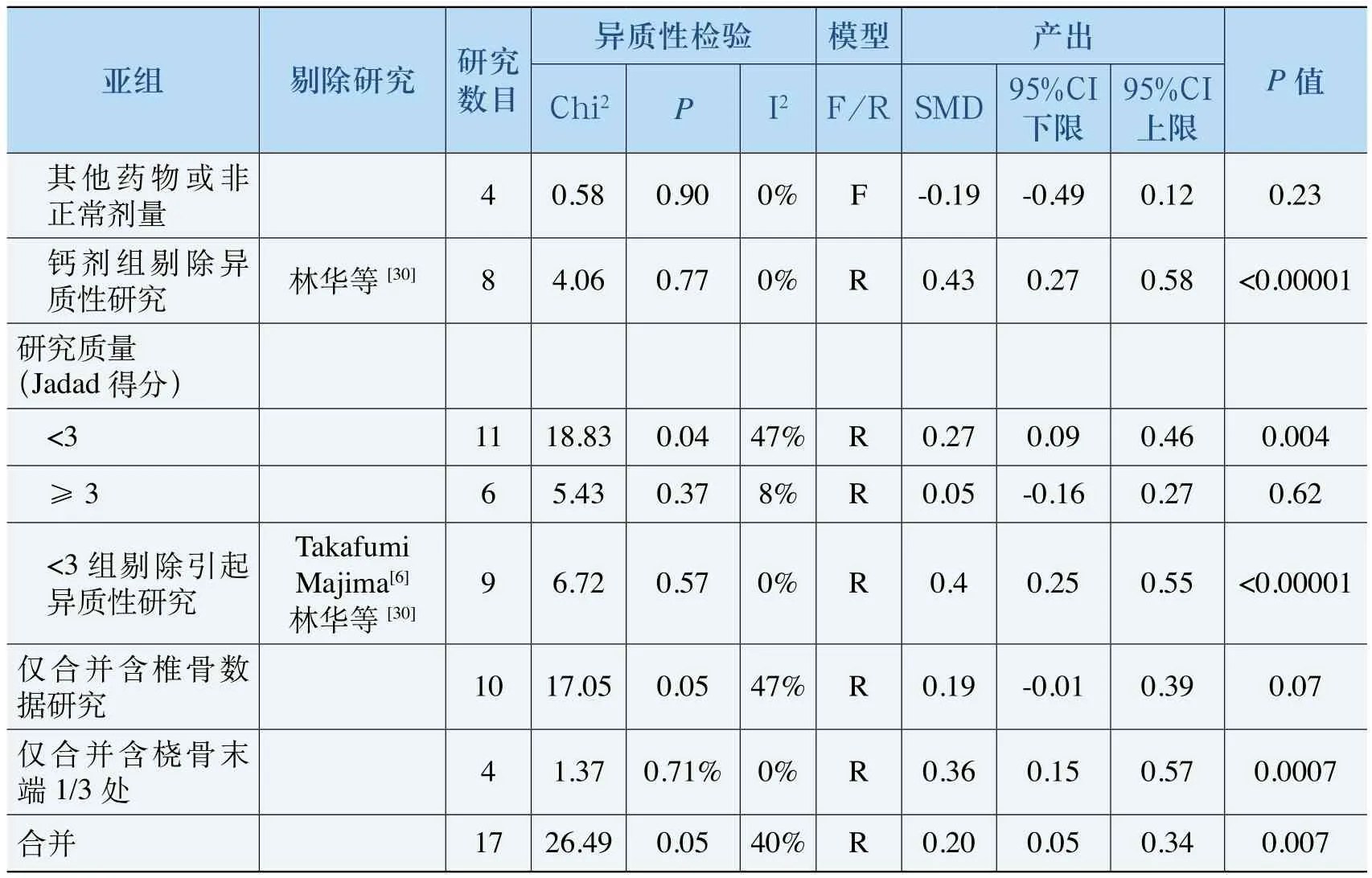
95%CI上限其他药物或非正常剂量 4 0.58 0.90 0% F -0.19 -0.49 0.12 0.23钙剂组剔除异质性研究 林华等[30] 8 4.06 0.77 0% R 0.43 0.27 0.58 <0.00001研究质量(Jadad得分)<3 11 18.83 0.04 47% R 0.27 0.09 0.46 0.004≥3 6 5.43 0.37 8% R 0.05 -0.16 0.27 0.62<3组剔除引起异质性研究亚组 剔除研究 研究数目异质性检验 模型 产出P值Chi2 P I2F/R SMD 95%CI下限Takafumi Majima[6]林华等[30]9 6.72 0.57 0% R 0.4 0.25 0.55 <0.00001仅合并含椎骨数据研究 10 17.05 0.05 47% R 0.19 -0.01 0.39 0.07仅合并含桡骨末端1/3处 4 1.37 0.71% 0% R 0.36 0.15 0.57 0.0007合并 17 26.49 0.05 40% R 0.20 0.05 0.34 0.007
如表6所示,合并所有研究的结果显示阿法骨化醇(ALF)防止骨量流失的治疗效果显著优于对照组[SMD=0.20, 95%CI(0.05, 0.34)]。按性别划分的亚组分析中,ALF对男性亚组的效果显著优于对照组。按疗程划分的亚组分析中,无论疗程长短,试验组和对照组均无显著差异,这提示我们在骨质疏松症的治疗中,骨密度的提升不是一个短期过程,需要长期用药以促进骨密度提升。按剂量划分的亚组分析中,剂量为0.5μg/d的亚组ALF治疗效果显著优于对照组。按治疗模式划分的亚组分析中,在联合用药组的治疗模式下,试验组和对照组的ALF的治疗效果有显著差异;当ALF与钙剂对照时,ALF优于钙剂的治疗效果。低质量的研究对合并SMD的影响显著,在所有高质量研究中,ALF和对照组无显著差异,而11篇低质量研究中ALF治疗效果优于对照组药物。研究注意到仅含有椎骨骨密度的数据合并分析结果与总的合并结果相悖,原因是其中三项研究[19-20,25]均使用了桡骨末端1/3交界处的骨密度数据,对含有桡骨末端1/3交界处骨密度数据合并分析显示ALF对该处的治疗效果显著优于对照组。
2.阿法骨化醇提升血钙浓度治疗效果的Meta分析
一共11项研究包含有血钙(Ca)数据,其中一篇[16]是变化值数据(产出与基线的差值),按照Cochrane系统评价员手册的要求,变化值数据可以和产出指标合并,但只能以固定效应模型。因此,本研究中,尽管研究间存在较大的异质性但若亚组内有变化值数据,仍然以固定效应模型合并分析。在有血钙数据的所有研究中,性别疾病类型和治疗模式之间具有很大的关联性,因此以疾病类型为代表分亚组分析。血钙的Meta分析结果见表7。
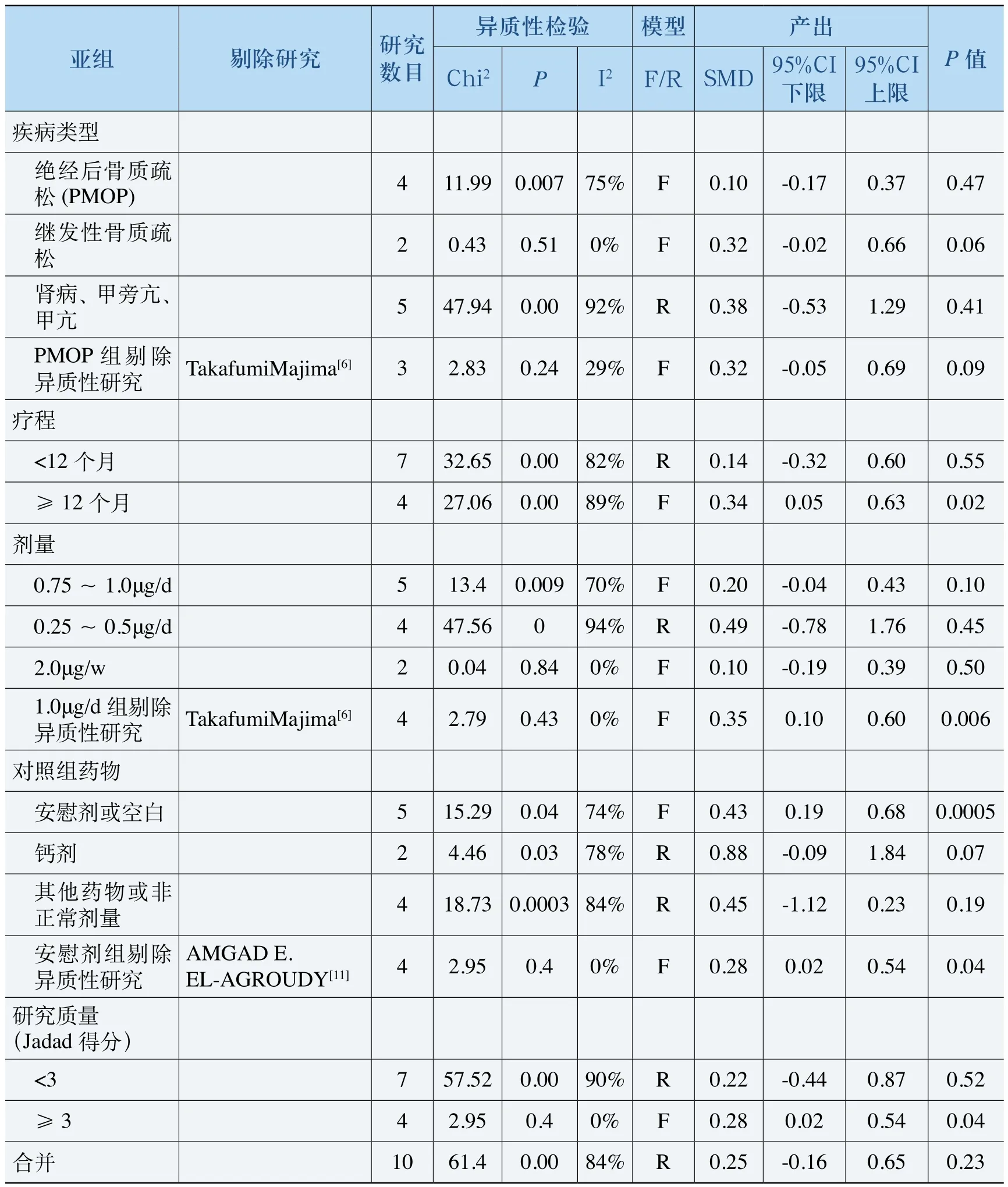
表7 血钙Meta分析
如表7所示,在疗程超过12个月的研究中,ALF的治疗效果明显优于对照组[SMD 0.34, 95%CI(0.05, 0.63)];剂量亚组内,当高剂量组(0.75~0.1μg/d)剔除异质性研究[6]后,ALF的疗效显著优于对照组。不同对照组的亚组分析中,ALF治疗效果显著优于安慰剂或空白组,但与钙剂或其他药物的对比没有显著性差异。研究质量对合并结果的影响显著,高质量研究显示ALF组疗效更优,而低质量研究中没有显著差异。在疾病的各亚组内,试验组和对照组的治疗效果没有显著差异;而合并所有研究的结果显示ALF对血钙的影响与对照组药物没有显著差异(P>0.05)。
3.阿法骨化醇对血磷浓度影响的Meta分析
一共11项研究包含有血磷的数据,变化值数据的处理同血钙一致。性别、疾病类型和治疗模式有很大相关性,仍以疾病类型作为代表分析血磷的Meta分析结果见表8。
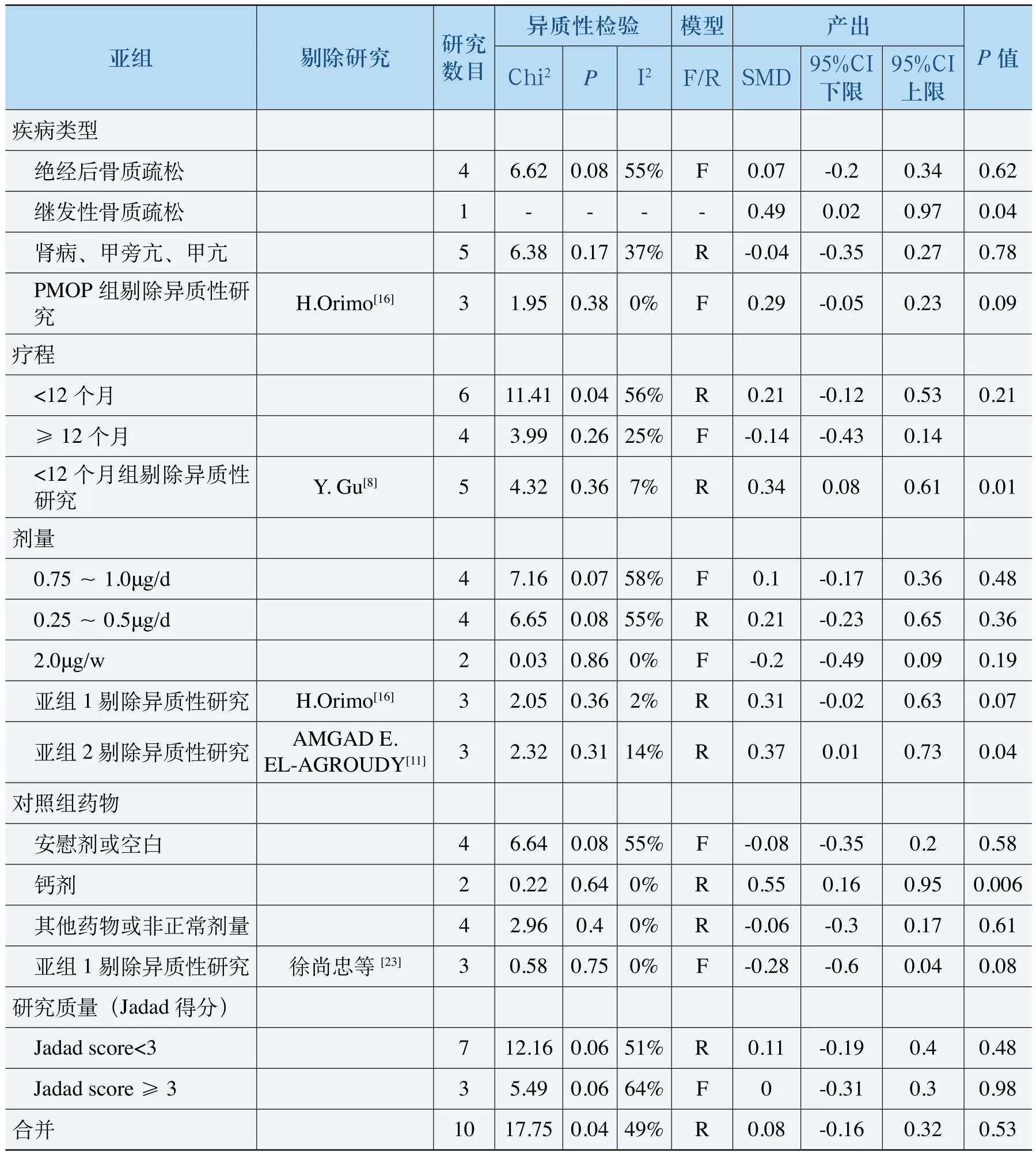
表8 血磷Meta分析
如表8所示,按疾病类型分亚组情况下,继发性骨质疏松治疗后血磷显著高于对照组,但该亚组只有一项研究,因此结果的可靠性尚不明确。在肾病伴甲状旁腺功能亢进症患者中,用ALF治疗后的血磷比对照组略低,但差异没有统计学意义。在疗程小于12个月的研究中,剔除异质性研究后用ALF治疗后的血磷水平显著高于对照组;而0.5μg/d亚组剔除异质性研究后同样显示用ALF治疗后的血磷水平高于对照组且差异有统计学意义。不同对照类型中,除与钙剂比较时用ALF治疗后的血磷水平显著高于钙剂外,其余亚组均无显著性差异。文献的研究质量对合并结果没有实质影响。总体合并结果显示ALF组对血磷的作用与对照组没有显著差异。
4.阿法骨化醇降低血清碱性磷酸酶效果的Meta分析
一共7项研究包含碱性磷酸酶数据,其中性别、剂量、对照组药物和疾病有显著的相关性,试验组慢性肾病患者及甲旁亢患者均用ALF冲击治疗(2.0μg/w),对照组为正常剂量(0.5μg/d);绝经后骨质疏松患者试验组均服用ALF+钙剂,对照组服用安慰剂+钙剂;继发性骨质疏松患者试验组用ALF,对照组用钙剂,因此按疾病分亚组同时也是按对照组药物分亚组的结果。碱性磷酸酶的Meta分析结果如表9。
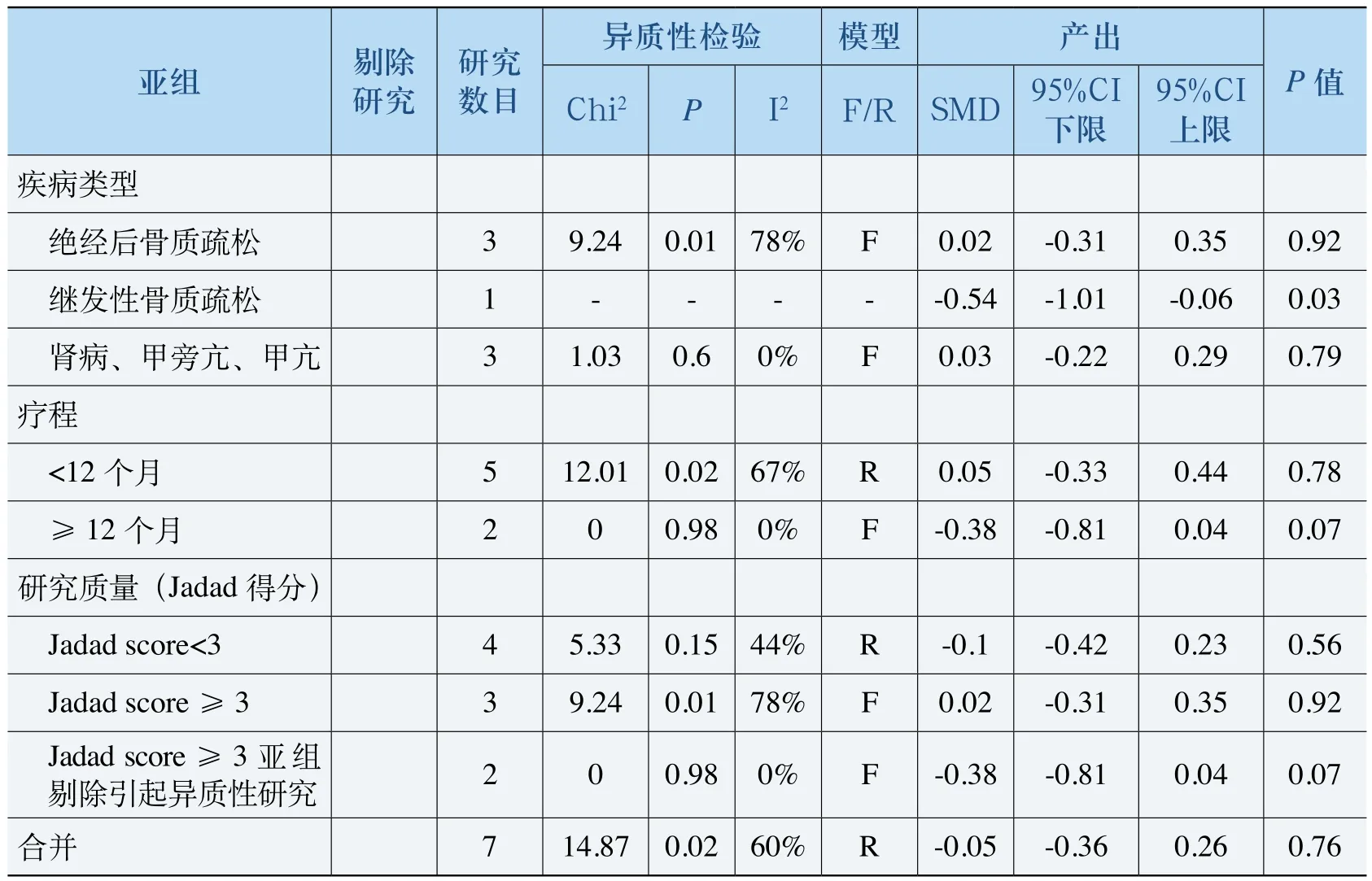
表9 碱性磷酸酶Meta分析
如表9所示,7项研究总体合并的SMD= -0.05(<0),但没有显著的统计学意义(P>0.05)。继发性骨质疏松亚组内(同时也是对照组为钙剂组)碱性磷酸酶下降水平显著低于钙剂,但该组只有一项研究,能否说明ALF有更好的疗效尚待证实。其余不同类型的亚组内试验组和对照组均没有显著差异。
5.阿法骨化醇骨折防治效果的Meta分析
一共10项研究报道了骨折率数据,值得注意的是在有骨折率数据的所有10项研究中,只有三项研究[11,12,14]Jadad得分是2分,剩余7项研究均是大于等于4的高质量研究。总体上看,骨折率的分析可靠性较好。骨折率的Meta分析结果见表10。
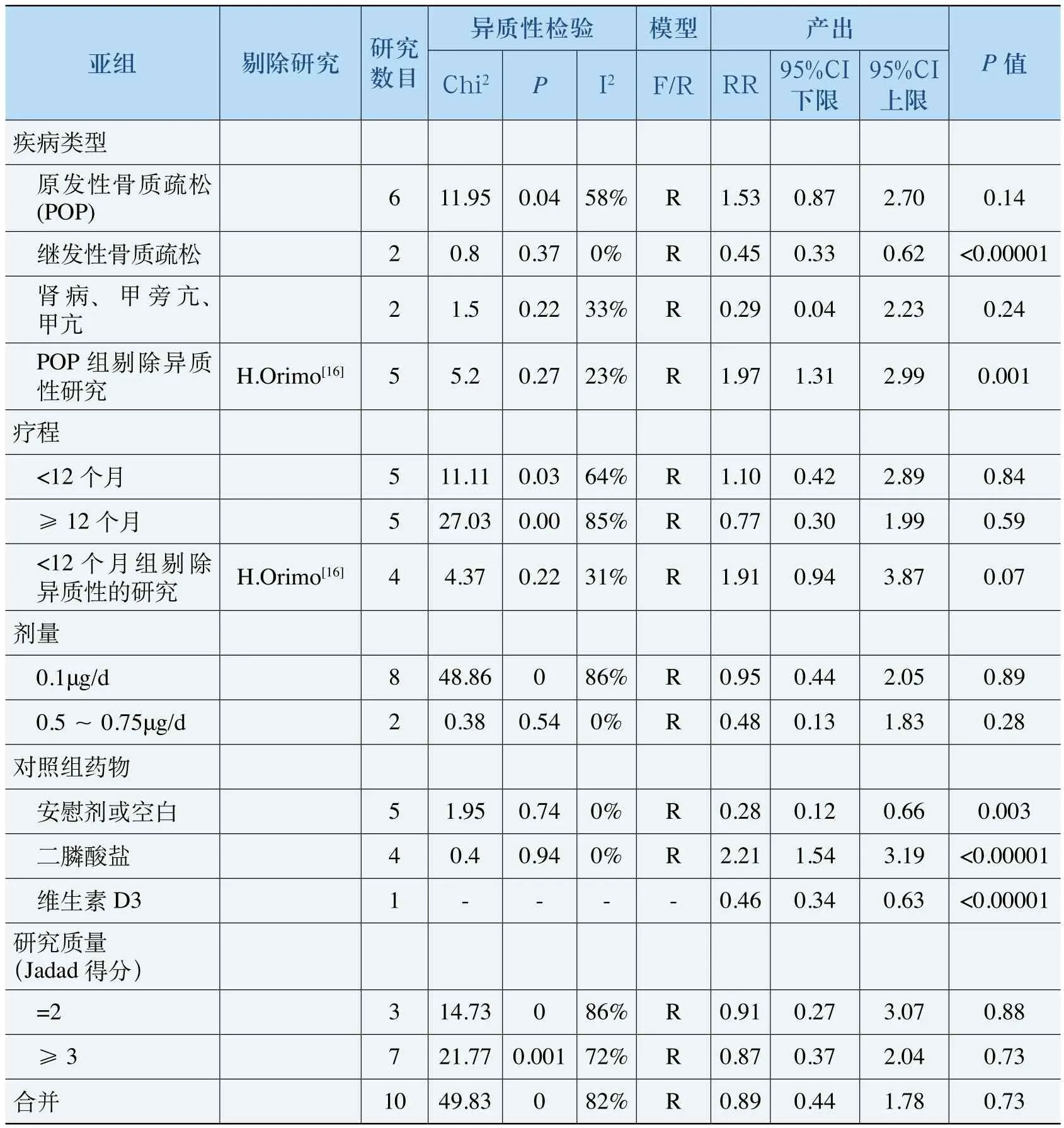
表10 骨折率Meta分析
如表10所示,继发性骨质疏松病人中,ALF降低骨折风险的水平显著高于对照组[SMD 0.45, 95%CI(0.33, 0.62)];而原发性骨质疏松亚组在剔除异质性研究后显示ALF的疗效显著劣于对照组,其原因可能是原发性骨质疏松亚组中,对照组有5项都是二膦酸盐,而在与二膦酸盐的比较中,ALF的疗效明显劣于后者[SMD 2.21, 95%CI(1.54, 3.19)],恰好可以证明前面的猜想。ALF的疗效显著优于维生素D3[SMD 0.46 95%CI(0.34, 0.63)]以及安慰剂或空白组[SMD 0.28, 95%CI(0.12, 0.66)]。合并所有研究的SMD=0.89(<1),表明ALF的疗效略优于对照组,但试验组和对照组的骨折防治效果没有显著性差异(P>0.05)。
(四)各项研究指标的发表偏倚
图1、图2、图3、图4和图5为表示骨密度、血钙、血磷、碱性磷酸酶和骨折率等研究指标发表偏倚的漏斗图。血钙、血磷和碱性磷酸酶的漏斗图都比较对称且集中度较高,表明研究质量较高而发表偏倚较小。而骨密度漏斗图和骨折率漏斗图的右下角都有不同程度的残缺,表明缺少小样本的研究,或者有阴性研究未能发表或有文献未检索到,存在一定程度的偏倚。
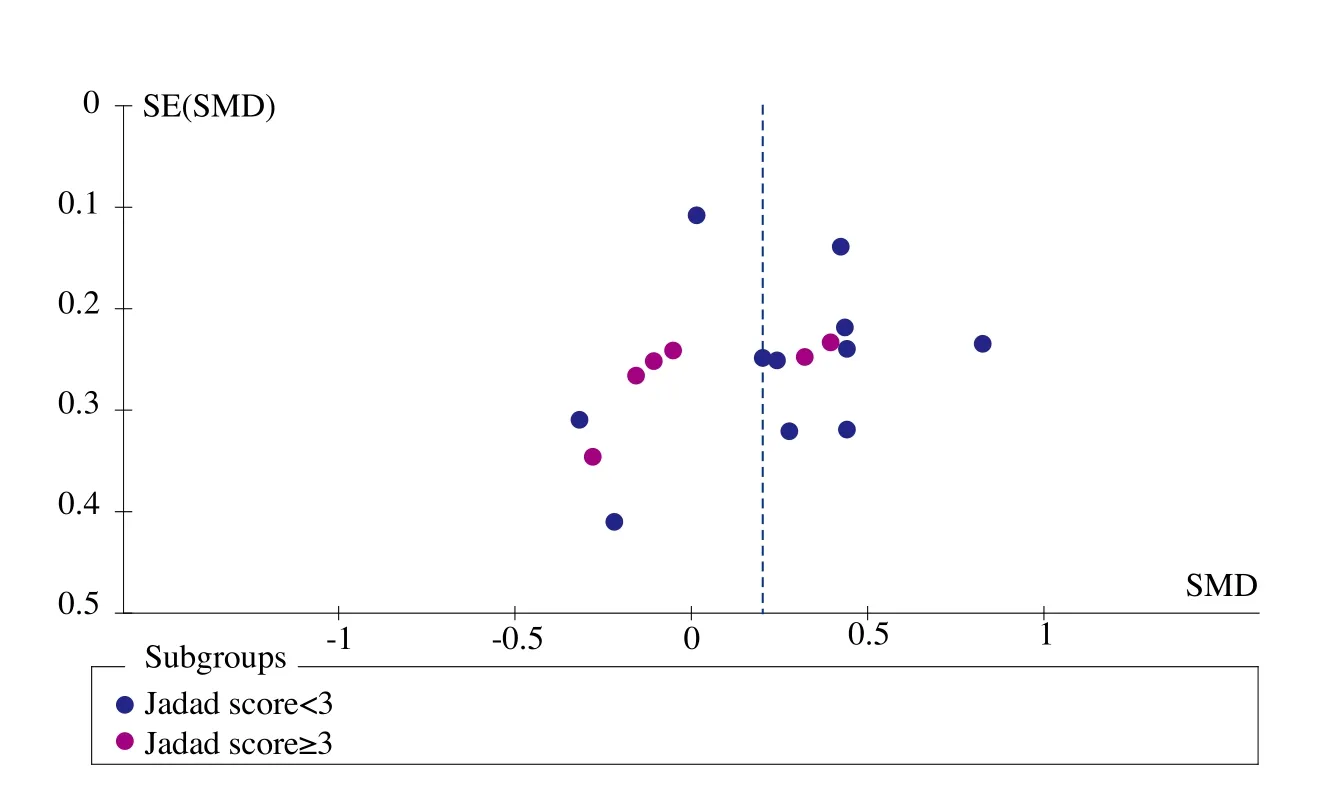
图1 骨密度漏斗图
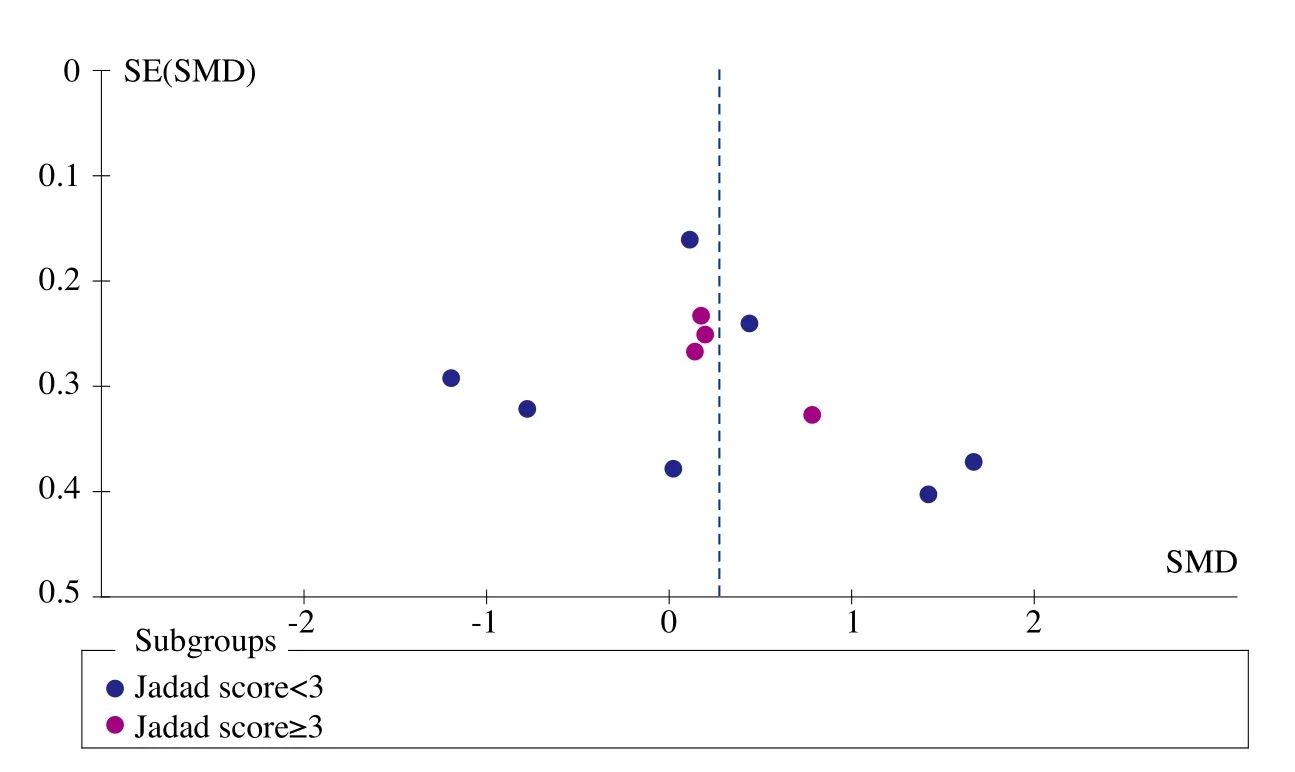
图2 血钙漏斗图
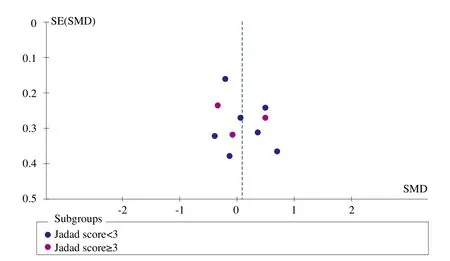
图3 血磷漏斗图
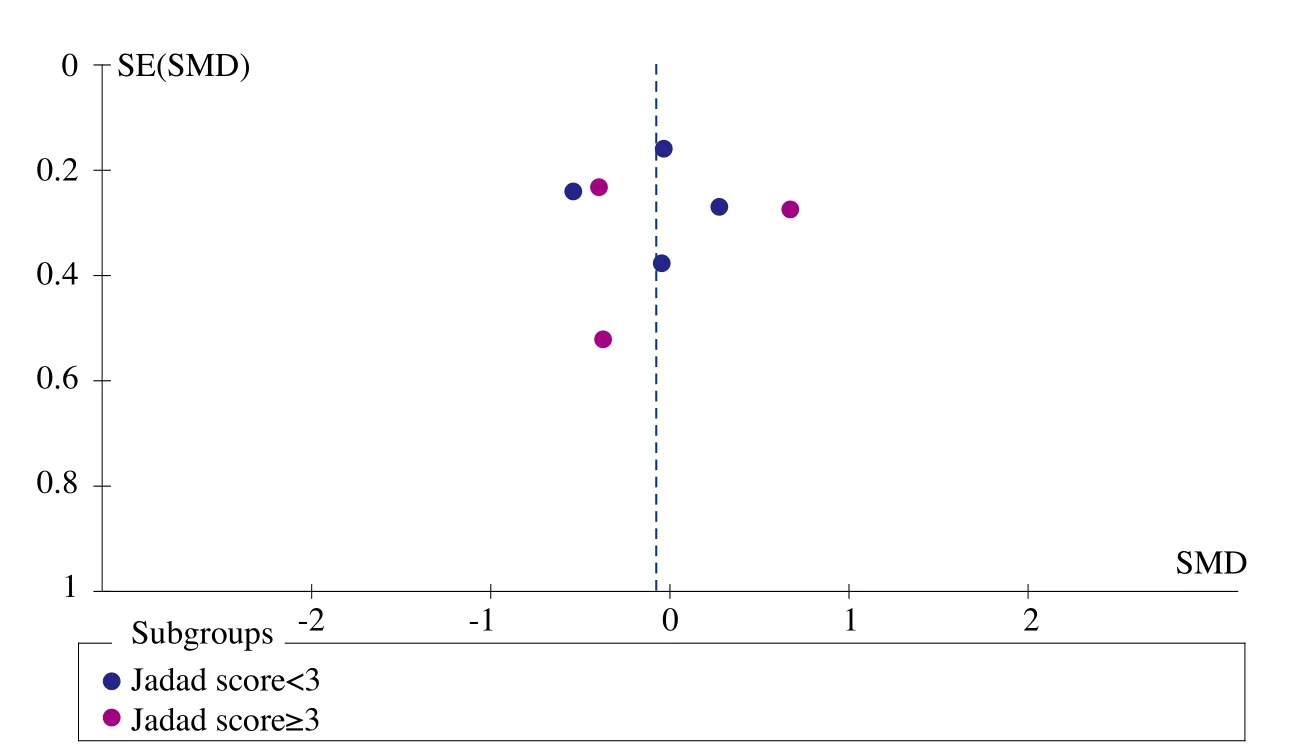
图4 碱性磷酸酶漏斗图
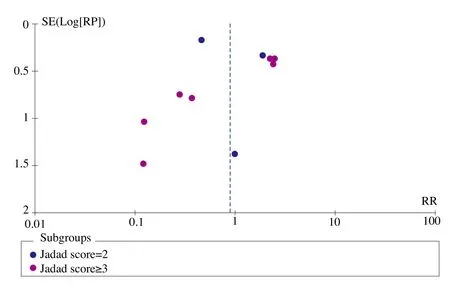
图5 骨折率漏斗图
三、讨论
(一)证据强度讨论
1.纳入研究的质量
所纳入的29项研究中,共有3项研究(10%)是Jadad得分5分的高质量研究,9项研究(31%)是得分3~4分的较高质量研究,剩余17项(59%)都是1~2分的低质量研究。值得注意的是,高质量研究中没有一篇中文文献,3~4分的较高质量研究中仅有2篇中文文献,绝大部分中文文献研究质量较低,因此从总体上降低了研究的质量和本研究的证据强度,这也提示国内的临床试验报告亟待规范。此外,4~5分的较高和高质量研究主要集中在骨折率数据,显示骨折率的Meta分析结果有较高的可靠性。
具体来看,共有8项研究(28%)采用了正确的随机化方法,7项研究(24%)描述了正确的盲法,21项研究(71%)详细报道了失访或退出的理由,4项研究(14%)采用了实施分配隐藏,22项研究(76%)报道了基线可比性(试验组和对照组主要指标均无显著差异)。纳入的29项研究中,涉及随机化、盲法和分配隐藏的研究质量较低,而涉及失访或退出以及基线可比性的研究质量较高。考虑到随机、盲法和分配隐藏对于选择偏倚、实施偏倚和测量偏倚的重要影响,除骨折率数据的质量外,其他4项指标(BMD、Ca、P和ALP)有待更新质量更高的随机对照试验。
2.异质性分析
由于所纳入的各个研究之间观察对象多样性显著,如:疾病类型包括老年性和绝经后骨质疏松症、糖尿病和中风后骨质疏松症、慢性肾衰、终末期肾病、甲旁亢和甲亢以及帕金森氏病等,疗程分3个月到36个月不等,试验组和对照组用药有明显差异以及性别因素的影响,因此研究之间的临床异质性很大,但在4项以上存在异质性的亚组内剔除引起异质性的研究后各研究效应量的一致性较高。此外,本研究中,性别、疾病、剂量和对照组有显著的相关性,在细分的亚组内往往有较好的临床同质性,所以结果可靠性较高。
3.发表偏倚
在所讨论的5项指标(骨密度、血钙、血磷、碱性磷酸酶和骨折率)中,除骨密度和骨折率外,其他三项没有明显的发表偏倚且效应量离散程度较低。骨密度和骨折率可能有阴性的研究结果未发表。而疗程的长短对疗效没有显著影响。
(二)阿法骨化醇疗效讨论
1.对骨密度的影响
骨密度的Meta分析总体合并结果显示,阿法骨化醇(ALF)防治骨量流失的疗效优于对照组。从剂量来看,0.5μg/d组的ALF疗效显著优于对照组,而大剂量或较小剂量的ALF与对照组没有显著差异,这提示0.5μg/d的剂量可能更适合于防止骨量流失的治疗。ALF在男性组内的疗效显著优于对照组,在女性亚组内的疗效与对照组没有显著差异,这提示ALF对男性的治疗效果可能优于女性。但男性亚组内仅有3项研究,是否具有足够的外部有效性仍待进一步研究。联合用药(一般是ALF+钙剂)的疗效明显优于对照药物。而ALF的疗效明显优于单用钙剂,说明ALF对钙剂疗效影响显著。ALF与其他药物(包括阿伦膦酸盐和雷洛昔芬)相比,治疗效果略差,但没有统计学意义。高质量的研究显示,试验组和对照组之间没有显著差异。而低质量的研究支持ALF优于对照组,研究质量对结果产生了显著的影响,需要更多的高质量研究支持该结论。ALF防治椎骨骨量流失与对照组无显著差异但对桡骨的作用显著优于对照组。
2.对血钙的影响
血钙Meta分析总体合并结果认为ALF疗效与对照组无显著的差异。高剂量组剔除异质性研究后显示ALF疗效显著优于对照组,提示可能存在一定量效关系,即高剂量有利于提高血钙水平。性别、疾病、疗程对治疗效果没有显著影响。高质量的研究支持ALF对血钙的疗效比对照组药物更好;同时低质量的研究显示ALF疗效比钙剂和其他药物略差(无统计学差异),但明显优于安慰剂组。
3.对血磷的影响
血磷Meta分析总体合并结果显示ALF疗效与对照组无显著差异。而在一项继发性骨质疏松研究[25]中,治疗后的血磷明显高于对照组,提示ALF对于继发性骨质疏松症患者提高血磷的效果明显。在疗程少于12个月的所有研究剔除异质性研究后支持同样的结论,0.5μg/d组在剔除异质性研究后也显示治疗后的血磷水平显著高于对照组,ALF(0.5μg/d)对血磷的效果更加明显,而超过12个月之后与对照组没有显著差异。与钙剂的对照(同时试验组是ALF+钙剂)结论同上;但与其他药物治疗后的血磷水平相比较低(没有显著性差异)。
4.对碱性磷酸酶的影响
ALF降低碱性磷酸酶(ALP)的效果在继发性骨质疏松(对照组为钙剂)中显著优于对照组,表明ALF联用钙剂比单用钙剂的疗效更好,说明ALF对钙剂的疗效影响较大。而在其他不同类型亚组内都没有显著差异。
5.对骨折率的影响
骨折率Meta分析总体合并结果显示,ALF与对照组防治骨折发生的效果没有显著性差异,但ALF对继发性骨质疏松患者的疗效优于对照组。由于原发性骨质疏松亚组的对照组除去异质性研究外都是二膦酸盐类,考虑到与二膦酸盐的比较结果,ALF防治骨折的疗效明显劣于二膦酸盐类但相比安慰剂和维生素D3能显著降低骨折的发生率。
在骨质疏松的临床诊断和防治中,目前骨密度、血钙和骨折发生率为最重要的观察指标,以此三项主要指标来看,ALF防治骨量流失要优于对照组药物;高质量的研究支持ALF对血钙的疗效比对照组药物更好,而在骨折防治上显著优于安慰剂和维生素D3组,但劣于二膦酸盐。然而有研究[31]表明,ALF和二膦酸盐(主要指阿伦膦酸盐)联合用药对骨密度、骨折率以及疼痛缓解的疗效显著优于二膦酸盐和维生素D联合用药或者ALF单用药的疗效,因此临床诊治中,ALF和二膦酸盐联合使用的治疗方案可能效果更好。
(三)系统评价的适用和局限
本研究检索的语言限定为中文和英文,所纳入文献中的受试者人群主要是亚裔(包括中国和日本)和欧美人群。观察对象的疾病除原发性和继发性骨质疏松外还包括肾病继发性甲旁亢等阿法骨化醇的主要适应证,性别研究包括女性研究男性研究以及混合研究,年龄从20~90岁不等因此研究结果仅适用于亚裔和白种人群、患阿法骨化醇适应证人群,性别和年龄不限。
本研究对模型的选择方法决定了研究倾向于保守估计效应量(保守适用固定效应模型),因此结论总体上偏于保守和稳妥,实际治疗效果可能优于本研究结论。
原则上,本研究应当合并的连续型数据应该是产出和基线的差值,但仅有一篇文献[16]报道了差值,而又缺乏基线和产出相关系数。因此,按照Cochrane手册选择直接合并产出数据,变化值数据以固定效应模型合并。但该方法基于的前提假设是所有研究的相关指标没有显著的统计学差异。但从表4可以看出,有7项研究并未报道基线数据是否有显著差异,其他研究基线均可比。因此,本研究仍然假设该7项研究的基线没有显著差异。
四、结论
综上所述,考虑纳入文献的研究质量、异质性以及发表偏倚等影响,本系统评价具有较高的证据强度,且有较好的外部效度。
阿法骨化醇(ALF)防治男性骨量流失的效果优于其他药物,对女性没有明显优势,性别对血钙、血磷、碱性磷酸酶和骨折率没有显著影响。ALF对继发性骨质疏松患者的血磷、碱性磷酸酶和骨折率的疗效显著优于其他药物,在血钙上没有显著差异,在其他指标方面没有明显优势。疗程对ALF疗效的影响除血磷之外,其他指标均不显著。0.5μg/d剂量对骨密度(BMD)和血磷的影响显著,而0.1μg/d剂量对血钙的效果显著优于其他药物,其余指标受剂量影响不显著。联合用药下,ALF组疗效明显优于对照组(主要是钙剂、安慰剂或空白)。ALF和安慰剂或空白组比较,在血钙和骨折率指标上有显著的优势,但其他指标上没有统计学差异;ALF和钙剂比较,在BMD、血磷和碱性磷酸酶上显著优于后者,但有联合用药的影响;ALF和其他药物比较,在骨折率指标上劣于二膦酸盐,在其他四个指标上略劣于对照药物,但没有显著差异。
[1] 中国老年学学会骨质疏松委员会骨质疏松诊断标准学科组.中国人原发性骨质疏松症诊断标准(试行).中国骨质疏松杂志,1999,5(1):2
[2]Assessment of fracture risk and its application to screening for postmenopausal osteoporosis.Report of a WHO study group. World Health Organ Techn Rep Ser, 1994, 843: 1-129
[3] Kaoru Yamazaki, Kazuhiro Kushida, Akihiro Ohmura, Tetsuo Inoue. Utility of Diagnostic Criteria for Involutional Osteoporosis Established by the Japanese Ministry of Health and Welfare. J Bone Miner Met, 1993, 11(2):s25-230
[4]中国健康促进基金会骨质疏松防治中国白皮书编委会.骨质疏松症中国白皮书.中华健康管理学杂志,2009,3(3):148-154
[5] M Borenstein, L V Hedges, J P T Higgins, H R Rothstein. Introduction toMeta-Analysis.John Wiley & Sons, Ltd, 2009
[6] Takafumi Majima. Efficacy of Combined Treatment with Raloxifene and Alfacalcidol on Bone Density and Biochemical Markers of Bone Turnover in Postmenopausal Osteoporosis. Endocrine Journal, 2008, 55(1): 127-134
[7] Hisaya Kawate, Masahiro Adachi, Ryoichi Takayanagi. Alendronate improves QOL of postmenopausal women with osteoporosis. Clinical Interventions in Aging, 2010, 5: 123-131
[8] Y Gu. Comparisons Between Oral Pulse Alfacalcidol Therapy and Daily Therapy in Maintenance Hemodialysis Patients with secondary Hyperparathyroidism: A randomized, Controlled, and Multicenter Study. Renal Failure, 2005, 27: 205-212
[9] Yoshihiro Sato, Hiroshi Maruoka, Kotaro Oizumi. Amelioration of Hemiplegia-Associated Osteopenia More Than 4 Years After Stroke by 1α-HydroxyvitaminD3and CalciumSupplementation. Stroke, 1997, 28: 736-739
[10] Ikeda T, H Manabe, K Iwata.Cinical significance of alendronate in postmenopausal type 2diabetes mellitus. Diabetes Metab, 2004, 30: 355-358
[11] AMGAD E EL-AGROUDY, AMR A EL-HUSSEINI, MOHARAM EL-SAYED, MOHAMED A. GHONEIM. Preventing Bone Loss in Renal Transplant Recipients with Vitamin D. Jam Soc Nephrol, 2003, 14: 2975-2979
[12] J D Ringe, H Faber, A Dorst. Alendronate Treatment of Established Primary Osteoporosis in Men: Results of a 2-Year Prospective Study. J Clin Endocrinal Metab, 2001, 86: 5252-5255
[13] Kazuhiro Kushida. Alendronate reduced vertebral fracture risk in postmenopausal Japanese women with osteoporosis: a 3-year follow-up study. J Bone Miner Metab, 2004, 22: 462-468
[14] J D Ringe, A Dorst, H Faber.Superiority of alfacalcidol over plain vitamin D in the treatmentof glucocorticoid-inducedosteoporosis. Rheumatol Int, 2004, 24: 63-70
[15] Takuo Fujita, Hajime Orimo, Tetsuo Inoue.Clinical effect of bisphosphonate and vitamin D on osteoporosis:reappraisal of a multicenter double-blind clinical trial comparing etidronateand alfacalcidol. J Bone Miner Metab, 2007, 25: 130-137
[16] Orimo H, Shiraki M, Hayashi Y, Hoshino T, Onaya T, Miyazaki S et al. Effects of 1a-hydroxyvitamin D3on lumbar bone mineral density and vertebral fractures in patients with postmenopausal osteoporosis. Calcif Tissue Int, 1994, 54:370-376
[17] Yoshihiro Sato, Manabe S, Kuno H, Oizumi K. Amelioration of osteopenia and hypovitaminosis D by 1a-hydroxyvitamin D3 in elderly patients with Parkinson’s disease. J Neurosurg Psychiatry, 1999, 66:64–68
[18] Masataka Shiraki, Kushida K, Yamazaki K, Nagai T, Inoue T, Orimo H. Effects of 2 years’ treatment of osteoporosis with 1ahydroxy vitamin D3 on bone mineral density and incidence of fracture: a placebo-controlled, double-blind prospective study. Endocrinol J, 1996, 43:211-220
[19] 王少黎,郭艳霞.阿法骨化醇的临床疗效观察.全国老年骨质疏松专题学术研讨会论文汇编,2000
[20] 赵玉堂, 王乃新,葛林阜等.阿法骨化醇治疗原发性骨质疏松效果观察和作用机理研究.解放军保健医学杂志,1994,4:32-33
[21] 邢小平, 樊继援,孟迅吾等.低剂量1α羟维生素D3治疗骨质疏松症的疗效观察.中华老年医学杂志,2002,21(4):261-263
[22]吴文,智喜梅,韩梅清等.钙与阿法骨化醇对老年男性骨质疏松患者骨密度及骨代谢的影响.医药导报,2004,23(9):643 645
[23]徐尚忠,黄伟民,任建英,张瑞芳.阿法骨化醇治疗老年骨质疏松症的双盲对照试验.新药与临床,1997,16(6):337-339
[24]任建伟,李朝,宗力群等. 阿法骨化醇治疗继发性甲状旁腺功能亢进疗效观察.中国现代医药杂志,2005,7(5):31-34
[25]李卫,梁可珍,张柄旺等. 钙剂加阿法骨化醇治疗老年糖尿病骨质疏松症38例.中国药业,2000,9(6):35-36
[26]吕维名,许荣.阿法骨化醇胶丸加钙改善女性甲状腺功能亢进骨代谢紊乱患者疼痛症状.中国临床康复,2005,9(15):9,19
[27]赵志权,霍冬梅,磨红.阿法骨化醇与碳酸钙对慢性肾衰患者骨代谢影响的对比研究. 广西医科大学学报2004,21(6):838-840
[28]李亚伟. 法能治疗原发性骨质疏松症45例临床观察. 中医正骨,2003,15(5):45
[29] 徐栋梁,李佛保,万勇等.活性维生素D3加钙剂治疗妇女骨质疏松症2年疗效观察.中国骨质疏松杂志,1998,4(2):62 65
[30]林华,韩祖斌,包丽华等.钙及维生素D3治疗骨质疏松症患者349例疗效评价.实用老年医学,2000,14(1):33-35
[31] J D Ringe, P Farahmand, E Schacht, A Rozehnal.Superiority of a combined treatment ofAlendronateand Alfacalcido compared to the combination of Alendronateand plain vitamin D or Alfacalcidol alone in establishedpostmenopausal or male osteoporosis (AAC-Trial). Rheumatol Int, 2007, 27:425–434
1 李洪超,张心科,金雪晶,初云波,符一男,中国药科大学国际医药商学院医药经济研究所,南京 210009
2 马爱霞,通讯作者,中国药科大学国际医药商学院医药经济研究所,南京 210009
