6-OHDA诱导过表达nurr1基因的SK-N-SH细胞凋亡
2011-04-28赵咏梅张海燕李卫红
刘 扬 赵咏梅 张海燕 李卫红 岳 云*
(1.首都医科大学北京朝阳医院麻醉科,北京 100020;2.首都医科大学宣武医院中心实验室,教育部神经变性病重点实验室,北京 100053;3.首都医科大学细胞生物学教研室,北京 100069)
核相关受体因子(nuclear receptor related factor1,Nurr1)属于类固醇/甲状腺激素核受体超家族成员,是未知配体的孤儿核受体,作为核转录因子,与神经前体细胞向多巴胺(dopamine,DA)能神经元方向分化、成熟密切相关[1]。在nurr1高表达的中脑黑质致密部,DA能神经元的退行性变性和丢失是帕金森病(Parkinson disease,PD)的主要病理特征[2],但这种选择性损伤DA能神经元的病因和发病机制目前尚不清楚。动物实验[3]发现,敲除nurr1基因的小鼠只在黑质纹状体和腹侧被盖处不能形成DA能神经元,并伴随DA浓度明显下降,这与PD的病理特征极其相似;对PD患者的调查研究[4]证实了家族性PD患者的nurr1基因存在2个异体突变位点。由此推论,nurr1基因的功能可能与PD患者中脑DA能神经元损伤易感性相关,具体机制尚不明确。
PD患者的中脑黑质致密部DA能神经元病理变化可能存在一条共同的通路,即细胞凋亡。Hartmann A等[5]在PD死亡患者中发现中脑黑质DA能神经元的凋亡特征性改变,并检测到细胞缺失与凋亡起始因子Caspase-3的表达密切相关。细胞凋亡可能是引起PD患者黑质中DA能神经元死亡和丢失的直接原因。
本研究小组已经证明过表达外源性nurr1基因的SK-N-SH/Nurr1细胞对6-羟基多巴胺(6-hydroxydopamine,6-OHDA)损伤敏感性增强[6]。本实验通过观察6-OHDA作用于Nurr1+/-细胞株后,比较超微结构以及凋亡因子Caspase-3表达的变化,研究SK-NSH/Nurr1细胞损伤是否通过细胞凋亡途径,以明确Nurr1基因在SK-N-SH/Nurr1细胞对6-OHDA损伤易感性中的作用。
1 材料和方法
1.1 实验材料
1)细胞株:人神经母细胞瘤株SK-N-SH细胞由首都医科大学细胞生物教研室提供,SK-N-SH/Nurr1细胞模型由本研究小组将表达nurr1基因的质粒载体pBK-RSV-Nurr1转染至SK-N-SH细胞后成功建立[7]。简言之,用脂质体基因转染法将带有nurr1基因的载体pBK-RSV-Nurr1转染至SK-N-SH细胞,经500 mg/L G418筛选。为排除质粒转染对细胞可能存在的影响,本研究还设立了过表达增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)的 SK-N-SH/EGFP细胞平行对照组。
2)细胞培养试剂:DMEM(Gibco公司),胎牛血清(杭州四季青生物工程材料有限公司)。转染细胞鉴定试剂:Nurr1抗体(Santa Cruz公司);SP免疫组化试剂盒(Zymed Laboratories公司);TRIzol(Gibco公司);RT-PCR第一链合成试剂盒(Invitrogen公司);PCR PreMix反应体系(北京赛百盛基因技术有限公司)。药物实验试剂:6-OHDA(Sigma公司);Annxin V-FITC凋亡检测试剂盒(北京宝赛生物技术有限公司)。
3)仪器:流式细胞仪(FACSCalibur,BD,USA);透射电镜(Philips,EM208S,Holand)。
1.2 方法
1)细胞培养:3株细胞用含10%灭活胎牛血清、青霉素1×105U/L、链霉素0.1 g/L的DMEM完全培养基,置CO2培养箱,37℃、3.5%CO2条件下培养。细胞每周传代2次,根据实验需要将细胞按合适密度接种于培养瓶中。
2)免疫细胞化学染色显示转染细胞Nurr1表达:免疫荧光细胞化学染色一抗为Nurr1抗体(1∶1 000),二抗为荧光素CY3标记的山羊抗小鼠抗体(1∶200)。免疫细胞化学染色按SP试剂盒说明书进行,用DAB显色。
3)RT-PCR鉴定转染细胞Nurr1 mRNA表达:用TRIzol提取总RNA反转录后行PCR。Nurr1及β-actin引物系根据GenBank中相应基因序列自行设计,由上海生工生物工程公司合成。引物序列如下:NURR1(299 bp):5'-agtacctttatggacaactacagca-3'和5'-cgtagtggccacgtagttctggt-3';β-actin(540 bp):5'-gtggggcgccccaggcacca-3'和5'-cttccttaatgtcacgcacgatttc-3'。PCR反应条件为:94℃变性5 min后,按94℃ 1 min,60℃ 1 min,72℃ 1 min,扩增28个循环,最后72℃延伸10 min。PCR产物在1.0%琼脂糖凝胶中电泳后在紫外灯下观察、照相。
4)流式细胞术(flow cytometry,FCM)测定细胞早期凋亡比例:向对数生长期的细胞分别加入50、75、100 μmol/L 6-OHDA,对照组更换新鲜培养基。分别在6、12 h后结束孵育,收集细胞1×106,1 000 r/min离心5 min,PBS 洗涤,加入 Binding Buffer 150 μL 和Annexin V-FITC 10 μL,室温,避光染色 30 min。再加入PI(50 mg/L)5 μL,避光反应5 min后,立即进行FCM(激发/发射488 nm/530 nm和600 nm)检测早期凋亡。数据采用Cell Quest软件进行分析。实验重复检测4次。
5)透射电镜(transmission electron microscopy,TEM)观察细胞超微结构:向对数生长期的细胞加入75 μmol/L 6-OHDA,对照组更换新鲜培养基。孵育12 h后,收集细胞,洗涤,弃上清,放入预冷的2%多聚甲醛-2.5%戊二醛前固定液(pH 7.4),4℃固定2 h。二甲砷酸钠缓冲液浸洗,1%锇酸(OSO4)4℃后固定2 h,梯度乙醇脱水,环氧丙烷置换,环氧树脂Epon812包埋。1 μm厚切片用天青美蓝染色作定位,超薄切片经醋酸双氧铀/枸橼酸铅双重染色,TEM观察。
6)Western blotting检测Caspase-3活性前体蛋白表达:细胞接种于25 cm2培养瓶中,培养24 h。向对数生长期的细胞加入含75 μmol/L 6-OHDA的完全培养基,对照组更换新鲜培养基,分别在培养6、12 h后结束孵育,收集细胞,1 000 r/min离心5 min,PBS洗涤。向细胞沉淀中加入细胞裂解液160 μL,超声破碎,用BCA法测定蛋白质浓度。取30 μg样品蛋白,煮沸变性,通过SDS-聚丙烯酰胺凝胶电泳(10%分离胶,4%聚集胶)分离蛋白质。取出凝胶,400 mA,冰浴中行电转移3 h。取出硝酸纤维素膜用TBS清洗2次,然后置于封闭液(含10%脱脂奶粉的TTBS)中,室温下封闭1 h。加入一抗,鼠抗人Caspase-3单克隆抗体(1∶500,Santa Cruz),4 ℃ 过夜,洗膜 3 次,每次 10 min。加入HRP标记的羊抗鼠二抗(1∶4 000),室温下孵育2 h,洗膜3次,每次10 min。按发光试剂盒(PIERCE公司)说明书显影,用Gel-Doc凝胶成像系统扫描X线,对条带密度进行半定量分析,分别计算出2株细胞经6-OHDA作用不同时间后Caspase-3活性前体蛋白条带与各自正常细胞Caspase-3活性前体蛋白条带的密度比值,得到各实验组Caspase-3活性前体蛋白表达的百分比。统计学处理后,以6-OHDA作用时间为横坐标,Caspase-3活性前体蛋白表达百分比为纵坐标绘制统计分析图。
1.3 统计学方法
采用Sigma plot 10.0统计软件,数据以均数±标准差()表示。应用Two Way ANOVA析因方差法进行统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 细胞培养
SK-N-SH、SK-N-SH/Nurr1和 SK-N-SH/EGFP 3株细胞形态无明显差异,均呈对数方式增生,SK-NSH/Nurr1细胞增生率最低,SK-N-SH和SK-N-SH/EGFP细胞增生率较为接近[6]。
2.2 Nurr1基因转染细胞的鉴定
免疫细胞化学染色结果显示SK-N-SH和SK-NSH/EGFP细胞Nurr1抗体染色阴性(图1A,1B),而SK-N-SH/Nurr1细胞传代5次Nurr1抗体染色仍为阳性,其阳性细胞胞核深染,胞质及突起淡染(图1C)。荧光显微镜显示EGFP在SK-N-SH/EGFP细胞高表达(1D)。以上结果说明已成功建立稳定过表达外源性Nurr1基因的SK-N-SH 细胞模型SK-N-SH/Nurr1,质粒转染对nurr1检测无影响。
RT-PCR结果显示未转染Nurr1基因的SK-N-SH细胞检测不到Nurr1 mRNA(图2A),而转染Nurr1基因的SK-N-SH/Nurr1细胞检测到高水平的NURRr1 mRNA表达(图2B)。
2.3 过表达nurr1基因促进6-OHDA诱导细胞凋亡比例增加
细胞受到凋亡诱导后不久,磷脂酰丝氨酸(phosphatiylserine,PS)从细胞膜内侧转移到外侧,可被荧光素(fluoresceinisothiocyanate,FITC)标记的钙依赖性磷脂结合蛋白Annexin V特异性地结合[8]。由于PS外露发生早于DNA断裂,联合PI法进行FCM检测,可区分、定量分析4个细胞亚群,包括Annexin V-/PI-的正常细胞亚群(左下象限);Annexin V+/PI-的早期凋亡细胞亚群(右下象限);Annexin V+/PI+的坏死细胞亚群(右上象限),其中包括凋亡晚期和坏死细胞,以及Annexin V-/PI+的受损细胞亚群(左上象限)。
FCM检测结果显示,正常SK-N-SH和SK-N-SH/Nurr1细胞凋亡或坏死细胞亚群比例均较低(图3-1A,B)。较小剂量 6-OHDA(50 μmol/L)作用 12 h,2株细胞凋亡和坏死细胞亚群比例均没有明显变化(图3-1C,D)。当6-OHDA 浓度升至75 μmol/L作用12 h后,SK-N-SH细胞正常亚群比例仍然较高,凋亡细胞亚群比例在 6-OHDA处理后为3.1% ±0.5%(图3-1A,E),而SK-N-SH/Nurr1细胞凋亡亚群比例由6-OHDA处理前的1.1% ±0.6%升至10.1% ±1.1%(图3-1B,F),经统计学分析,2 组细胞凋亡差异显著(P=0.000)。大剂量 6-OHDA(100 μmol/L)作用6 h后,两株细胞凋亡亚群比例比起6-OHDA处理前没有增加(图3-2A,B),而2株细胞坏死亚群比例均明显上升(图3-2C,D);100 μmol/L 6-OHDA 作用12 h后,SK-N-SH细胞坏死亚群升至18.5% ±1.3%,SK-N-SH/Nurr1细胞坏死亚群升至27.4% ±1.7%,经统计学分析,2株细胞坏死亚群比例差异无统计学意义(P=0.080),但均较6-OHDA处理前上升显著,差异有统计学意义(P=0.000),但2株细胞凋亡亚群比例仍然很低,分别为 1.4% ±0.03%和2.2% ±0.17%,差异无统计学意义(P=0.060)(图 3-2E,F)。

图1 免疫组化染色显示Nurr1抗体在SK-N-SH、SK-N-SH/Nurr1和SK-N-SH/EGFP细胞中的表达Fig.1 Immunocytochemical staining results of SK-N-SH,SK-N-SH/Nurr1 and SK-N-SH/EGFP cells with Nurr1 antibody(original magnification 400×)

图2 RT-PCR法检测Nurr1 mRNA在SK-N-SH和SK-N-SH/Nurr1细胞中的表达Fig.2 Nurr1 mRNA in SK-N-SH and SK-N-SH/Nurr1 cells was detected by RT-PCR analysis
2.4 过表达nurr1基因促进6-OHDA诱导细胞凋亡形态改变
TEM观察,正常SK-N-SH和SK-N-SH/Nurr1细胞微绒毛丰富,胞膜完整,线粒体较少,内质网表面有多聚核糖体附着,有核异型现象(图4-1A,B,图4-2A,B)。75 μmol/L 6-OHDA 作用12 h,SK-N-SH 细胞以坏死为主,表现为细胞体肿胀,胞膜崩解,粗面内质网扩张、脱颗粒,线粒体嵴断裂、消失或呈空泡化改变,胞质及胞核内电子密度普遍降低,核内染色质溶解,胞质内可见髓样小体(图4-1C,D),而SK-N-SH/Nurr1细胞出现典型的凋亡形态学改变,表现为细胞形态不规则,细胞膜完整,胞质减少,线粒体基本正常,核内染色质凝集成块状并有边集现象,电子密度明显增加。个别处于凋亡晚期的细胞核可见染色质进一步凝聚,聚集成染色质小块或呈新月形(图4-2C,D)。
2.5 6-OHDA诱导SK-N-SH细胞Caspase-3活性前体蛋白激活
Western blotting印迹结果显示,正常的SK-N-SH和SK-N-SH/Nurr1细胞,在泳道上的32 000处均出现了特异蛋白条带,肉眼观察条带的面积和着色无明显差别。75 μmol/L 6-OHDA 分别作用6、12 h,SK-N-SH细胞各实验组在泳道上的32 000处的条带面积以及着色变化不明显,说明Caspase-3活性前体蛋白表达基本不变。而 SK-N-SH/Nurr1细胞在75 μmol/L 6-OHDA分别作用6、12 h后,各实验组泳道上的32 000处的条带着色随6-OHDA作用时间延长而逐渐减弱(图5 A,B),说明Caspase-3活性前体蛋白表达随6-OHDA作用时间延长而明显下降。用Gel Doc凝胶成像系统进行光密度值分析,并经统计学处理,显示75 μmol/L 6-OHDA 作用 6、12 h,SK-N-SH/Nurr1 细胞Caspase-3活性前体蛋白表达显著低于SK-N-SH细胞(P=0.010)(图6)。
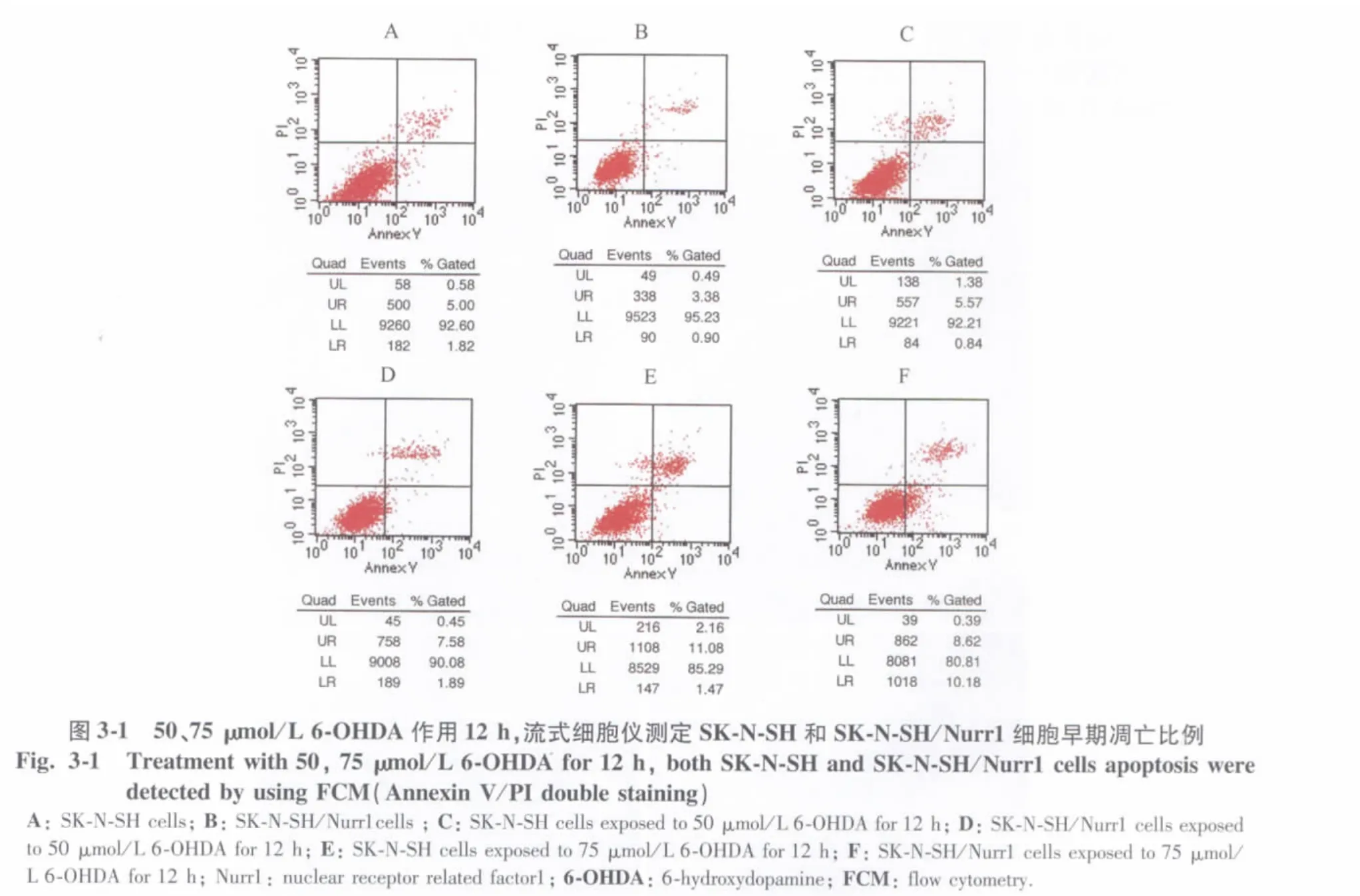
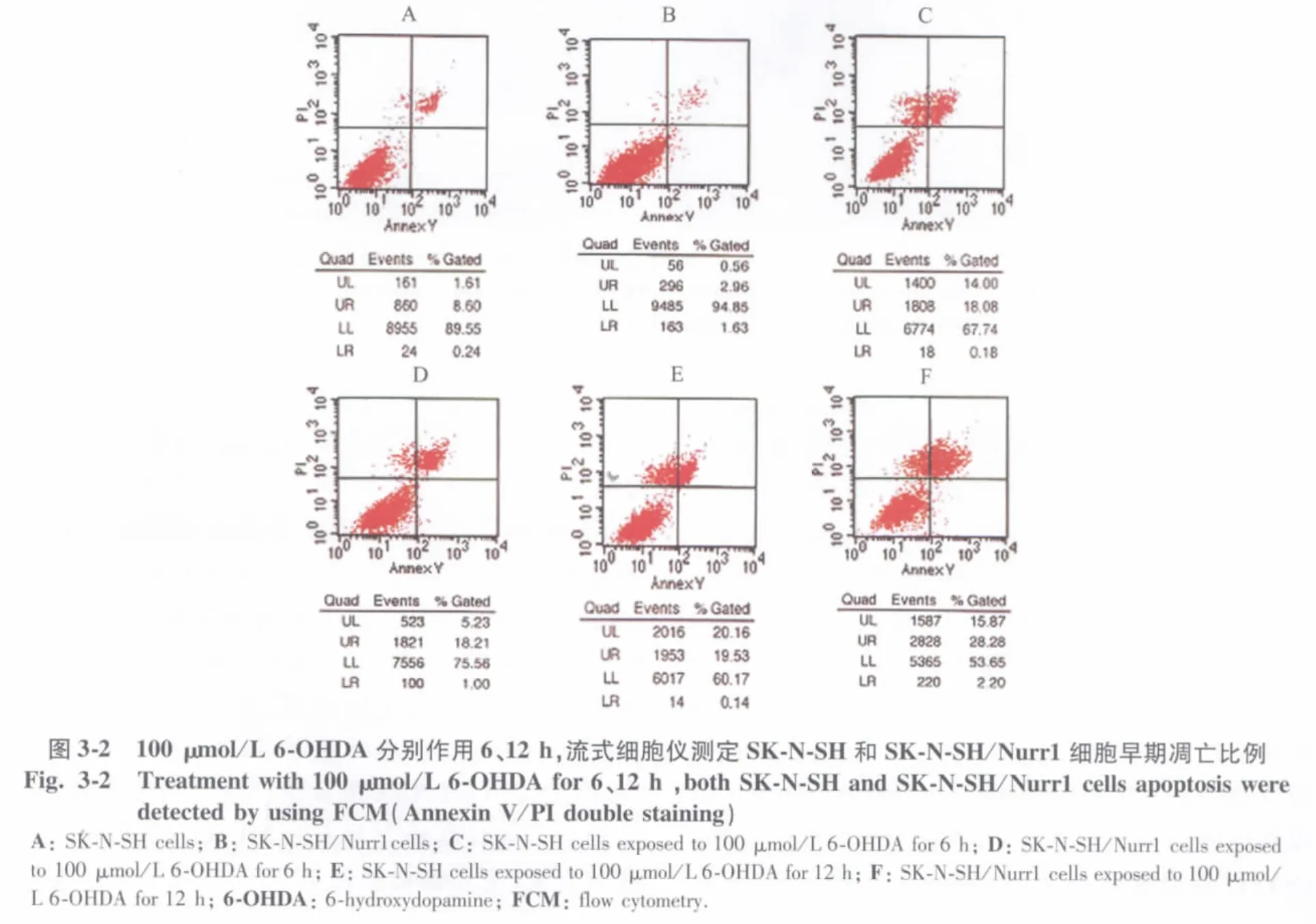

图4-1 75 μmol/L 6-OHDA作用12 h,经透射电镜观察SK-N-SH细胞超微结构Fig.4-1 The ultrastructural changes of SK-N-SH cells were observed by TEM after treatment with 75 μmol/L 6-OHDA for 12 h
3 讨论
本研究通过比较人神经母细胞瘤细胞株SK-NSH细胞和过表达外源性 nurr1基因的SK-N-SH/Nurr1细胞对神经毒素6-OHDA损伤的不同反应,研究过表达中脑特异性转录因子nurr1基因在6-OHDA选择性诱导DA能神经元凋亡中的作用。经6-OHDA作用,2株细胞表现出了不同的病理损伤特征,并且具有毒素剂量、作用时间依赖性:细胞超微结构以及AnnexinV/PI双染联合FCM检测均显示,75 μmol/L 6-OHDA作用12 h,SK-N-SH/Nurr1细胞凋亡比例显著上升,而SK-N-SH细胞主要表现为细胞毒性坏死;大剂量6-OHDA(100 μmol/L)作用不同时间,SK-N-SH和SK-N-SH/Nurr1细胞均表现为坏死。可见,6-OHDA诱发SK-N-SH和SK-N-SH/Nurr1细胞死亡存在细胞凋亡和坏死两条不同途径,在75 μmol/L 6-OHDA作用下,nurr1基因主要激活SK-N-SH/Nurr1细胞凋亡通路,说明6-OHDA的致凋亡作用与细胞种类和剂量相关。体外实验[9]显示,6-OHDA能诱导中脑 DA能神经元、儿茶酚胺细胞系PC12细胞及中脑源性DA能细胞系MN9D等细胞凋亡。Walkinshaw G等[10]最早报道低浓度的6-OHDA(≤100 μmol/L)能诱导PC12出现具有明显生化和形态特征的凋亡,但高浓度的6-OHDA主要诱导细胞毒性损伤,与我们的实验结论一致。


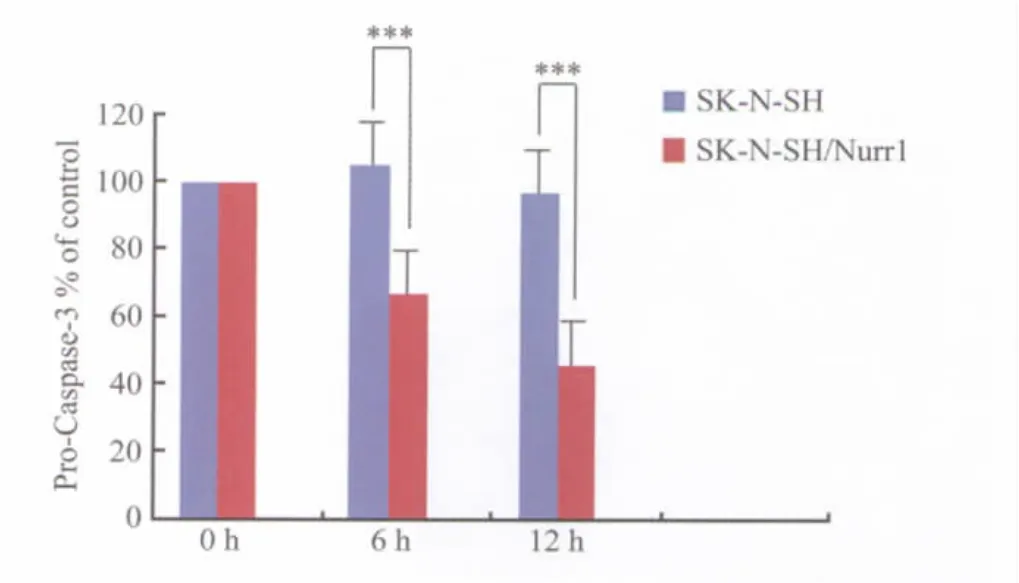
图6 75 μmol/L 6-OHDA 分别作用6、12h,SK-N-SH 和SK-N-SH/Nurr1细胞Caspase-3活性前体蛋白表达的变化Fig.6 Comparison of pro-Caspase-3 in SK-N-SH and SK-N-SH/Nurr1 cells treated with 75 μmol/L 6-OHDA for 6、12 h
在体外,过表达nurr1基因可促进前体细胞向DA能神经元分化,如在过表达nurr1的成年海马前体细胞,nurr1可直接与酪氨酸羟化酶 (tyrosine hydroxylase,TH)基因的启动子结合,在不引起神经元分化的情况下激活th转录[11];若将过表达nurr1的C17.2细胞与腹侧中脑来源的Ⅰ型星型胶质细胞共培养,则可诱导大量的 th阳性神经元产生[12];我们也已经报道[7],过表达nurr1基因的 SK-N-SH/Nurr1细胞能表达成熟神经元的特异性标识物-微管相关蛋白2(microtubule-associated protein 2,MAP-2),证明外源性nurr1基因过表达可促进SK-N-SH细胞向成熟神经元方向分化。以上研究表明nurr1表达与DA能神经元的表型关系密切,经6-OHDA作用后,DA能神经元死亡形式可能与nurr1基因存在某些关联。
Nurr1及其相关基因nurr1、nor-1共同组成核受体超家族中的NURR77亚家族,该亚家族成员由即早基因编码[13],各种刺激如生长因子、细胞因子、缺血等都能引起这些基因快速短暂的表达上调[14],参与细胞生存、增生以及凋亡过程。nurr1对凋亡过程的调节还不甚明了,但是nur77调节T细胞和肿瘤细胞凋亡通路研究较为深入[15-17]。nur77可以上调促凋亡基因如Fas配体、肿瘤坏死因子相关凋亡诱导配体(TRAIL)[18-20]。信号传导因子JNK的激活以及Akt的抑制可促使nur77由细胞核转移至细胞质[21],与线粒体Bcl-2组成凋亡前体复合物刺激凋亡反应[22-23]。此外,PKC的活化可导致nur77表达上调,对T细胞受体信号诱导胸腺细胞凋亡起到重要作用[24]。
研究[25]发现,在PD病人和动物模型的中脑黑质致密部,Caspase-3,作为神经元凋亡的重要调控因子,其前体蛋白被激活的DA能神经元显著增加。存在急慢性神经退行性疾病的实验动物,其病理改变检测到Caspase-3的激活,尤其在使用6-OHDA诱发PD后,Caspase-3前体蛋白激活后诱发凋亡过程。
由此,我们推测作为转录因子,nurr1基因可能具有调节不同信号传导通路的作用,最终是否激活Caspase-3途径,关系到细胞坏死、凋亡或免受损伤等不同结局,相关分子机制有待进一步研究。
[1]Eells J B.The control of dopamine neuron development,function and survival:insights from transgenic mice and the relevance to human disease[J].Curr Med Chem,2003,10(10):857-870.
[2]Schapira A H.Pathogenesis of Parkinson’s disease[J].Baillieres Clin Neurol,1997,6(1):15-36.
[3]Zetterstrom R H,Solomin L,Jansson L,et al.Dopamine neuron agenesis in Nurr1-deficient mice[J].Science,1997,276(5310):248-250.
[4]Xu P Y,Liang R,Jankovic J,et al.Association of homozygous 7048G7049 variat in the intron six of Nurr1 gene with Parkinson’s dusease[J].Neurology,2002,58(6):881-884.
[5]Hartmann A,Hunot S,Michel P P,et al.Caspase-3:A vulnerability factor and final effector in apoptotic death of dopaminergic neurons in Parkinson’s disease[J].Proc Natl Acad Sci U S A,2000,97(6):2875-2880.
[6]刘扬,赵咏梅,张海燕,等.外源性Nurr1基因过表达增强SK-N-SH细胞对神经毒素6-OHDA敏感性的研究[J].中国药理学通报,2005,21:1171-1176.
[7]赵咏梅,张海燕,刘扬,等.外源性Nurr1基因过表达对SK-N-SH细胞分化作用的研究[J].神经解剖学杂志,2005,21(1):23-28.
[8]Andree H A,Reutelingsperfger C P,Hauptmann R,et al.Binding of vascular anticoagulant alpha(VAC alpha)to planar phospholipids bilayers[J].J Biol Chem,1990,265(9):4923-4928.
[9]Lotharius J,Dugan L L,O’Malley K L.Distinct mechanisms underlie neurotoxin-mediated cell death in cultured dopaminergic neurons[J].J Neurosci,1999,19(4):1284-1293.
[10]Walkinshaw G,Waters C M.Neurotoxin-induced cell death in neuronal PC12 cells is mediated by induction of apoptosis[J].Neuroscience,1994,63(4):975-987.
[11]Sakurada K,Ohshima-Sakurada M,Palmer T D,et al.Nurr1,an orphan nuclear receptor,is a transcriptional activator of endogenous tyrosine hydroxylase in neural progenitor cells derived from the adult brain[J].Development,1999,126(18):4017-4026.
[12]Wagner J,Akerud P,Castro D S,et al.Induction of a midbrain dopaminergic phenotype in Nurr1-overexpressing neural stem cells by type 1 astrocytes[J].Nat Biotechnol,1999,17(7):653-659.
[13]Maruyama K,Tsukada T,Ohkura N,et al.The NGFI-B subfamily of the nuclear receptor superfamily[J].Int J Oncol,1998,12(6):1237-1243.
[14]Maruyama K,Tsukada T,Bandoh S,et al.Expression of NOR-1 and its closely related members of the steroid/thyroid hormone receptor superfamily in human neuroblastoma cell lines[J].Cancer Lett,1995,96(1):117-122.
[15]Li Q X,Ke N,Sundaram R,et al.NR4A1,2,3-an orphan nuclear hormone receptor family involved in cell apoptosis and carcinogenesis[J].Histol Histopathol,2006,21(5):533-540.
[16]Youn H D,Sun L,Prywes R,et al.Apoptosis of T cells mediated by Ca2+-induced release of the transcription factor MEF2[J].Science,1999,286(5440):790-793.
[17]Wilson A J,Arango D,Mariadason J M,et al.TR3/Nur77 in colon cancer cell apoptosis[J].Cancer Res,2003,63(17):5401-5407.
[18]Weih F,Ryseck R P,Chen L,et al.Apoptosis of nur77/N10-transgenic thymocytes involves the Fas/Fas ligand pathway[J].Proc Natl Acad Sci U S A,1996,93(11):5533-5538.
[19]Rajpal A,Cho Y A,Yelent B,et al.Transcriptional activation of known and novel apoptotic pathways by Nur77 orphan steroid receptor[J].EMBO J,2003,22(24):6526-6536.
[20]Chintharlapalli S,Burghardt R,Papineni S,et al.Activation of Nur77 by selected 1,1-bis(3'-indolyl)-1-(p-substituted phenyl)methanes induces apoptosis through nuclear pathways[J].J Biol Chem,2005,280(26):24903-24914.
[21]Li H,Kolluri S K,Gu J,et al.Cytochrome c release and apoptosis induced by mitochondrial targeting of nuclear orphan receptor TR3[J].Science,2000,289(5482):1159-1164.
[22]Lin B,Kolluri S K,Lin F,et al.Conversion of Bcl-2 from protector to killer by interaction with nuclear orphan receptor Nur77/TR3[J].Cell,2004,116(4):527-540.
[23]Han Y H,Cao X,Lin B,et al.Regulation of Nur77 nuclear export by c-Jun N-terminal kinase and Akt[J].Oncogene,2006,25(21):2974-2986.
[24]Kim H,Lee J E,Kim B Y,et al.Menin represses JunD transcriptional activity in protein kinase C theta-mediated Nur77 expression[J].Exp Mol Med,2005,37(5):466-475.
[25]Dodel R C,Du Y,Bales K R,et al.Peptide inhibitors of caspase-3-like proteases attenuate 1-methyl-4-phenylpyridinum-induced toxicity of cultured fetal rat mesencephalic dopamine neurons[J].Neuroscience,1998,86(3):701-707.
