超声波降解法对壳聚糖结构的影响研究
2011-04-27李军立张波马力
李军立,张波,马力*
(西华大学生物工程学院,成都,610039)
1 引言
甲壳素是由N-乙酰-2-氨基-2-脱氧-D-葡萄糖以β-1.4糖苷键形式连接而成的多糖,壳聚糖(Chitosan)是甲壳素的N-脱乙酰产物,结构单元是氨基葡萄糖的二糖,一般而言,N-乙酰基脱去55%以上的就可称之为壳聚糖,是自然界中唯一的天然阳离子高聚物[1],是天然存在的唯一碱性多糖,也被誉为第六大生命要素[2,3], 其pKa值为6.3[4,7],这种脱乙酰度的壳聚糖能溶于1%的乙酸或者1%的盐酸。
低分子量(黏均分子量小于5×104)壳聚糖不仅具有一些与壳聚糖相似的性质,而且比高分子量壳聚糖有着更为广泛的应用,还具有其特殊的生理生化活性,因此,便出现了各种各样的有关壳聚糖的降解的方法,但这些方法或多或少的对壳聚糖的结构有着一定的影响,而壳聚糖的特殊的生理生化活性与其特殊的分子结构是密不可分的,因此,考究一种方法是否科学可行,是否对壳聚糖结构造成严重破坏,是评价这种方法优劣的重要手段,为此,本论文在前人研究的基础上,来探讨超声波降解法对壳聚糖结构的影响,并验证这种方法科学可行性。本部分实验通过单因素实验来研究超声功率对壳聚糖结构的影响,并利用红外光谱法找出最适的超声波功率范围。
2 实验材料与仪器
2.1 实验材料
壳聚糖(D.D.84.24%、分子量为97013)
济南海得贝海洋生物工程有限公司
溴化钾(分析纯)
成都市邛崃宏旺化工贸易有限公司
其他所用药品均为分析纯
2.2 实验仪器
JY92-2D超声波细胞粉碎机
宁波新芝科器研究所
Heto Lyolab3000冷冻干燥机
安徽省尚马科工贸有限公司
傅立叶红外光谱仪
天津市拓普仪器有限公司
2.3 实验方法
2.3.1 准备实验
2.3.1.1 原料的预处理
首先,称取20g的原料壳聚糖加入1000mL预先制备好的1%的盐酸溶液中,用磁力搅拌器搅拌至壳聚糖充分溶解后,抽滤,除去不溶解的壳聚糖和杂质,收取滤液,再向滤液中加入1mol/L的氢氧化钠溶液调pH值至9,使得所溶解的壳聚糖充分沉淀,低速离心5min后,弃上清液,回收沉淀,用去离子水反复冲洗沉淀直至pH值为中性,离心分离,重复3~5次后,将沉淀进行冷冻干燥后,密封保存。
2.3.1.2 壳聚糖脱乙酰度测定[8]
准确称取0.3~0.5g 壳聚糖样品,置于250 mL烧杯中,加入足量的 0.1mol/L HCl 溶液(30mL),在20~30℃用磁力搅拌器搅拌2~3 h 至完全溶解,加5至6滴指示剂,用标准0.1mol /L NaOH 溶液滴定,至溶液变成浅蓝绿色。另称取一份样品,于105℃烘干至恒重,测水分。每个样品各做三次。通过测定氨基含量,便可以测的壳聚糖的脱乙酰度(D.D.)。
① NH2/%=[(C1V1-C2V2)×0.016/G(100-W)]×100
②脱乙酰度(D.D.)/%=(NH2%/9.94%)×100
式中,C1——盐酸标准溶液的浓度(mo1/L);
C2——氢氧化钠标准溶液的浓度(mo1/);
V1——加入的盐酸标准溶液的体积(mL);
V2——滴定消耗的氢氧化钠标准溶液的体积(mL);
G——样品的质量(g);
W——样品中含有的水分(%);
0.016 ——与1mL的1mol/L盐酸溶液相当的氨基量(g)
2.3.1.3 壳聚糖分子量测定[9]
本实验采用乌氏粘度计法测定壳聚糖的分子量,根据下面公式[η]=KMνa可计算出原料壳聚糖的黏均分子量Mν。其中[η]为样品黏度;K、a为系数,根据脱乙酰度选定相关数值。
2.3.1.4 壳聚糖的超声波降解
准确称取1g精制后的壳聚糖溶解于100 mL1%盐酸溶液中,直至完全溶解,共配制5份,然后分别在超声功率为350W、400W、450W、500W、550W作用下,将壳聚糖溶液间歇式超声处理120min(仅计超声时间)后,超声降解期间,温度控制在40℃左右。超声完成后快速将每份的降解产物在45℃减压浓缩1h,然后分别对每份用1mol/L NaOH溶液调节溶液的pH值为9,收集沉淀,用丙酮反复洗涤至中性,冷冻真空干燥,利用乌氏黏度计测定每份溶液黏度,即可获得不同的低聚分子量壳聚糖M1、M2、M3、M4、M5。
2.3.1.5 红外光谱检测
采用溴化钾压片法对降解后的壳聚糖M1、M2、M3、M4、M5的结构进行检测,并对降解前后壳聚糖结构发生的变化进行探讨。
2.4 实验结果与分析
2.4.1 壳聚糖脱乙酰度测定结果
① NH2/%=[(C1V1-C2V2)×0.016/G(100-W)]×100
②脱乙酰度(D.D.)/%=(NH2%/9.94%)×100
C1——盐酸标准溶液的浓度(mo1/L);本实验C1=0.0998 mo1/L
C2——氢氧化钠标准溶液的浓度(mo1/L);本实验C2=0.103mo1/L
V1——加入的盐酸标准溶液的体积(mL);本实验V1=30mL
V2——滴定消耗的氢氧化钠标准溶液的体积(mL);本实验平均消耗V2=7.5mL
G——样品的质量(g);本实验G=0.5g
W——样品中含有的水分(%);本实验W=15.0799%
经实验测定NH2%=8.37%;D.D.%=84.24%
2.4.2 壳聚糖分子量测定结果
由实验测定可知,壳聚糖黏度[η]=87.27mL·g-1,通过查阅资料可得K=1.424×10-3mol/g,a=0.96,代入公式[η]=KMνa便可以得到原料壳聚糖的黏均分子量97013。
2.4.3 壳聚糖超声波降解结果与分析
5份壳聚糖试样在降解温度、超声时间、溶液浓度一定,超声功率不同的条件下,降解后每份溶液黏度、分子量与功率的关系如表2.1。

表2.1 超声功率与降解后溶液黏度和分子量的关系
2.4.4 降解产物的红外光谱与分析
按照2.3.1.5的使用方法测定原料壳聚糖经过不同功率超声波降解后,各分子量大小的壳聚糖的红外光谱图实验结果如下:
(1) 原料壳聚糖的红外检测结果与分析
按照按照2.3.1.5的使用方法测定降解后壳聚糖的红外谱图见图2.1。
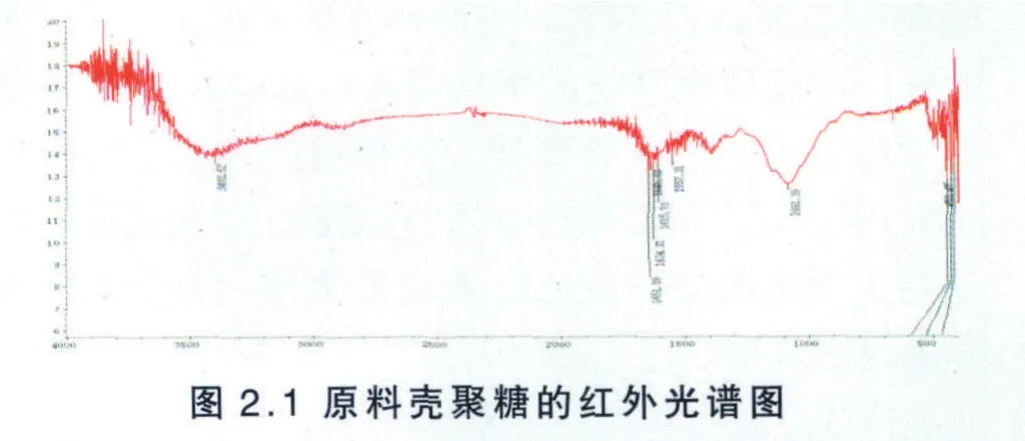
由图2.1可知,在3402.52cm-1左右的宽峰是O─H的伸缩振动吸收峰与N─H的伸缩振动吸收峰重叠而成的多重吸收峰,并对应于残糖基上的羟基和氨基,并且这个峰的宽窄可以反映出分子内和分子间氢键的强弱程度,在2919 cm-1~2880 cm-1之间分别对应着残糖基上的甲基或次甲基的C─H伸缩振动吸收峰,图2.2中并不是很明显。原料壳聚糖的酰胺Ⅰ谱带在1651.80 cm-1左右,为α-壳聚糖,β-壳聚糖为1631cm-1左右[10],此吸收峰的强弱可以判断壳聚糖的晶型,并反映的乙酰氨基[11],该峰的强弱与脱乙酰度有直接关系。原料壳聚糖的酰胺Ⅱ谱带在1557 cm-1左右,该吸收峰在各文献中的报道差异较大,有时相差50cm-1左右[12],脱乙酰度的高低决定了壳聚糖分子中酰胺基团参与分子内和分子间的氢键的数目和种类不同,因此该吸收峰的强弱也反映了脱乙酰度的高低。该壳聚糖的酰胺Ⅲ谱带在1400cm-1左右,由图2.1可知,壳聚糖的C─H弯曲和─CH3对称变形振动吸收峰为1398cm-1。C6─OH是一级羟基,在1091.39cm-1有特征吸收峰,而C3─OH是二级羟基,在1120cm-1有特征吸收峰,这两个特征吸收峰用于检测甲壳素或者壳聚糖的衍生化反应,用处很大,只要测出这两个峰的峰面积或峰高就可以知道反应是发生在一级羟基上还是在二级羟基上。
(2) 350W超声波降解后的壳聚糖红外检测结果与分析
同样按照按照2.3.1.5的使用方法测定降解后壳聚糖的红外谱图见图2.2。
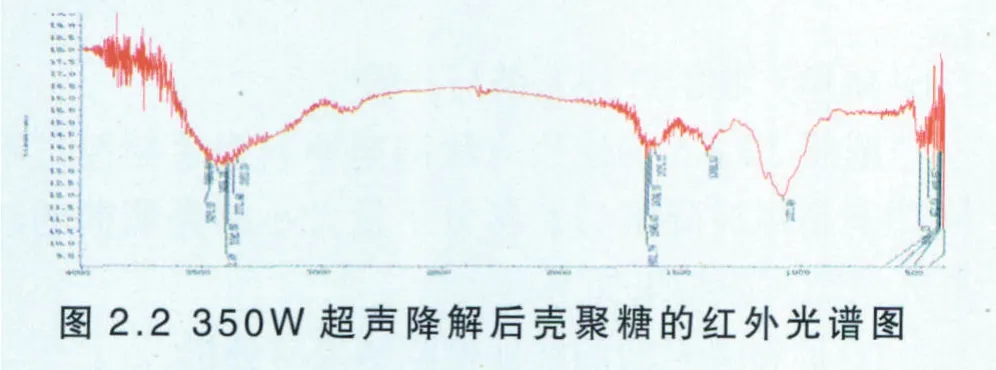
由图2.2可知,O─H的伸缩振动吸收峰与N─H的伸缩振动吸收峰重叠而成的多重吸收峰出现在3402.80cm-1左右,与原料壳聚糖相比,无显著变化,并且残糖基上的甲基或次甲基的C─H伸缩振动吸收峰也无显著变化。壳聚糖的酰胺Ⅰ谱带在1651.79 cm-1左右,与原料极为接近,说明壳聚糖的晶型未发生改变,脱乙酰度未发生较大改变。壳聚糖的酰胺Ⅲ谱带在1389.10 cm-1左右与原料壳聚糖接近,并且一级羟基和二级羟基均与原料壳聚糖接近,因此,在超声功率为350W下超声两小时,除了分子量降低外并未对壳聚糖的结构造成显著影响。
(3) 400W超声波降解后的壳聚糖红外检测结果与分析
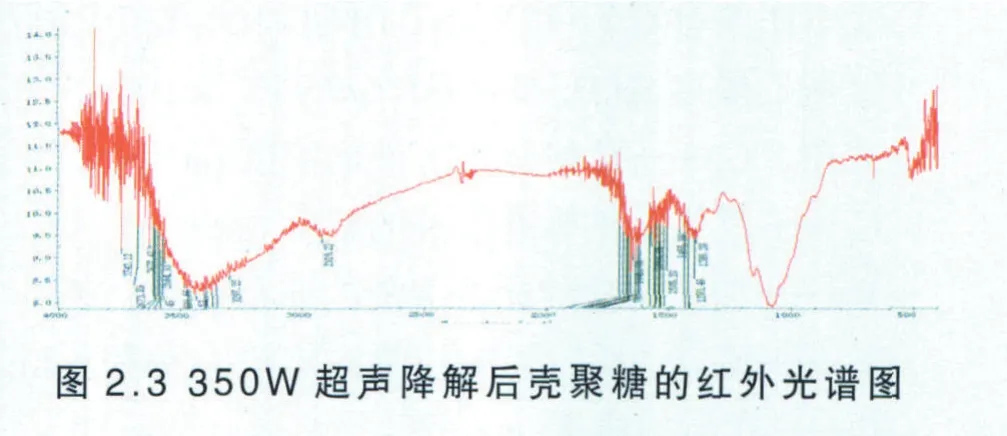
同样按照按照2.3.1.5的使用方法测定降解后壳聚糖的红外谱图见图2.3。
由图2.3可知,在400W超声波下降解两小时后的壳聚糖的结构与原料壳聚糖的结构相比,未发生显著变化,降解后的壳聚糖的O─H的伸缩振动吸收峰与N─H的伸缩振动吸收峰重叠而成的多重吸收峰均在3042 cm-1左右,说明壳聚糖分子内和分子间的氢键作用并未发生显著变化。
(4) 450W超声波降解后的壳聚糖红外检测结果与分析
同样按照按照2.3.1.5的使用方法测定降解后壳聚糖的红外谱图见图2.4。
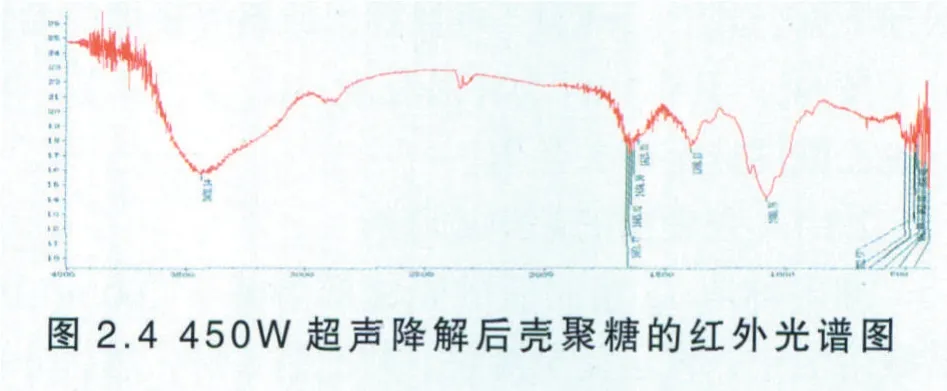
由图2.4可知,O─H的伸缩振动吸收峰与N─H的伸缩振动吸收峰重叠而成的多重吸收峰出现在3438.14 cm-1左右,可能是因为壳聚糖分子内和分子间氢键作用的改变所致,同样一级羟基C6─OH也发生较小位移,总的来说,超声功率为450W的超声波,对壳聚糖降解后的结构影响不显著。
(5) 500W超声波降解后的壳聚糖红外检测结果与分析
原料壳聚糖在超声功率为500W的超声波下作用两小时后的红外光谱结果如下:
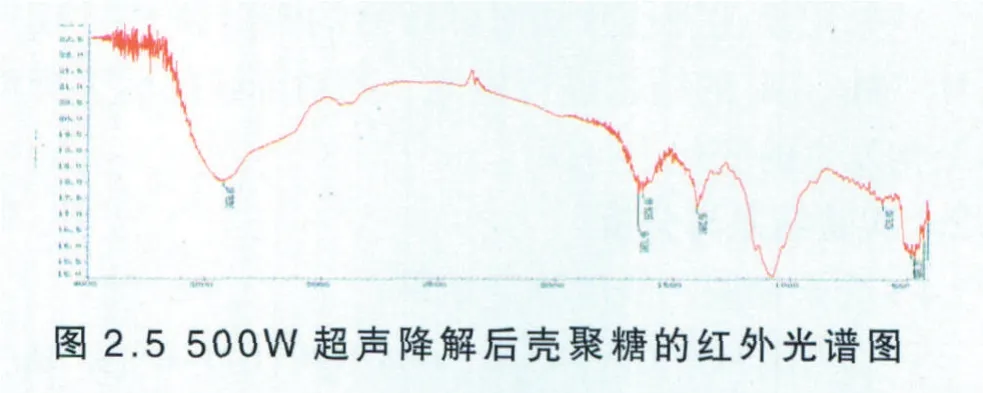
由图2.5可知,降解后的壳聚糖的O─H的伸缩振动吸收峰与N─H的伸缩振动吸收峰重叠而成的多重吸收峰出现在3424.43cm-1左右,与原料壳聚糖的吸收峰接出现位置相比发生位移,说明了壳聚糖分子内和分子间的氢键作用有所改变,壳聚糖的C─H弯曲和─CH3对称变形振动吸收峰也发生较小的位移,总的来说壳聚糖的基本结构未发生显著性变化。
(6) 550W超声波降解后的壳聚糖红外检测结果与分析
同样按照按照2.3.1.5的使用方法测定降解后壳聚糖的红外谱图见图2.6。
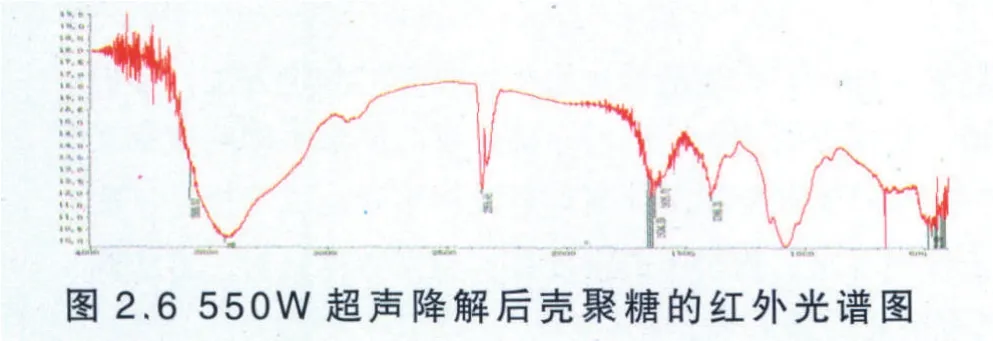
由图2.6可知,壳聚糖的O─H的伸缩振动吸收峰与N─H的伸缩振动吸收峰重叠而成的多重吸收峰的峰宽较原料壳聚糖的峰宽变窄,原因是壳聚糖分子内和分子间的氢键被削弱所致,并且降解后壳聚糖的酰胺Ⅰ谱带吸收峰出现在1634.28 cm-1左右,较原料壳聚糖发生较严重的偏移,可能是因为壳聚糖的乙酰氨基含量发生了较大变化,此外,还在3585.53 cm-1处出现了吸收峰,原因是样品中含有微量的结晶水或游离水所致。总的来说,550W的超声波对壳聚糖降解后结构的影响较显著。
3 结论
通过超声波降解壳聚糖的研究结果表明,随着超声功率的增加,降解后壳聚糖的结构的影响也逐渐增加,为了保证降解后壳聚糖的结构不发生显著变化,并结合其他原因,所采用的超声波超声功率不宜超过550W,并可以得到质量优良的低聚壳聚糖。
[1] 陈小娥,夏文水,余晓斌.微生物壳聚糖酶研究进展[J].海洋科学,2004,28(3):72—76
[2] 蒋挺大.壳聚糖[M].北京:化学工业出版社,2001:1—9
[31 武美霞.氧化降解法制备低聚壳聚糖[J].山西大同大学学报,2008,24(5):24—25
[4] 寇晓亮,王琛.超声波辅助氧化剂降解壳聚糖的研究[J].印染助剂,2010,11(11):27
[5] 野口川藏,荒户和子,驹井乔.工业化学标志.1969, 72:796
[6] Muzzarelli R A A.Anal.Chim.Acta.1971,54: 133
[7] Cravotto,Giancarlo.Chemical modification of chitosan under high-intensity ultrasound[J].Ultrasonics Sonochemistry,2005,12(1-2):95-98
[8] 吴小勇,曾庆孝,曾峰,等.碱量法测定壳聚糖脱乙酰度计算公式中存在的一个问题的探讨[J].广州食品工业科技,2004,20(4):96.
[9] 曹宗顺,卢凤琦.药用壳聚糖生物降解膜的研制[J].中国医药工业杂志,1996,27(1):14
[10] Blackwell J.Methods in Enzymol.1988,161:435
[11] Domszy J G,Roberts G A F.Makromol.Chem.1985,186: 1671
[12] Miya M, Iwamoto R, Yoshikawa S.Int.J.Biol.Macromol.1987, 54: 55
