TNF-α对银屑病患者成纤维细胞基因表达的影响
2011-04-27武警陕西总队医院西安710054程随涛张衍国吕雅洁张惠中余春艳
武警陕西总队医院(西安 710054) 徐 皓 程随涛 张衍国 吕雅洁 张惠中 余春艳
银屑病是一种表皮过度增殖为特征的慢性皮肤病,发病机理尚不明确,近年来研究表明银屑病皮损中成纤维细胞存在异常,认为成纤维细胞可能是银屑病发病的重要因素之一。肿瘤坏死因子-α(TNF-α)作为一种炎症因子,在银屑病的发病中具有重要作用,我们采用 GeneChip Human Genome U133 Plus2.0芯片研究以 TNF-α为刺激条件下,寻常型银屑病患者成纤维细胞基因表达谱的变化情况,为进一步研究成纤维细胞在银屑病发病中的作用提供相应的理论支持。
材料与方法
1 材 料 胎牛血清购自杭州四季青公司,DMEM、PBS购自 GIBCO公司,硫酸链霉素、氨苄青霉素购自华北制药股份公司,TRIZOL购自INVIT ROGEN公 司,TNF-α购 自 ABD公司。GeneChip Human Genome U133 Plus2.0芯片为Affymetrix公司产品。
2 方 法 ①成纤维细胞的培养:见参考文献[1]。利用小鼠抗型胶原一抗进行细胞鉴定。②TNF-α对皮肤成纤维细胞基因表达影响的检测:实验组加入 TNF-α15ng/ml,72h培养,空白对照组未加。贴壁细胞培养诱导结束后,弃去培养液基。加入 Tizol,按照Trizol总 RNA抽提试剂盒说明书分别提取总 RNA,用电泳及分光光度计测 A260/A280鉴定 mRN A质量。 RNA定量,反转录合成双链 cDNA并进行纯化。用Bio Array High Yield RNA Transcrip tLableling体转录合成生物素化 cRNA。cRNA片断化,与Affymetrix133芯片杂交、染色、洗涤。
3 统计学分析 用 Microarray SuitVersion 5.0和 Data Mining Tool Version 2.0获取芯片杂交信息,进行数据处理和分析。采用 Genmapp和 Mappfinder进行功能聚类和途径分析,该软件中的数据库(生物途径图)来源于 KEGG数据库,并与 Gene Ontology(GO)Consortium链接,在 Genmapp运行结果的基础上,对基因差异表达数据在分析生物过程、分子功能和细胞组分进行聚类分析,并进行显著相关性统计分析。
结 果
1 杂交与扫描结果 将基因芯片与制备的探针杂交后,扫描 Cy3与 Cy5两种荧光信号的强度和比值,用专用软件分析,差异表达的标准为基因表达变化在 2倍以上者为阳性。根据 GO分类与 GENE M APP分类,差异表达基因共有 730条,其中上调基因 395条,下调 335条。
2 散点图分析 分别以参加比对两组数据的对数值(Ln)作为横纵坐标作图,沿 45度对角线方向分布的基因,表示它在两样本中的表达量是相同的。距离对角线垂直距离越远的基因,表示它在某一样本中的差异表达程度越大。设 R=S/C(S代表纵坐标上归一化后的样本数据,C代表横坐标上归一化后的样本数据)。
3 功能聚类分析 对差异显著基因,即变化倍数在 2倍及 2倍以上的基因进行 Mappfinder功能聚类分析。具体分布情况见表 1。
4 与免疫相关的基因名称及生物学过程 见表2。
讨 论
基因芯片的特点是大规模、高通量和高平行性地研究成千上万个基因的表达情况,广泛应用于基因功能的研究[2]。银屑病是一种以表皮过度增殖为特征的慢性皮肤病,病因和发病机制尚不清楚。现研究表明银屑病患者成纤维细胞可维持银屑病皮损表皮的高增殖状态,产生较高水平的 IL-6、IL-8[3]、角质形成细胞生长因子[4]。故认为银屑病成纤维细胞通过旁分泌释放高水平的细胞因子可能是造成角质形成细胞过度增殖的重要始动因素[5]。 TNF-α在银屑病的发病中具有重要的作用。为了研究成纤维细胞在银屑病发病中的作用,我们用基因芯片分析了在 TNF-α作用下,银屑病患者成纤维细胞基因表达谱的变化。结果表明在TNF-α单一因素的作用下,银屑病患者成纤维细胞基因表达谱发生了重大变化,有 730条基因表达有明显变化,涉及合成、分解、加工、修饰、运输、调控、细胞周期和凋亡等多个生物过程。在这些基因中,还有近 1/3的基因功能未知。提示在 TNF-α的刺激下成纤维细胞可能通过合成和分泌多种因子,造成细胞周围环境的多因素变化,从而引起角质形成细胞的过度增殖。其中涉及免疫的基因有 31条,在以往银屑病研究中已有相关报道有 IL-15、 C3和 PLA2G4C,未见相关报道有IL-32、CD163、CD83、PTX3、鸟苷酸结合蛋白 (GBP1)等。IL-15在银屑病皮损整个表皮以及直接与表皮基底细胞接触的真皮细胞高表达,而在正常皮肤中只有表皮下部的角质形成细胞表达[6]。我们实验证实银屑病患者成纤维细胞在 TNF-α的刺激下 IL-15的基因表达明显升高,说明银屑病患者皮损中的 IL-15不仅仅是来源于免疫系统,真皮内的成纤维细胞可能是皮损中 IL-15的重要来源,这与以往研究相符合,同时也证明我们试验的可靠性与结果的可信性。C3在补体系统中主要参与旁路激活途径,表现为感染早期的非特异性免疫,其水解片段具有多种生物活性,如过敏毒素作用、中性粒细胞的趋化作用,增强炎症反应,调节免疫功能和促进炎症因子的产生等。C3对中性粒细胞具有趋化作用,中性粒细胞释放的溶酶体激活补体,形成中性粒细胞、T淋巴细胞、角质形成细胞的相互作用恶性环路,促使银屑病反复发作及慢性化。
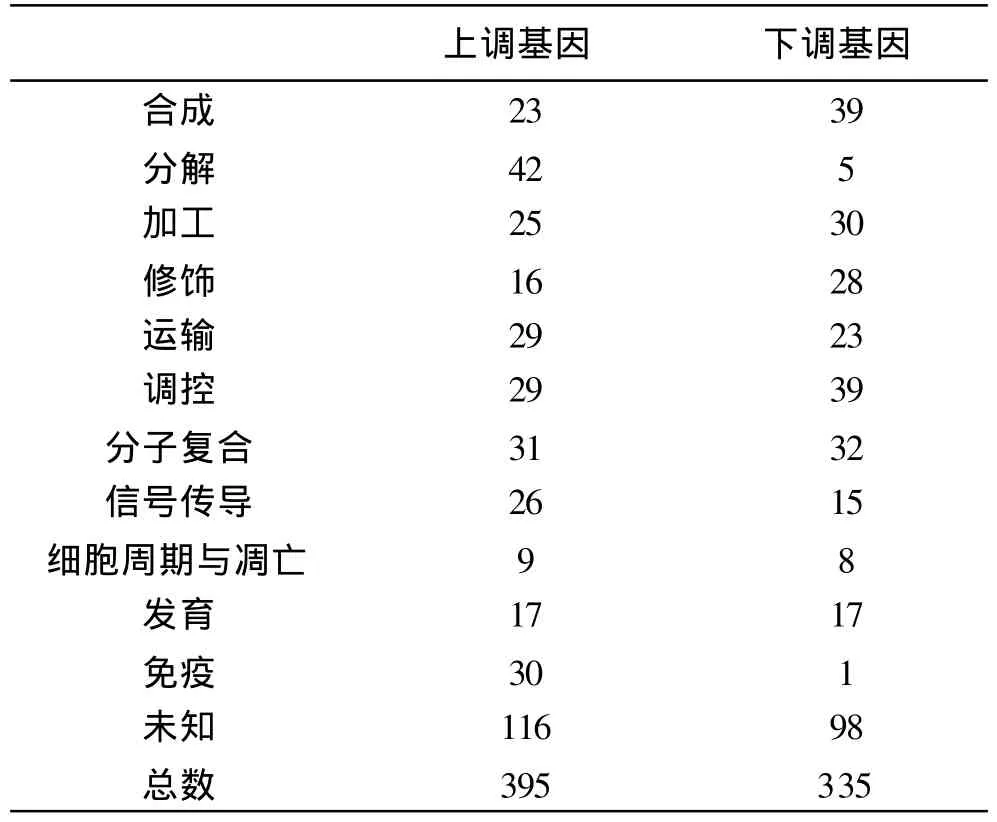
表1 按照 GO标准进行生物学活性过程分类
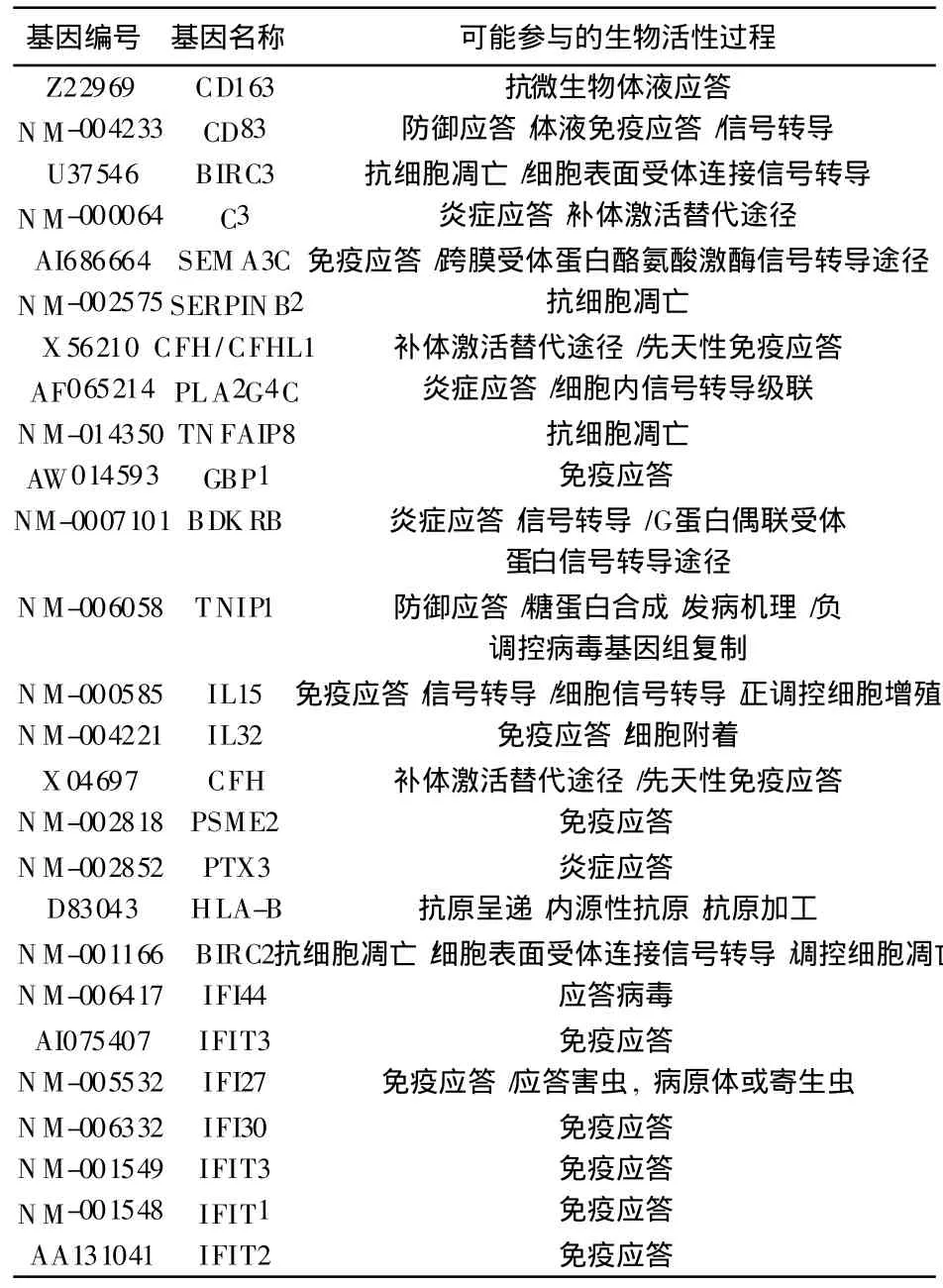
表2 与免疫相关的基因名称及生物学过程
PLA2G4C磷脂酶 A2(PLA2)是一类催化磷脂二位酰基水解的酶族,是花生四烯酸、溶血磷脂等炎性介质生成的限速酶,促进炎性介质和细胞因子的释放和激活,直接影响炎性病变的发展和预后。虽然没有直接证据证明 PLA2与银屑病发病相关,但是体外试验表明 PLA2通过酶解产物花生四烯酸,诱导角质形成细胞殖[7]。因此 PLA2可能与银屑病发病相关。
IL-32是先天免疫中的关键效应器。具有趋化外周血单核细胞作用。 IL-32 α通过活化 NF-κ B和 p38 MAPK的磷酸化诱导多种炎症因子包括 TNF-α的表达。本实验结果提示银屑病患者成纤维细胞在 TNF-α的刺激下,释放 IL-32,IL-32诱导产生 TNF-α,放大TNF-α的效应,参与了银屑病 TNF-α恶性循环的形成。CD163血色素-结合珠蛋白复合物的受体,通过调节血红素氧合酶-1的表达,参与抗炎、抗氧化作用。CD163具有单核细胞-巨噬细胞特异性,在炎症组织或血液循环的单核细胞中,CD163的表达增高。IL-6,IL-10和糖皮质激素促使 CD163表达上调,而干扰素和TNF-α使其表达下调[8]。本试验表明 CD163可能不仅仅表达在单核细胞和巨噬细胞上,也表达在成纤维细胞上,在 TNF-α刺激下成纤维细胞的 CD163基因表达不是降低,而是明显增高。这与以往的研究结果不符,是否由于银屑病患者的成纤维细胞功能紊乱造成,还需进一步深入研究。
CD83是细胞表面Ⅰ型膜糖蛋白。不仅仅是成熟树突状细胞(DC)的标志,还是 DC发挥其激发免疫应答作用中不可缺少的功能分子。分为膜结合型和可溶型,膜结合型 CD83增强 T细胞应答,促进免疫反应的作用。可溶性 CD83具有强大的免疫反应抑制作用,抑制DC的成熟和 T细胞的增殖[9]。 PTX3结合蛋白相关基因,是 TNF诱导表达基因之一。作为炎症急性期反应蛋白,PTX3特异性结合在凋亡细胞的细胞核膜上,能够提高血管内皮细胞对 TNF的敏感性,提高细胞合成 TNF诱导的细胞因子。GBP1鸟苷酸结合蛋白(GBP1),简称 G蛋白。 由α、β和γ三个亚单位组成,α亚单位上有鸟苷酸结合位点。主要在激素受体结合的部分与腺苷环化酶之间起调节作用。当 G蛋白上结合的鸟苷酸为 GT P时则激活而发挥作用,但当 G蛋白上的 GTP水解为 GDPA时则失去活性。当激素与受体结合时,活化的受体与 G蛋白的α亚单位结合,促使其与β、γ亚单位脱离,通过对腺苷酸环化酶起激活或抑制作用,从而实现激素对细胞内功能的调节。
试验中银屑病患者成纤维细胞在 TNF-α的刺激下,不仅仅是激活免疫的细胞因子基因表达增高,而且抑制免疫的细胞因子基因表达也升高。此外还涉及到炎症、细胞增殖与凋亡等多方面原因,其病理变化不是一种细胞因子造成的,而是多种细胞因子共同改变的结果,许多基因其生物学过程与功能并不是十分清楚。越来越多的研究表明 TNF-α与银屑病关系密切。说明银屑病患者皮肤成纤维细胞可能合成免疫相关细胞因子的功能失衡,在银屑病的发病中具有重要的意义。这些免疫相关的基因与银屑病的发病关系还需进一步深入研究。
[1] 李海红.人皮肤成纤维细胞的培养和鉴定[J].中国危重病急救医学杂志,2005,17(2):89.
[2] Dasu M R,Hawkins HK,Barrow RE,et al.Gene expressi on profiles from hypertrophic scar fibroblasts before and after IL-6stimulation[J].J Pathol,2004,202:476~ 485.
[3] Zalewska A,Glowacka E,Wyczolkowska J,et al.Sysa-Jedrzejowska,Interleukin 6 and 8 levels in plasma and fibroblast cultures in psoriasis[J].Mediators Inflamm,2006,81:767.
[4] Kovacs D,Falchi M,Cardinali G,et al.Immunohistoche mical analysis of keratinocyte growth factor and fibroblast growth factor10 expression in psoriasis[J].Exp Dermatol,2005,(14):130-137.
[5] 赵小东,付 萌,卢 涛,等.银屑病成纤维细胞培育上清对角质形成细胞增殖的影响 [J].中华现代皮肤科学杂志,2004,1(2):34-35.
[6] 张国龙,张学军,张胜权,等.IL-15在寻常型银屑病患者皮损中的表达 [J].安徽医科大学学报,2006,(04):34-35.
[7] Sjursen W,Brekke OL,Johansen B.Secretory and cytos olic phospholipase A(2)regulate the long-term cytokineinduced eicosanoid production in human keratinocytes[J].Cytokine,2000,(12):1189-1194.
[8] Weaver LK,Pioli PA,Wardwell K,et al.Up-regulation of human monocyte CD163 upon activation of cell-surface Toll-like receptors[J].J Leukoc Biol,2007,(18):663-671.
[9] Fujimoto Y,Tu L,Miller AS,et al.CD83expression influences CD4+T cell development in the thymus[J].Cell,2002,108:755-767.
