豫中平原区紫花苜蓿根部入侵病原真菌的种类及其分布特征
2011-04-25郭玉霞严学兵王成章樊文娜姜义宝李德锋
郭玉霞,严学兵,王成章,樊文娜,姜义宝,李德锋
(河南农业大学牧医工程学院,河南 郑州 450002)
紫花苜蓿(Medicagosativa)是世界上栽培最早、分布面积最大的多年生优质豆科牧草,粗蛋白质含量和营养价值高,适口性好,素有“牧草之王”的美誉[1]。随着苜蓿种植面积的扩大和集约化程度的逐步提高,苜蓿病害愈发严重。我国尚无病害引致苜蓿损失的全国性资料。据估计,全世界每年因病虫、杂草等危害作物和牧草造成的损失高达35%[2],其中美国每年因病害导致生产损失达40亿美元之多,仅每年因病害使苜蓿干草减产25%,种子减产10%,按1972年价格计算就为4亿美元[3]。由于根病的发生,苜蓿种群密度不断下降,在建植数年之内,使单位面积的株数可减少84%,严重降低草地的利用价值。
我国中部地区是重要的农业生产区,拥有良好的土壤、水热条件,也非常适合紫花苜蓿的高产栽培和优质牧草生产。苜蓿草产量的高低与根系特征成正相关,根系特征决定植物产草量的潜能,而且根系特征还与苜蓿品种有关[4]。苜蓿根腐病是一种世界性病害,在苜蓿栽培地区普遍发生,已经成为产量和品质的重要制约因素之一。发病初期,仅仅是个别支根和须根感病,并逐渐向主根扩展,主根感病后,早期植株不表现症状,后随着根部腐烂程度的加剧,吸收水分和养分的功能逐渐减弱,病情严重时,将造成植株的死亡。河南省是传统农业生产区,地域和气候属于过渡地带,地形以平原为主。由于土壤、水热等条件非常适合于种植紫花苜蓿,近几年苜蓿产业发展很快,但问题是河南省雨热同季,生产中的病害问题一直困扰其产量和品质,特别是根部病害尤为严重。根腐病的发生是病原(真菌种类)、环境(土壤和气候)和寄主(苜蓿品种)的综合作用。我国已发现有36种真菌对苜蓿造成危害[5],已经报道的苜蓿根腐病病原已达30种,其中镰刀菌15种,其他病原真菌12种,细菌2种,线虫1种[5-8]。郭玉霞等[9]根据近25年的文献报道统计发现,国内外的苜蓿根部入侵真菌分别为20和86种。由于各地生态、气候、土壤以及栽培条件等不同,其土壤微生物区系会有所不同,病原菌的种类亦有很大差异。张静妮[10]总结不同地区的主要病害后认为,我国在苜蓿病害调查研究中存在明显的地区不平衡的现象,西北地区各省份苜蓿病害的调查研究较为全面,尤其是内蒙、新疆等地。华北地区苜蓿病害调查基础薄弱,仅报道了3种苜蓿病害,而相对于东北和西北地区,华北等地区有较多的降水和较高的平均气温,更适宜于苜蓿病原菌生长,苜蓿病害近几年比较严重,亟待加强苜蓿根部病害的研究。不同苜蓿品种对病害表现出不同的抗病性和根部真菌入侵规律,鉴于此,本研究在豫中平原以国内外31个紫花苜蓿品种为材料,研究根部入侵病原真菌的种类及其带菌率与紫花苜蓿品种和生长季节的关系,确定不同季节和品种的优势菌种,旨在明确中原地区不同品种和季节真菌区系的表现规律,为根部病害的防治和品种选择提供科学依据。
1 材料与方法
1.1试验地概况 试验地位于河南省长葛市大周乡黄庄村(113°34′~114°08′ E,34°09′~34°21′ N),海拔135~165 m。属暖温带半湿润、大陆性季风气候,四季分明,年均温14.3 ℃,历年最热月(7月)平均气温28 ℃,最冷月(1月)平均气温-2 ℃;极端最高气温和最低气温分别为40和-20 ℃。常年降水量为700 mm左右。年均日照时间2 175.1 h,平均无霜期218 d。沙质土壤,其有机质含量为0.95%,全氮0.42%,全磷0.18%。

表1 参试苜蓿品种及其秋眠级
1.2参试品种、试验设计与栽培管理 选择秋眠级(fall dormancy class,FD)为2~8级的31个紫花苜蓿品种为试验材料(表1)。试验地采用随机区组法设计,重复4次,于2003年10月26日播种。每个小区面积13.5 m×3.0 m。播种行距0.3 m,每公顷理论播种量15.0 kg,实际播种量按理论播种量除以种子用价(纯净度×发芽率)计算。播前浇一次底墒水,每公顷施过磷酸钙600 kg和尿素375 kg作底肥。生长期间,定期进行中耕、除草和灌溉。春季苜蓿返青时每公顷施用225 kg尿素作追肥。试验期间,没有喷施任何杀菌剂。
1.3苜蓿根部入侵真菌的分离 分别于2006年5月2日(春季-最适生长期)、7月10日(夏季-炎夏高温期)、10月6日(秋季-晚秋秋眠期)3次取不同苜蓿品种的根样。每小区按“Z”字形取4株根样,取样深度为0~30 cm。取样方法为:用铁锨将苜蓿的根挖出,将取好的各品种根样连同土壤装进自封塑料袋,编号后带回实验室置于4 ℃冷藏箱中备用。根据Nan[11]的方法进行苜蓿侧根根部入侵真菌的分离,具体方法是:将取自田间的各品种苜蓿根样用解剖刀将其侧根从主根上切取,在自来水下冲洗干净,用0.3%次氯酸钠溶液消毒1 min,再用无菌水冲洗3次,在无菌滤纸(130 ℃烘烤5 h)上吸干沾附水分,然后在无菌滤纸上随机将根系切为2 mm左右的根段置于含有青霉素、链霉素各100 mg/L的马铃薯葡萄糖琼脂培养基(ABPDA)上,每皿10个根段,最后将培养皿(直径90 mm)移入20 ℃黑暗恒温培养箱中进行培养。从第3天起统计每皿带菌根段数,并及时将分离到的真菌菌落分别转接到PDA培养基上于20 ℃下进行纯化培养,获得纯培养,供进一步鉴定和下一步试验备用。待试验结束时,分别计算每培养皿的根段带菌率及各真菌分离率。
1.4真菌的鉴定 对培养的真菌菌落,详细观察记载其菌落大小、形态及在PDA培养基上的颜色,逐一制片镜检,根据沈崇尧[12]、张中义等[13]、王振辰等[14]及Nelson 等[15]方法将其鉴定到种,个别真菌鉴定到属。
1.5资料统计与分析 用Microsoft Excel进行数据处理及DPS 6.55 Patch软件对数据进行完全随机双因素有重复(真菌分离率的数据分析时进行了反正弦转化的处理)、统计分析和差异显著性检验。
2 结果
2.1入侵真菌的种类、分离率及其季节表现特征 在参试的31个苜蓿品种中,共分离到16 种根部入侵真菌,其中春、夏、秋季分别分离到15、14、8种(表2~表7),按照其平均分离率的高低依次为:锐顶镰孢(Fusariumacuminatum)(15.3%)、柱孢(Cylindrocarpondestructuns)(14.2%)、细交链孢(Alternariaalternata)(14.0%)、立枯丝核菌(Rhizoctoniasolani)(12.2%)、尖孢镰孢(F.oxysporum)(8.8%)、腐皮镰孢(F.solani)(6.3%)、燕麦镰孢(F.avenaceum)(2.9%)、多隔镰孢(F.decemcellulare)(2.7%)、半裸镰孢(F.semitectum)(2.5%)、胶帚霉(Gliocladiumsp.)(1.3%)、青霉(Penicilliumsp.)(0.9%)、枝孢(Cladosporiumherbarum)(0.8%)、茎点霉(Phomamedicaginis)(0.6%)、匐柄霉(Stemphyliumbotryosum)(0.3%)、轮枝菌(Verticilliumsp.)(0.3%)和粉红胶帚霉(G.roseum)(0.2%)。其中前9个(除燕麦镰孢外)病菌在3个生长季节大部分苜蓿品种上均均能分离到,而后7个病菌只在部分或少数品种某个生长季节分离到。

表2 不同品种和生长季节的苜蓿根部带菌率和入侵锐顶镰孢分离率 %
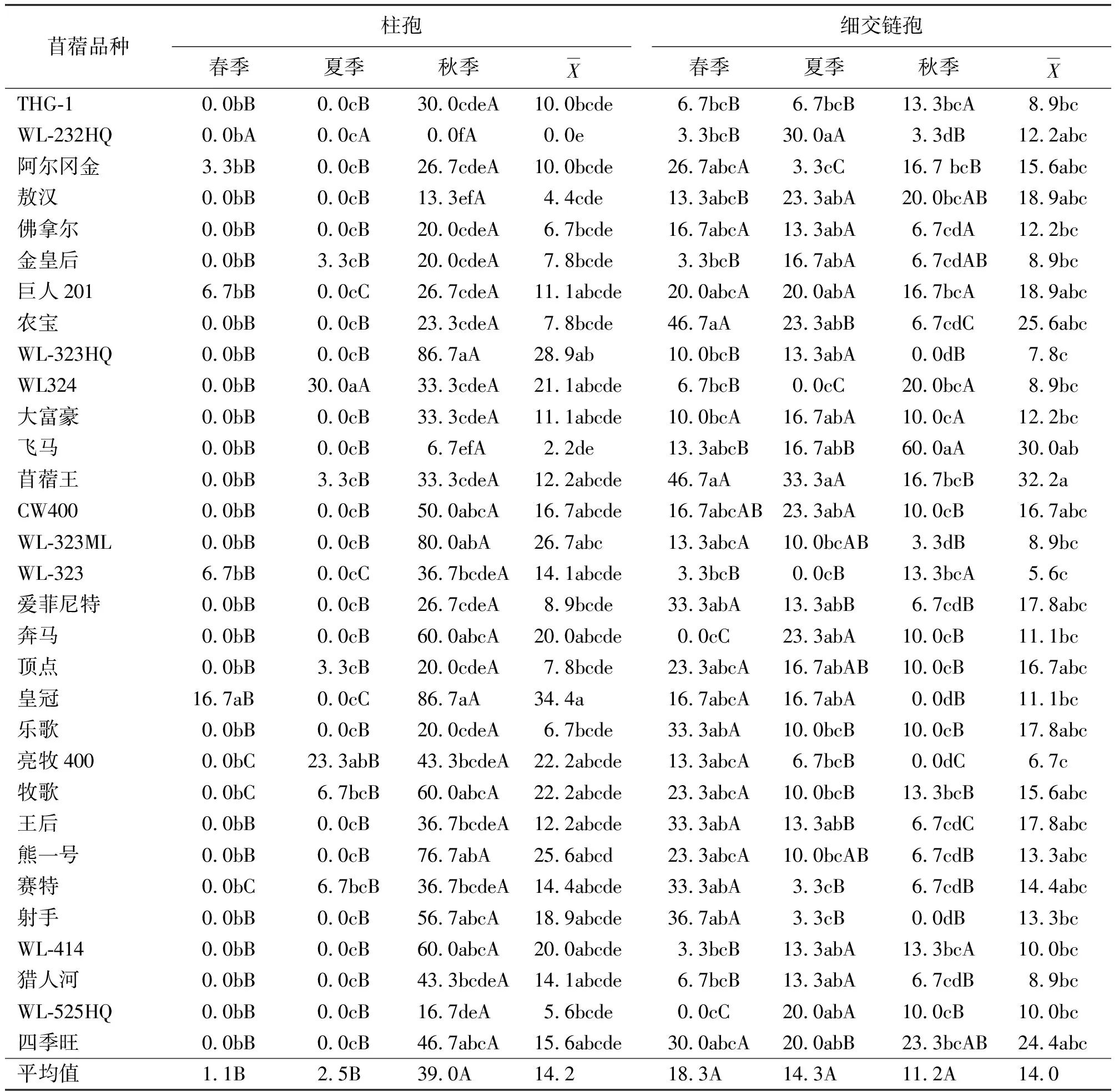
表3 不同品种和生长季节的苜蓿根部入侵柱孢和细交链孢分离率 %
不同生长季节苜蓿根部入侵真菌区系中优势菌种明显不同。春季分离到15种,以细交链孢、立枯丝核菌、尖孢镰孢和腐皮镰孢分离率较高,相应为18.3%、14.0%、10.4%和7.1%;夏季也分离到14种根部入侵真菌,其中出现较多的为锐顶镰孢、细交链孢、尖孢镰孢和立枯丝核菌,其分离率分别为24.8%、14.3%、11.3%和10.2%;秋季共分离到8种真菌,以柱孢、锐顶镰孢、立枯丝核菌和细交链孢的分离率较高,分别为39.0%、19.8%、12.4%和11.2%(表2~表7)。

表4 不同品种和生长季节的苜蓿根部入侵腐皮镰孢、燕麦镰孢和青霉分离率 %
2.2生长季节、品种和秋眠级对带菌率的影响 随着生长季节的延长各苜蓿品种的根部带菌率逐渐增高,大多数苜蓿品种秋季的根部平均带菌率显著高于春、夏季(P<0.05)。阿尔冈金和乐歌春、夏、秋3个季节的带菌率分别为63.3%和70.0%、66.7%和76.7%、93.3%和96.7%,其秋季带菌率显著高于春、夏季(P<0.05)。敖汉和猎人河春、夏、秋3个生长季节的根部带菌率分别为88.3%和76.7%、90.0%和80.0%、93.3%和83.3%,但3个生长季节的带菌率差异均不显著(P>0.05);然而,也有苜蓿品种春、夏、秋3个季节的根部带菌率依次升高,如WL-323ML的3个季节的根部带菌率分别为76.7%、90.0%和100.0%,春季的带菌率比夏季降低了13.3%,但二者不显著(P>0.05);比秋季显著降低了23.3%(P<0.05),夏季的带菌率比秋季降低了10.0%,但二者不显著(P>0.05)。少部分品种的夏季带菌率最低,如THG-1、佛拿尔、射手和WL-525HQ(表2~表7)。
不同苜蓿品种在不同生长季节其根部主要的入侵真菌种类亦有明显的不同,根部各真菌出现频率与生长季节和苜蓿品种有关。春季以王后、WL-525HQ(100.0%)的带菌率最高,夏季以WL-232HQ、苜蓿王和CW400(均为100.0%)的带菌率最高,而秋季以THG-1、巨人201、WL-323HQ、飞马、苜蓿王、WL-323ML、皇冠、亮苜400、牧歌、射手、WL-525HQ和四季旺的带菌率(均为100.0%)高。从不同苜蓿品种3个生长季节的平均带菌率来看,以苜蓿王最高,其次为WL-525HQ、赛特和四季旺,4个品种的根部平均带菌率均显著高于飞马和THG-1,苜蓿王的带菌率也显著高于阿尔冈金、佛拿尔和金皇后(P<0.05),其余品种间差异不显著(P>0.05);THG-1的带菌率最低,其次为飞马和金皇后。其中平均带菌率较高的5个苜蓿品种依次为:苜蓿王、WL-525HQ、赛特、四季旺和敖汉;平均带菌率较低的5个苜蓿品种依次为:阿尔冈金、佛拿尔、金皇后、飞马和THG-1(表2~表7)。

表5 不同品种和生长季节的苜蓿根部入侵立枯丝核菌和尖孢镰孢分离率 %

表6 不同品种和生长季节的苜蓿根部入侵多隔镰孢和半裸镰孢分离率 %
在相同生长季节,不同苜蓿品种各真菌分离率也存在差异。就春季而言,在31个苜蓿品种中,分离到最高比率的某一特定真菌的苜蓿品种为:农宝、苜蓿王的细交链孢(46.7%)、WL-324的腐皮镰孢(33.3%)、WL-324的锐顶镰孢(23.3%)、WL-324的尖孢镰孢(33.3%)、敖汉的半裸镰孢(13.3%)、皇冠的柱孢(16.7%)、阿尔冈金的枝孢(13.3%)、大富豪与WL-323ML及WL-525HQ的立枯丝核菌(30.0%)、WL-525HQ的多隔镰孢(26.7%)、WL-414的燕麦镰孢(30.0%)、WL-232HQ的青霉(33.3%)、爱菲尼特与熊一号的茎点霉(20.0%)及WL-323的轮枝菌(13.3%)为最高。夏季的真菌分离率则分别以苜蓿王的细交链孢(33.3%)、王后的腐皮镰孢(23.3%)、WL-323的锐顶镰孢(66.7%)、WL-324的尖孢镰孢(33.3%)、猎人河的半裸镰孢(20.0%)、WL-324的柱孢(30.0%)、WL-232HQ的立枯丝核菌(36.7%)、顶点的多隔镰孢(30.0%)、佛拿尔的燕麦镰孢(30.0%)、乐歌的茎点霉(30.0%)为最高。而秋季的真菌分离率分别以飞马的细交链孢(60.0%)、顶点的腐皮镰孢(43.3%)、WL-232HQ的锐顶镰孢(63.3%)、阿尔冈金的尖孢镰孢(30.0%)、皇冠和WL-323的柱孢(86.7%)、农宝和WL-323的的立枯丝核菌(40.0%)以及牧歌的多隔镰孢(16.7%)为最高。
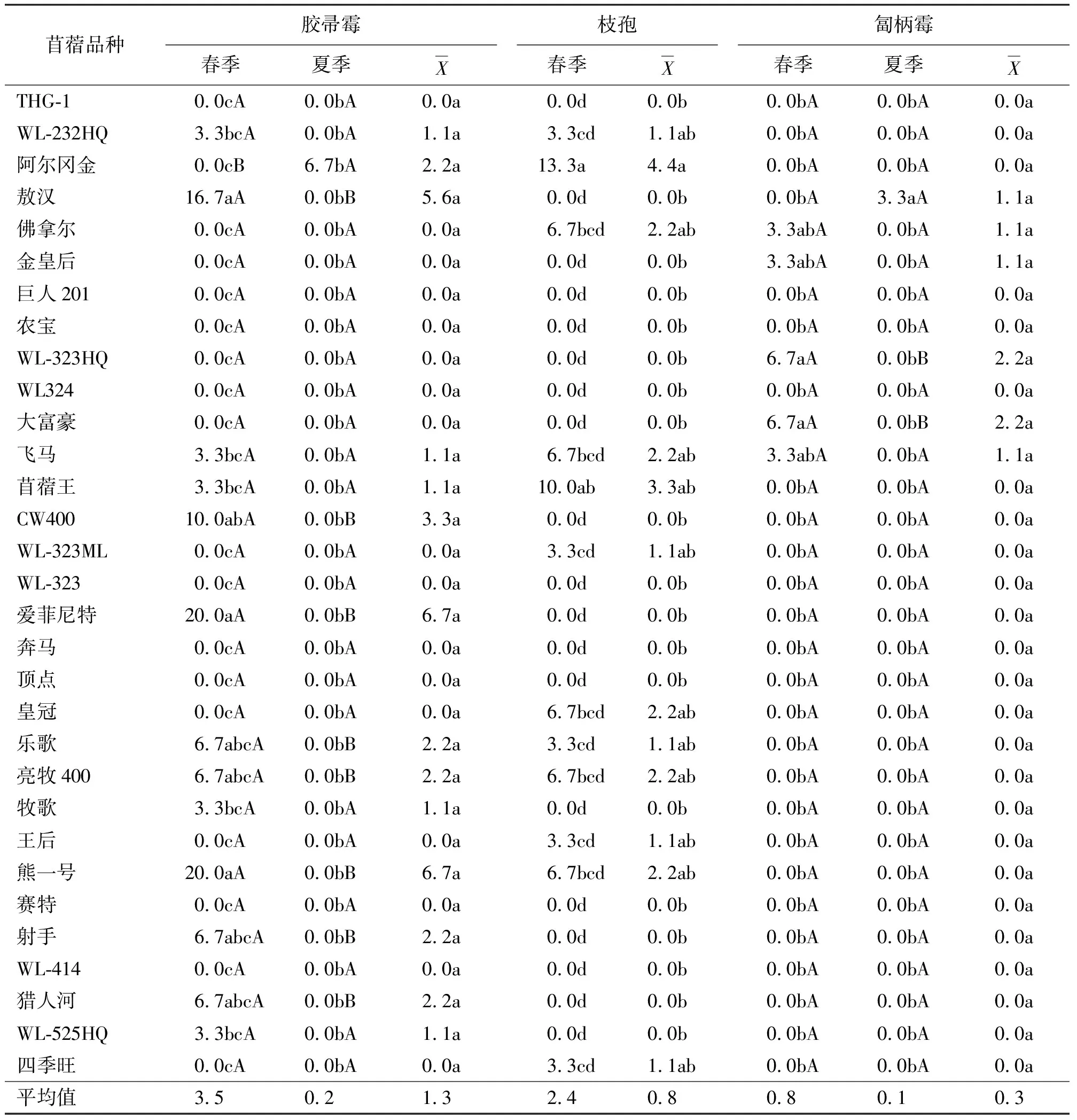
表7 不同品种和生长季节的苜蓿根部入侵胶帚霉、枝孢和匐柄霉分离率 %
从苜蓿秋眠级角度来说,在同一生长季节,各秋眠级的苜蓿其带菌率并无明显规律性,说明各秋眠级苜蓿的带菌率与其秋眠级无相关性。同一秋眠级的苜蓿,不同苜蓿品种在不同的生长季节其带菌率也有所不同(表8)。
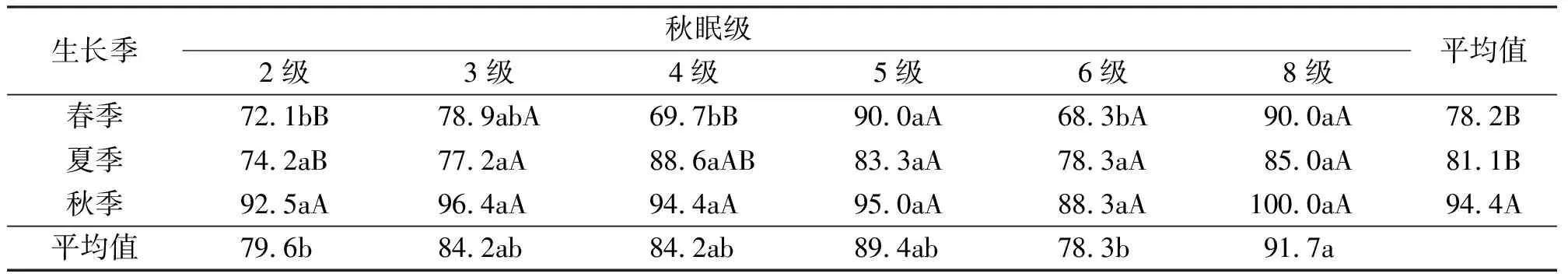
表8 不同秋眠级苜蓿的带菌率 %
3 讨论
在参试的31个苜蓿品种共分离到16种根部入侵真菌,均是我国和其他国家苜蓿[16-31]及其他作物[32-37]常见的真菌种类。通过比较不同季节真菌种类及其带菌率,发现苜蓿品种在不同的生长季节有着不同的病原真菌和优势菌种。苜蓿根部入侵的镰刀菌、立枯丝核菌及腐霉(Pythiumspp.)的分离率因生长季节和苜蓿品种不同而存在显著差异[38];在整个生长季内(苜蓿第1茬的分枝期、开花期、成熟期和第3茬分枝期),苜蓿根部的带菌率随生长季的延长而增高[22]。不同季节土壤真菌数量不同,夏季>秋季>春季>冬季,而且不同季节土壤真菌的主要类群也不同[39]。本研究表明,大多数苜蓿品种秋季的根部平均带菌率显著高于春季与夏季(P<0.05)、不同生长季节苜蓿根部入侵真菌区系中优势真菌种类存在明显不同。因在寒冷的冬季,大多数真菌数量下降,春、夏季的温度等生态条件适宜使其真菌数量不断累积所致,至于有些苜蓿品种的根部入侵真菌种类及分离率夏季最高或最低,可能与该病菌适应高温或不适应高温条件有关[37]。在中原地区苜蓿生产中,夏季是根部病害频繁发生的季节,然而,在本研究中,夏季的根部带菌率并不是最高,大多数苜蓿品种秋季的根部带菌率显著高于春、夏季(P<0.05),春、夏季的带菌率相同或相似;部分品种春、夏、秋季的根部带菌率依次升高。由此可以看出,带菌率的高低并不能决定是否发病和病害的发生程度,环境是重要的调控因素。真菌生长的最适温度范围为20~30 ℃,苜蓿的根腐病在27~30 ℃时最严重[37]。根据中原地区(长葛气象站)近10年的气象资料,夏季(6-8月)的月平均温度分别是26.31、27.13和25.82 ℃。6月非常适宜真菌生长,7月开始适宜病害发生,8月又进入了真菌快速生长时期。温度的变化完全能够解释本研究不同季节的带菌率和实际生产中的病害发生规律,也就是说,在中原地区,苜蓿根部病害夏季发生最严重的主要原因是温度。由此说明在较高温度条件下,镰刀菌在病原和寄主的相互作用中占主导地位。较高的温度可能直接影响一些真菌的生长,但影响其产毒能力的温度有时不尽相同,因此,干扰植物的生理过程也有所不同,从而影响其抗病性[37]。在本研究中,各真菌出现的频率与苜蓿品种有关的结果与上述研究结果[40]不尽一致,可能与试验地的生态条件不同[41-43]有关。苜蓿根部入侵真菌种类是寄主、环境、病原和生产活动共同作用的结果,如生长生育阶段、土壤营养成分含量、降水量和温度、田间管理技术和种植的作物种、品种以及种植体系等均可对当茬及后茬作物的病害产生重要影响;不同的地理生态区域,其土壤微生物区系和病原菌的种类亦有差异,农艺耕作措施、土壤质地类型、植物种及其基因型都是决定土壤微生物区系组成的重要因素[44-45];而且土壤区系中不同的碳源会造成土壤微生物种类的差别[46]。
在本研究中,不同品种的带菌率表现出很大的差异,平均带菌率较高的5个苜蓿品种依次为:苜蓿王、WL-525HQ、赛特、四季旺和敖汉。阿尔冈金、佛拿尔、金皇后、飞马和THG-1等的带菌率较低。根据以上品种在中原地区生长表现和生产性能测定,带菌率较高的有些品种同样拥有良好的生长表现和生产性能,带菌率较低的品种并不一定是当地的优良品种[1]。根据本研究的带菌率似乎不能解释实际的生产表现,也不能指导生产实践,主要原因是在特定的环境条件下,在环境、病原和寄主之间存在特殊的依存关系[37]。本研究发现,不同生长季节苜蓿根部入侵真菌区系中优势菌种存在差异,其中细交链孢、腐皮镰孢为3个季节共同的建群种;不同季节其真菌建群种不同的真菌有:春季的半裸镰孢和尖孢镰孢,夏季的尖孢镰孢和半裸镰孢,秋季的锐顶镰孢和柱孢。因此,在中原地区种植紫花苜蓿前的品种选择时,尽量选用对建群真菌抗性强的品种,综合参试品种的生产性能和带菌率及抗病性的角度,THG-1、飞马和金皇后应该广泛种植和推广。同时,也应该重视苜蓿科学的管理技术,保证植物健康生长,以增强对这些真菌的抗性。秋眠性是反映不同品种在秋季短日照条件下的生长表现,表明,不同苜蓿品种的带菌率与其秋眠级无相关性,说明秋眠级在与抗病性之间无明显关系,在根部入侵真菌及其病害防治方面无太大指导价值。另外,在中原地区,根据秋眠级选择高产的紫花苜蓿品种也没有得到相应的证据支持[1]。
[1]王成章.不同苜蓿品种的生产性能和其秋眠性调控研究[D].郑州:河南农业大学,2004.
[2]南志标.建立中国的牧草病害可持续管理体系[J].草业学报,2000,9(2):1-9.
[3]南志标.我国的苜蓿病害及其综合防治体系[J].动物科学与动物医学,2001,18(4):1-4.
[4]赵艳.不同苜蓿品种根系特征及其与草产量关系的研究[D].兰州:甘肃农业大学,2008.
[5]南志标,李春杰.中国牧草真菌病害名录[J].草业科学,1994,11(增刊):1-160.
[6]郭玉霞.黄土高原草田轮作系统中苜蓿与小麦的根部入侵真菌[D].兰州:甘肃农业大学,2003.
[7]Summers C G.Integrated pest management in forage alfalfa [J].Integrated Pest Management Reviews,1998,3:127-154.
[8]Stuteville D L,Erwin D C.A Compendium of Alfalfa Diseases [M].Minnesota:The American Phytopathological Society Press,1990:1-59.
[9]郭玉霞,南志标,王成章,等.苜蓿根部入侵真菌研究进展[J].草业学报,2009,18(5):243-249.
[10]张静妮.不同秋眠等级苜蓿匍柄霉叶斑病抗性评价及抗病机理研究[D].北京:北京林业大学,2008.
[11]Nan Z B.Fungicide seed treatments of sainfoin control seed-borne and root-invading fungi [J].New Zealand Journal of Agricultural Research,1995,38:413-420.
[12]Barnett H L,Hunter B B.半知菌属图解[M].沈崇尧译.北京:科学出版社,1977.
[13]张中义,冷怀琼,张志铭,等.植物病原真菌学[M].成都:四川科学技术出版社,1998.
[14]王振辰,郑重,叶琪明,等.常见镰刀菌鉴定指南[M].北京:中国农业科技出版社,1996.
[15]Nelson P E,Toussoun T A,Marasas W F O.Fusarium Species an Illustrated Manual for Identification [M].Philadelphia:The Pennsylvania State University Press,1983.
[16]陈耀,闵继淳,肖风,等.新疆苜蓿根腐病研究初报[J].中国草地,1989,2:71-73.
[17]南志标.陇东黄土高原栽培牧草真菌病害调查与分析[J].草业科学,1990,7(4):30-34.
[18]南志标,员宝华.新疆阿勒泰地区苜蓿病害[J].草业学报,1994,11(4):14-18.
[19]王雪薇,喻宁莉,马德成.新疆苜蓿病害种类和分布的初步研究[J].草业学报,1998,7(2):48-52.
[20]陈雅君,崔国文.黑龙江省紫花苜蓿根腐病调查及病原分离[J].中国草地,2001,23(3):78-79.
[21]李敏权,柴兆祥,李金花,等.定西地区苜蓿根和根颈腐烂病病原研究[J].草地学报,2003,21(1):83-86.
[22]郭玉霞,南志标,李春杰,等.黄土高原区苜蓿与小麦轮作系统根部入侵真菌研究[J].生态学报,2004,24(3):486-494.
[23]王多成,孟有儒,李文明,等.苜蓿根腐病病原菌的分离及鉴定[J].草业科学,2005,22(10):78-81.
[24]李万苍,李文明,孟有儒.苜蓿根腐病菌(Fusariumsolani)生物学特性研究[J].草业学报,2005,14(4):106-110.
[25]郭玉霞,王成章,严学兵,等.不同紫花苜蓿品种根部入侵真菌研究[J].草地学报,2009,17(5):723-730.
[26]Stephen R C,Saville D J,Harvey I C,etal.Herbage yields and persistence of lucerne (MedicagosativaL.) cultivars and the incidence of crown and root diseases [J].New Zealand Journal of Experimental Agriculture,1982,10:323-332.
[27]Uddin W,Knous T R.Fusarium species associated with crown rot of alfalfa in Nevatda [J].Plant Disease,1991,75(1):51-56.
[28]Kalb D W,Bergestrom G C,Shields E J.Prevalence,severity,and association of fungal crown and root rots with injury by the clover root curculio in New York alfalfa [J].Plant Disease,1994,78(5):491-495.
[29]Hwang S F,Gossen B D,Turnbull G D,etal.Seedbed preparation,timing of seeding,fertility and root pathogens affect establishment and yield of alfalfa [J].Canadian Journal Plant Science,2002,82:371-381.
[30]Couture L,Dhont C,Chalifour,F P,etal.Fusarium root and crown rot in alfalfa subjected to autumn harvests [J].Canadian Journal Plant Science,2002,82:621-624.
[31]Wiggins B E,Kinkel L L.Green manures and crop sequences influence alfalfa root rot and pathogen inhibitory activity among soil-borne streptomycetes [J].Plant and Soil,2005,268:271-283.
[32]Skipp R A,Christensen M J,Nan Z B.Invasion of red clover (Trifoliumpratense) roots by soilborne fungi [J].New Zealand Journal of Agricultural Research,1986,29:305-313.
[33]王守正.河南省经济植物病害志[M].郑州:河南科学技术出版社,1994:8-19.
[34]李春杰,南志标.苜蓿种带真菌及其致病性测定[J].草业学报,2000,9(1):27-36.
[35]Peters R D,MacLeod C,Seifert K A,etal.Pathogenicity to potato tubers ofFusariumspp.isolated from potato,cereal and forage crops [J].American Journal of Potato Research,2008,85:367-374.
[36]Yin Y L,Nan Z B,Li C J,etal.Root-invading fungi of milk vetch on the Loess Plateau,China [J].Agriculture,Ecosystems and Environment,2008,124:51-59.
[37]南志标.豆科牧草根腐病[J].国外畜牧学——草原与牧草,1991(2):5-11.
[38]Hancock J G.Fungal rootlet colonization and forage yields of alfalfa in fungicide-treated field plots [J].Plant Disease,1993,77:601-608.
[39]孟嫣.甘肃省干旱灌区苜蓿地土壤镰刀菌种群结构及致病性研究[D].兰州:甘肃农业大学,2006.
[40]Hancock J G.Fungal infection of feeder roots of alfalfa [J].Phytopathology,1985,75:1112-1120.
[41]耿繁军,朱伟然,李黎,等.郑州地区不同秋眠级苜蓿品种的生产性能评价[J].草业科学,2009,26(6):70-77.
[42]张艳娟,沈益新.南京地区冬闲田播种紫花苜蓿生产性能的品种间差异[J].草业科学,2010,27(2):93-98.
[43]张成霞,南志标.放牧对草地土壤微生物影响的研究述评[J].草业科学,2010,27(1):65-70.
[44]Bossio D,Scow K,Gunapala N.Determinants of soil microbial communities:effects of agricultural management,season,and soil type on phospholipid fatty acid profiles[J].Microbiological Ecology,1998,36:1-12.
[45]Govaerts B,Mezzalama M,Sayre K,etal.Long-term consequences of tillage,residue management and crop rotation on maize/wheat root rot and nematode populations on subtropical highlands[J].Applied Soil Ecology,2006,32:305-315.
[46]Bailey K,Lazarovits G.Suppressing soil-borne diseases with residue management and organic amendments[J].Soil & Tillage Research,2003,72:169-180.
