毒死蜱降解菌腺苷酸激酶基因的分离及结构特征
2011-04-25齐芬芳冉雪琴王嘉福
齐芬芳,冉雪琴,王嘉福,
(1.贵州大学农业工程省重点实验室,贵州 贵阳550025; 2.贵州大学动物科学学院,贵州 贵阳550025)
腺苷酸激酶(adenylate kinase,ADK)是生物体内一种重要的核苷酸激酶,属于磷酸果糖激酶B家族[1-2]。主要催化ADP的生成,反应式为AMP + Mg2+ATP↔ADP + Mg2+ADP。腺苷酸激酶广泛存在于微生物、植物以及动物体内。所有腺苷酸激酶由3个结构域组成:CORE、AMPbd(AMP-binding subdomain)和LID(ATP-binding subdomain)结构域。根据LID结构域的长度将腺苷酸激酶分为长亚型和短亚型。底物分子与腺苷酸激酶结合后LID结构域发生很大变化,并覆盖整个活性位点,保护Mg2+ATP/AMP和酶形成的三元复合体,协助磷酰基的转移和防水解[3]。腺苷酸激酶以ATP或GTP作为磷酸根的供体,维持细胞中3种腺苷酸的正常水平,对能量代谢和酶活性的调节起重要作用[4]。本研究中,施氏假单胞菌(Pseudomonasstutzeri)75为贵州大学农业工程省重点实验室分离到的一株有机磷农药降解菌,能以毒死蜱作为唯一碳源生长。ADK在需要高水平ATP合成和利用的细胞中大量存在并参与细胞中的能量代谢和核苷酸代谢,低等生物要应对多变的外界环境以及激烈的生存竞争,必然要求高度的腺苷酸激酶活性用以维持体内的能量代谢平衡。而关于农药降解菌中的腺苷酸激酶基因鲜有报道。本研究以一株毒死蜱降解菌75为研究材料,克隆ADK基因并对其结构特点进行分析,以期为后续的研究奠定一定的基础。
1 材料与方法
1.1材料
1.1.1菌株来源 施氏假单胞菌75为贵州大学农业工程省重点实验室分离的毒死蜱降解菌[5]。
1.1.2主要试剂 T4DNA连接酶、Taq DNA聚合酶、载体pMD18-T为TaKaRa公司产品;DL2000 DNA Marker和质粒提取试剂盒为天根生化科技(北京)有限公司产品,DNA片段胶回收试剂盒由Omega公司生产。引物由上海捷瑞生物技术有限公司合成,核苷酸序列的测定工作由北京诺赛基因组研究中心有限公司完成。大肠杆菌(Escherichiacoli)TG1为贵州大学农业工程省重点实验室保存。
1.2方法
1.2.1基因组DNA的提取 施氏假单胞菌75单菌落接种于液体LB培养基,37℃ 120 r/min条件下震荡培养过夜,取1.5 mL培养物12 000 r/min离心2 min,去上清。沉淀中加入400 μL的TE缓冲液,反复吹打使之悬浮,加入80 μL溶菌酶(100 mg/mL),混匀,于37℃温育1 h。加入100 μL 5 mol/L NaCl,充分混匀,再加入600 μL裂解液,混匀,65℃温育10 min,12 000 r/min离心2 min,取上清,加入等体积的酚∶氯仿∶异戊醇(25∶24∶1)抽提2次,12 000 r/min离心5 min,取上清加入0.8倍体积的异丙醇,稍加离心沉淀基因组DNA,200 μL的70%乙醇洗涤沉淀,离心弃乙醇,干燥后溶于40 μL TE缓冲液(含25 ng/mL RNaseA)中,0.7%琼脂糖凝胶电泳检测。
1.2.2ADK基因的扩增及克隆 根据NCBI中已经报道的假单胞菌属ADK基因的序列,应用Primer premier 5.0软件设计一对特异性引物,正向引物P1:5′-CGATAGACCTTTTCGGGACGGCTTGT-3′;反向引物P2:5′-TGATCAGCTCAGGGCAGCAAAGACCT-3′。以细菌基因组为模板进行扩增,预期扩增片段施氏假单胞菌75 ADK基因(以下均简称ADK75)约为810 bp。PCR反应条件:94℃预变性5 min;94℃变性40 s,58℃退火35 s,72℃延伸50 s,30个循环;72℃延伸10 min,4℃保存。
PCR产物经1.0%琼脂糖凝胶电泳分离,切下含目的片段的胶条,用胶回收试剂盒回收目的片段,16℃下与pMD18-T载体连接过夜,构建重组质粒pMD18-T-ADK,转化感受态大肠杆菌 TG1,涂布于IPTG和X-gal的氨苄青霉素琼脂平板上,37℃倒置培养过夜。挑取白色单菌落,经菌落PCR、质粒提取以及质粒PCR,鉴定为阳性的克隆子测定核苷酸序列。
1.2.3ADK基因序列分析 据ADK75核苷酸序列利用DNAstar推导出氨基酸序列;经GenBank进行核苷酸、氨基酸序列相似性比对,确定基因的开放读码框(open reading frame,ORF),用瑞士生物信息学研究所的蛋白分析系统(Expasy protein analysis system)对目的基因进行生物信息学分析,预测ADK75的理化性质。应用Clustal X程序进行完全比对,以MEGA 4.0软件选择Neighbor-Joining法分析分子系统进化树(重复1 000次)。通过SWISS-MODEL(http://swissmodel.expasy.org/)在线分析施氏假单胞菌ADK75蛋白的二级结构和三级结构。施氏假单胞菌ADK75基因核苷酸序列已在NCBI上登录,接收号为HQ586947。
2 结果
2.1ADK75基因的克隆 以施氏假单胞菌75基因组DNA为模板,经特异性引物扩增,获得810 bp的DNA片段,与预期大小相符(图1)。经琼脂糖凝胶电泳回收目的片段,与pMD18-T载体相连,经菌落PCR及质粒提取鉴定阳性克隆子,获得阳性克隆pMD18-T-ADK。

图1 ADK75基因片段的PCR扩增
2.2ADK75基因序列分析 将测定的810 bp的DNA碱基序列与已知序列进行比对,810 bp片段中包含648 bp的腺苷酸激酶基因,并具有完整的ORF,起始密码子为ATG,终止密码子为TGA,共编码215个氨基酸。经Expasy软件分析,编码蛋白的分子量为23 191.3,等电点5.61。
与已知序列相比较,ADK75与施氏假单胞菌A1501(ABP80394.1)的同源性最高,核苷酸序列只有3个碱基差异,导致3个氨基酸改变,核苷酸同源性高达99.5%。
与假单胞菌属其他ADK蛋白相比,同源性为77.2%~99.1%(图2)。AMPbd结构域和LID结构域是腺苷酸激酶中两个重要的功能区域。在AMPbd结构域内,施氏假单胞菌A1501与ADK75的氨基酸是一致的,但与其他的ADK蛋白在该区域的氨基酸差异数为3~13个。在LID结构域内,施氏假单胞菌A1501与ADK75的仅为第142位的丝氨酸变成异亮氨酸,而其他的ADK蛋白与ADK75的差异数为5~16个。推测这些氨基酸的不同可能与施氏假单胞菌75以毒死蜱为唯一碳源生长的特性有关。
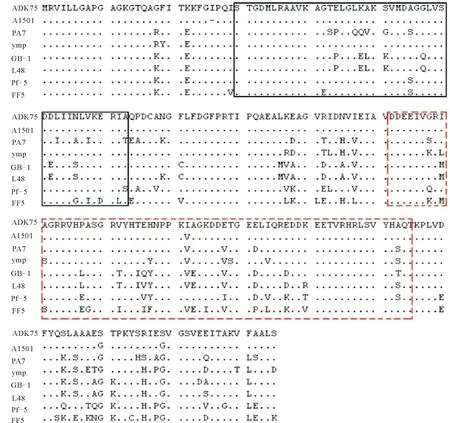
图2 施氏假单胞菌75与其他假单胞菌的氨基酸序列比较
以施氏假单胞菌75中ADK基因编码的氨基酸序列进行BLASTp比对,获得100条细菌来源的ADK基因序列,依据这些序列构建系统发育树,若以自举支持率15%为分界线,可将这100个基因归为两大类,假单胞菌属属于第一大类,第二大类包括少数变形菌门细菌属及不动细菌属。以自举支持率66%为分界线时,100个细菌ADK基因可分为13大类,假单胞菌属依然归为一类。从已知假单胞菌属的7种ADK基因序列各选取一个为代表,另外选取2个碳酸钙不动杆菌(Acinetobactercalcoaceticus)RUH2202与空气滤器水栖菌(Enhydrobacteraerosaccus)AK60作为外源,采用MEGA4.0中的Neighbor-Joining方法,与ADK75进行聚类分析(图3)。结果显示,施氏假单胞菌75的ADK基因与施氏假单胞菌A1501分为一支,与同属的恶臭假单胞菌(P.putide)GB-1及虫媒假单胞菌(P.entomophila)L48的相应基因有一定的距离。
以类鼻疽伯克霍尔德菌(Burkholderiapseudomallei)的ADK蛋白晶体结构(pdb: 3gmtB)为模板,经SWISS-MODEL在线分析施氏假单胞菌75编码的ADK蛋白,构建了ADK75蛋白的三维结构(图4),其中包含9个β片层、8个α螺旋,含AMP结合位点和ATP-AMP(Ap5A) 结合位点,具有典型的ADK蛋白的分子特征[6-7]。三维结构建模显示,ADK75可以分为明显的3个结构域,CORE结构域、LID结构域和AMPbd结构域。

图3 施氏假单胞菌75 ADK基因氨基酸序列的聚类分析

图4 ADK75三维结构图
3 讨论
腺苷酸激酶作为维持腺苷酸代谢平衡的生物酶,为细胞提供了一个有效的磷酸传递,在生物体内起着重要的作用。腺苷酸激酶ADK遗传缺陷会导致非球型红细胞溶血性贫血症;大肠埃希菌ADK结构基因的损伤可引起致死突变[7];此外,ADK基因还可能在细胞凋亡中扮演着重要的角色[8];在变铅青链霉菌(Streptomyceslividans)中,腺苷酸激酶失活会导致孢子形成和放线紫红素的生物合成受阻[9],提示腺苷酸激酶一方面作为细胞中能量平衡的维持者,同时也参与大分子的合成或分解代谢;结核分枝杆菌(Mycobacteriumtuberculosis)中腺苷酸激酶不仅可以催化腺苷酸的磷酸化,还能催化腺苷酸的同源物2-甲基腺苷酸的磷酸化[10],说明腺苷酸激酶作用的底物并不是单一的。目前还不清楚腺苷酸激酶是否可以作为磷酸根的供体参与毒死蜱的降解,但生物体内的代谢是一个复杂的过程,任何完整的生物代谢都不是一种酶的单一作用可以完成。因此,对该基因的研究有利于了解腺苷酸激酶在有机磷农药降解中所扮演的角色。
ADK75基因在假单胞菌属中相对保守,三维结构建模显示其具有典型的ADK蛋白的分子特征,而在AMPbd结构域与LID结构域内存在的氨基酸差异说明该腺苷酸激酶在与磷酸根的结合及传递过程中也可能与其他非农药降解的假单胞菌的腺苷酸激酶有所不同。进一步研究施氏假单胞菌75降解毒死蜱过程中腺苷酸激酶基因的表达量及其活性变化,将有助于有机磷农药解毒机理的研究。
[1] Wu L F,Reizer A,Reizer J,etal.Nucleotide sequence of theRhodobactercapsulatusfruK gene,which encodes fructose-1-phosphate kinase: evidence for a kinase superfamily including both phosphofructokinases ofEscherichiacoli[J].Journal of Bacteriology,1991,173:3117-3127.
[2] Spychala J,Datta N S,Takabayashi K,etal.Cloning of human adenosine kinase cDNA: sequence similarity to microbial ribokinases and fructokinases[J].Proceedings of the National Academy of Sciences U.S.A,1996,93(3):1232-1237.
[3] Muller C W,Schlauderer G J,Reinstein J,etal.Adenylate kinase motions during catalysis: an energetic counterweight balancing substrate binding[J].Structure,1996,4:147-156.
[4] Declerck P J,Müller M.Hydrogenosomal ATP:AMP phosphotransferase ofTrichomonasvaginalis[J].Comparative Biochemistry and Physiology.Part B,Comparative Biochemistry,1987,88(2):575-580.
[5] 金鑫,王嘉福,冉雪琴.农田土壤中毒死蜱降解菌的分离与鉴定[J].贵州农业科学,2010,38(4):103-106.
[6] Berry M B,Phillips G N Jr.Crystal structures ofBacillusstearothermophilusadenylate kinase with bound Ap5A,Mg2+Ap5A,and Mn2+Ap5A reveal an intermediate lid position and six coordinate octahedral geometry for bound Mg2+and Mn2+[J].Proteins,1998,32(3):276-288.
[7] Diederichs K,Schulz G E.The refined structure of the complex between adenylate kinase from beef heart mitochondrial matrix and its substrate AMP at 1.85A resolution[J].Journal of Molecular Biology,1991,217(3):541-549.
[8] 秋安,胡建军,孙久荣.腺苷酸激酶与细胞凋亡[J].生物化学与生物物理进展,2001,28(4):444-446.
[9] Rajkarnikar A,Kwon H J,Suh J W.Role of adenosine kinase in the control ofStreptomycesdifferentiations: loss of adenosine kinase suppresses sporulation and actinorhodin biosynthesis while inducing hyperproduction of undecylprodigiosin inStreptomyceslividans[J].Biochemical and Biophysical Research Communications 2007,363:322-328.
[10] 静恩煊,周波,罗杰,等.腺苷酸激酶基因在大肠杆菌中的可溶性高表达[J].生物化学与生物物理进展,1997,24:525-528.
