IBA处理对厚叶扇子花扦插苗生根关联酶活性的影响
2011-04-25刘玉民刘亚敏徐娜婷何丙辉
刘玉民,刘亚敏,徐娜婷,何丙辉
(西南大学资源环境学院 西南大学三峡库区生态环境教育部重点实验室,重庆 400715)
厚叶扇子花(译名)(Scaevolacrassifolia),英文名Thick-leaved fan flower,是草海桐科草海桐属植物,澳大利亚特产。其特点是多年生、生长快、适应性较强、易养护,种植当年即开花,花量大、花期长、花形特别,是澳大利亚花卉市场的重要种类,并已在欧洲和北美引种成功,深受消费者喜爱,作为地栽和盆栽花卉被广泛栽植于广场、庭院、阳台等地,极具市场前景和经济价值。Scaevola属植物因其花呈扇子形而被统称为扇子花,2007年作为国家林业局“948”引进项目被引种到我国进行试验栽培,厚叶扇子花为其中的1个种,但由于其种子发芽率极低,用种子繁殖比较困难,引种后一直未能在我国进行大面积推广。扦插繁殖方法能够有效解决某些用种子繁殖困难的植物快速繁育问题,为了使澳大利亚特色花卉厚叶扇子花能在我国快速繁殖和推广,丰富我国的花卉资源种类,本研究探讨IBA处理对厚叶扇子花扦插生根的影响,分析扦插生根过程中过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、多酚氧化酶(PPO)和吲哚乙酸氧化酶(IAAO)等关联酶活性变化,旨在为确定正确的厚叶扇子花无性扦插快繁技术提供科学的理论依据。
1 材料与方法
1.1扦插试验 厚叶扇子花插穗来源于西南大学温室大棚内种子繁殖的植株(作为国家林业局“948”引进项目,2007年西南大学等项目承担单位从澳大利亚引进的种子,种子发芽率仅为4%)。扦插试验于2009年5月初在西南大学温室大棚内进行,在厚叶扇子花母株上剪取粗约0.3 cm的侧枝,摘去下部叶片,保留3~4片上部叶片和顶芽,剪成长度为8 cm的插穗,下切口平剪,扦插前用质量浓度为250 mg/L的IBA溶液浸泡2 min,对照用蒸馏水浸泡2 min。扦插基质为珍珠岩、紫色土、腐殖土的混合基质(体积比为1∶1∶1)。插后保持温室遮光率为60%左右,相对湿度控制在70%~80%,温度控制在20~30℃,按照需要进行喷雾处理,常规管理。扦插试验采用完全随机区组设计,3次重复,每个区组将对照及用IBA处理的插穗各插200条,3个区组总计扦插1 200条。
1.2取样及样品处理 扦插后每隔4 d采样一次,每个测定指标均在3个区组各随机取5株,采样后洗净吸干,先观察其生根情况,然后取插穗基部3 cm皮部分别测定其POD、SOD、CAT、PPO和IAAO等酶的活性,进行3次重复测定。
1.3测定方法 PPO活性采用李忠光和龚明[1]改进的方法测定,取1.0 g插穗基部皮层放入研钵中,加入1 mL预冷的磷酸缓冲液(pH值7.8)研磨,再加1 mL缓冲液,倾入5 mL离心管,于4℃ 10 000 r/min条件下离心20 min,上清液即为酶液。反应体系为3 mL 0.2 mol/L邻苯二酚(用pH值7.8的磷酸缓冲液配制),1 mL酶液,以灭活的酶液为空白对照,30℃下水浴10 min,立即用20%三氯乙酸中止反应,5 000 r/min下离心10 min,于410 nm处测定其吸光值。POD活性采用愈创木酚法、SOD活性采用NBT光氧化还原法、CAT活性采用滴定法测定[2],IAAO活性用比色方法测定[3]。
PPO以每克鲜样品每分钟A410光密度变化0.01个单位所需要的酶液量作为一个活力单位(U),POD以每分钟内A470变化0.01为1个过氧化物酶活性单位(U),SOD以抑制NBT光氧化还原50%的酶量为一个酶活性单位(U),CAT以每克鲜样品每分钟内分解1 mg过氧化氢为1个酶活力单位(U);IAAO以每克鲜样品在1 h内分解破坏IAA的毫克数表示1个酶活性单位(U)。
1.4数据分析 用DPS统计软件进行数据分析,显著性检验采用双因素方差分析,多重比较采用最小显著极差法(LSD),利用EXCEL绘图。
2 结果与分析
2.1厚叶扇子花扦插苗生根特性 观察厚叶扇子花生根过程形态变化发现(表1),无论是用IBA处理的插穗还是对照插穗下切口开始出现愈伤组织的时间均在扦插开始后8 d左右。部分插穗扦插后基部能形成愈伤组织,开始只出现一些半透明的、不规则的瘤状突起物,后来有些形成环状,这些插穗多数都能继续生根;部分插穗基部不能形成愈伤组织并出现皱缩现象,但仍能继续长出不定根;少数插穗基部完全被团状的愈伤组织包围,这类插穗生根数较少或不生根,但也不立即枯死,有些还能继续抽稍、展叶;少数插穗基部发黑,这类插穗往往最终死亡,极少数基部发黑的插穗上端能长出不定根。经IBA处理的插穗有45%能长出愈伤组织且能继续生长膨大,而对照插穗只有20%能长出愈伤组织且多数不能继续膨大。经IBA处理的插穗扦插后,第12天开始形成不定根,第30天时生根率为89%,不定根条数范围为2~46条,平均不定根条数为25条,生根植株最大根长为3.4 cm,平均根长为1.3 cm。对照插穗扦插后,第14天开始形成不定根,第30天时生根调查显示生根率为62%,不定根条数范围为1~30条,平均不定根条数为13条;生根植株最大根长为2.9 cm,平均根长为0.9 cm。多数厚叶扇子花扦插苗不定根是从插穗基部3 cm范围内的皮部长出,极少数从愈伤组织处长出,且生根优良的插穗愈伤组织发育往往较弱,因此厚叶扇子花扦插苗应为皮部生根类型。
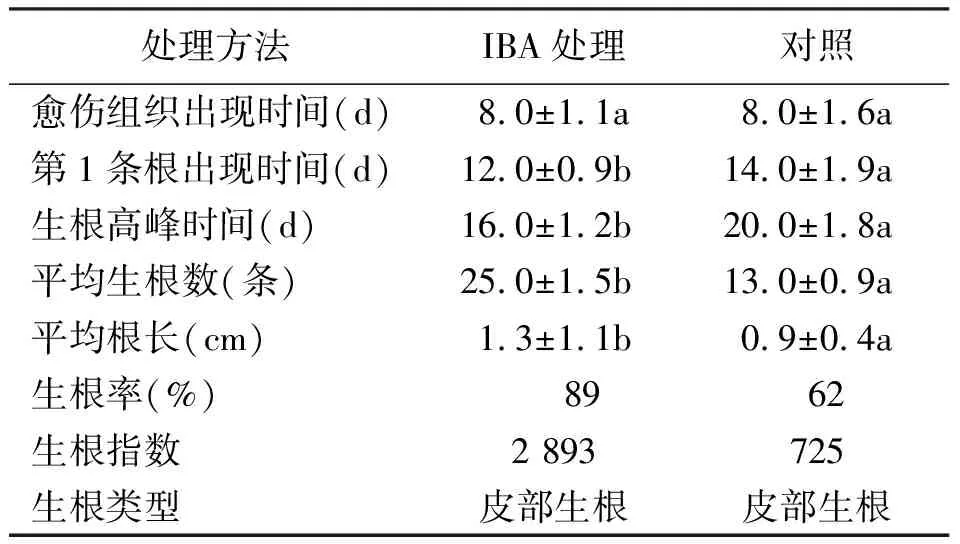
表1 厚叶扇子花扦插苗生根特性
2.2厚叶扇子花扦插生根过程相关酶活性变化
2.2.1POD活性变化 POD是植物对膜脂过氧化酶促防御系统中重要的保护酶,主要起到酶促降解H2O2的作用[4]。POD的活性与离体植物生根有密切关系,是植物生根标志性物质之一[5],其作用的某些产物是不定根发生和发展所必须的辅助因子,能促进不定根的形成[6]。在不定根诱导期和表达期,POD活性升高是有生根能力的标志[7-8]。厚叶扇子花扦插生根过程中POD活性成规律性变化(图1),经IBA处理的插穗和对照插穗POD活性在扦插初期均升高,且均在10 d左右达到高峰,之后开始下降,处理插穗POD活性在扦插15 d后基本稳定,对照插穗扦插20 d后基本稳定。处理与对照插穗中POD活性差异显著(P<0.05),表明激素处理能提高插穗的POD活性,这种活跃的生理状态对生根有利,在生根的不同阶段POD活性有显著变化(P<0.05)。
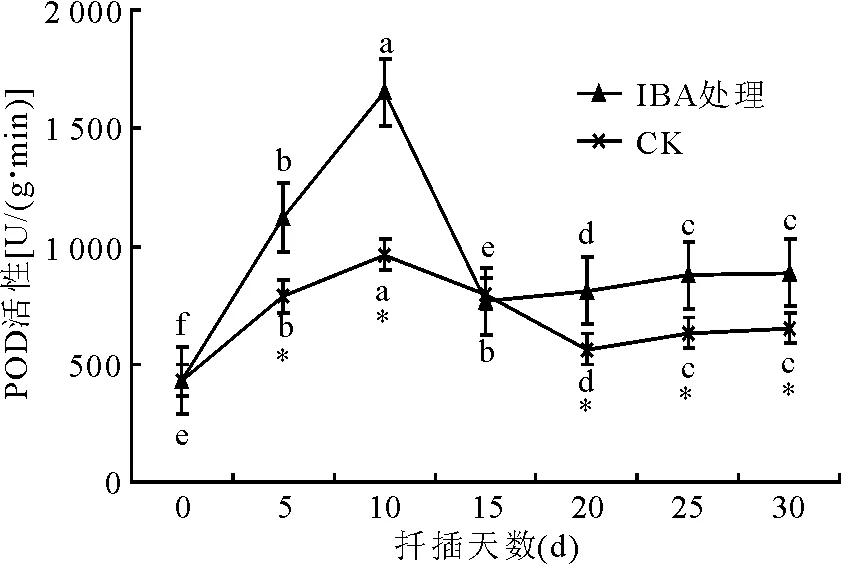
图1 厚叶扇子花扦插过程种POD活性变化

图2 厚叶扇子花扦插过程种SOD活性变化
2.2.3CAT活性变化 CAT酶在体内的主要作用是清除H2O2,有效地保护细胞免受损伤[11]。厚叶扇子花扦插生根过程中CAT活性成规律性变化(图3),经IBA处理的插穗和对照插穗基部CAT活性在扦插初期均降低,随着不定根的凸出和生长又开始升高,最小值出现在扦插后10 d左右。经IBA处理的插穗CAT活性比对照降低的更明显,且在整个扦插生根过程中始终低于对照。经IBA处理的插穗与对照插穗中CAT活性有显著差异(P<0.05),在生根的不同阶段CAT活性有变化但差异不显著(P>0.05)。

图3 厚叶扇子花扦插过程种CAT活性变化
2.2.4PPO活性变化 PPO能催化酚类物质和IAA形成一种“IAA-酚酸复合物”[12],这种复合物具有促进不定根形成的活性[13],PPO还能催化生长素的代谢,促进不定根的起源与发育[14]。厚叶扇子花扦插生根过程中PPO活性均表现为扦插初期上升,达到最大值后开始下降(图4)。处理与对照插穗中PPO活性高峰期出现的时间不同,经IBA处理的插穗在扦插后15 d左右达到高峰,而对照插穗在扦插后20 d左右达到高峰。处理与对照插穗中PPO活性差异不显著(P>0.05),在生根的不同阶段PPO活性有显著差异(P<0.05)。
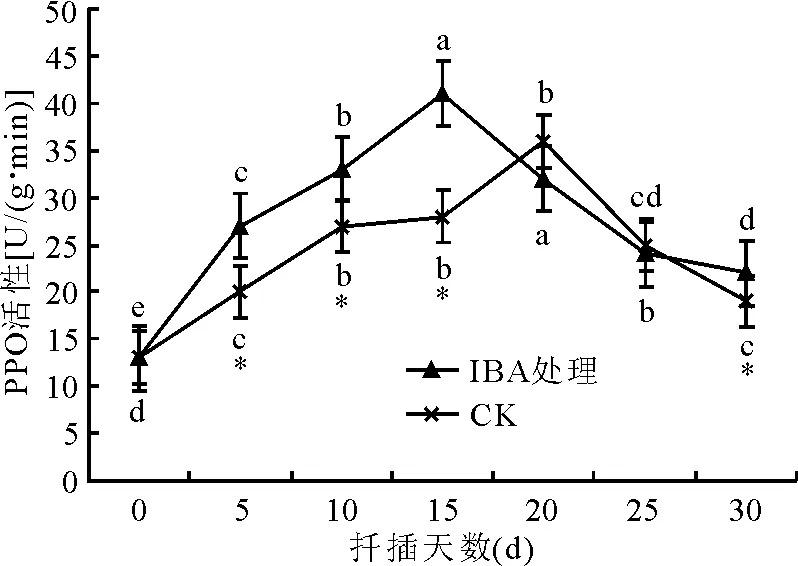
图4 厚叶扇子花扦插过程种PPO活性变化
2.2.5IAAO活性变化 IAA是一种植物生长素,能促进不定根的发生与发育,而IAAO能降解IAA,调节植物体内的IAA含量,影响植物的生长发育,因此IAAO活性的大小与根的发生有重要关系[15]。厚叶扇子花扦插生根过程中IAAO活性均表现为先降低后升高的趋势(图5)。经IBA处理的插穗IAAO活性最小值出现在扦插后15 d左右,对照插穗出现在扦插后20 d左右。经IBA处理的插穗IAAO活性比对照降低的更明显,且在整个扦插生根过程中始终低于对照,处理与对照插穗之间IAAO活性差异显著(P<0.05),在生根的不同阶段IAAO活性有显著差异(P<0.05)。

图5 厚叶扇子花扦插过程种IAAO活性变化
3 讨论与结论
厚叶扇子花属于皮部生根类型,用适宜浓度的IBA处理厚叶扇子花插穗能提高其生根率和根系质量。过氧化物酶、超氧化物歧化酶、过氧化氢酶、吲哚乙酸氧化酶、多酚氧化酶等活性酶均与厚叶扇子花生根过程有密切关系,直接影响植物的生根特性。IBA处理明显改变了厚叶扇子花插穗内过氧化物酶、超氧化物歧化酶、过氧化氢酶、吲哚乙酸氧化酶、多酚氧化酶等氧化酶的活性,且在生根过程中成规律性变化,其中过氧化物酶、超氧化物歧化酶和多酚氧化酶活性在扦插后逐渐升高,在根系形成期达到高峰,然后又逐渐下降;过氧化氢酶和吲哚乙酸氧化酶活性表现为先降低后升高的趋势,在根系形成期达到最小值。
植物体内的过氧化物酶、吲哚乙酸氧化酶、多酚氧化酶等酶之间存在密切的关系,具有许多共同特征,有些过氧化物酶同工酶具有吲哚乙酸氧化酶活性,有些具有多酚氧化酶的活性[16];而有些植物体内吲哚乙酸氧化酶也具有过氧化物酶的性质[17]。过氧化物酶、吲哚乙酸氧化酶、多酚氧化酶活性高低可作为判定植物生根难易的指标之一,吲哚乙酸氧化酶是调节IAA含量的重要酶,而IAA的一个非常重要的生理功能就是促进不定根的形成。因此,吲哚乙酸氧化酶通过氧化IAA来控制植物的生根状况。相关研究认为,一些植物离体生根的诱导期内高活性的吲哚乙酸氧化酶使内源IAA水平降低,低浓度的IAA有利于生根,在表达期吲哚乙酸氧化酶活性降低使得植株内源IAA含量升高,高浓度的IAA能促进根的生长[5,7,18-21]。本研究中,厚叶扇子花插穗体内吲哚乙酸氧化酶的变化表现为根系诱导期较高、表达期较低、生长期又升高的趋势,与相关研究结论一致;有研究认为,过氧化物酶,也能氧化IAA,从而调节植物生根能力[22],当植物体内的过氧化物酶、吲哚乙酸氧化酶活性较高时,降解IAA的作用强,IAA被破坏较多,对诱导生根不利。当植物体内的过氧化物酶、吲哚乙酸氧化酶活性较低时,降解IAA能力较弱,对诱导根原基的形成有利。而本研究中,过氧化物酶和吲哚乙酸氧化酶活性变化趋势并不相同,这说明过氧化物酶和吲哚乙酸氧化酶对植物生根的联合影响具有复杂性,可能因物种不同而异,有待于进一步深入研究;植物体内的酚类物质对不定根的起源和发育起着极其重要的作用[20],多酚氧化酶能催化酚类物质与IAA缩合而形成一种“IAA-酚酸复合物”[12],这种复合物是一种生根的辅助因子,具有促进不定根形成的活性[13]。在不定根形成时,体内的酚类物质含量会下降,被认为这是由于酚类物质在多酚氧化酶的作用下转变的结果。因此,多酚氧化酶是影响不定根形成的一个重要因素。而本研究中,不定根形成期多酚氧化酶含量达到高峰,与前人研究的结论一致。虽然过氧化物酶、吲哚乙酸氧化酶、多酚氧化酶等活性高低直接影响不定根的形成,但也不能仅凭植物的过氧化物酶、吲哚乙酸氧化酶、多酚氧化酶等活性高低就判定植物生根的难易,因为生根是插穗内激素种类和相对比例、生根抑制剂的存在与否、插穗内营养物质含量等多种因素综合作用的结果。
植物从扦插开始到生根完毕会受到很多逆境胁迫的影响,插穗内会产生大量自由基和活性氧,对植物造成很大伤害,过氧化物酶、超氧化物歧化酶、过氧化氢酶是保护酶系统的重要组成成分,能够在一定程度下清除体内过剩的活性氧和自由基[23-24],影响植物的生根质量。有研究表明一些植物扦插生根过程中过氧化物酶活性会出现两个高峰值[18-19,22,25],而本研究中厚叶扇子花在整个生根过程中只出现了一个峰值,这与前人[18-19,22,25]对其他植物的研究结果不同,可能是由于厚叶扇子花属于皮部生根类型,所需生根的时间较短引起的,但这种推测还有待进一步深入研究。
IBA能促进植物体内过氧化物酶、多酚氧化酶、吲哚乙酸氧化酶等酶的活性变化,从而促进细胞的脱分化,产生愈伤组织。本研究从生根过程中相关氧化酶变化方面揭示了厚叶扇子花生根的生理响应机制,但由于影响植物扦插生根的因素较多,只有对插穗内营养物质含量、内源激素水平等与生根相关指标的变化规律进行详细研究后,才能更确切地阐明厚叶扇子花的生根机理。
[1] 李忠光,龚明.植物多酚氧化酶活性测定方法的改进[J].云南师范大学学报,2005,25(1):44-49.
[2] 萧浪涛,王三根.植物生理学实验技术[M].北京:中国农业出版社,2005:107-109,103-104,152-153,161-166.
[3] 张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2004:188-189.
[4] 刘磊,陈立波,李志勇,等.晚秋温度对苜蓿地上部游离脯氨酸、可溶性糖和POD活性的影响[J].草业科学,2009,26(10):89-93.
[5] Gaspar T.Practical uses of peroxidase activity as a predictive marker of rooting performance of micropropagated shoot[J].Agronomic,1992(12):757-765.
[6] 宋丽红,曹帮华.光叶楮扦插生根的吲哚乙酸氧化酶、多酚氧化酶、过氧化物酶活性变化研究[J].武汉植物学研究,2005,23(4):347-350.
[7] Moncousin C H.Peroxidase as a marker for rooting improvement of clones ofVitiscultured in vitro[A].In:Greppin H,Penel C,Gaspar T.Molecular and Physiological Aspects of Plant Peroxidases[C].Geneva:University of Geneva,1986:379-385.
[8] Nordstrom A C,Eliasson J.Levels of endogenous indole-3-acetic acid and indole-3-acetylaspartic acid during adventitious root formation in pea cuttings[J].Plant Physiology,1991,82:599-605.
[9] Sairam R K,Saxena D C.Oxidatives trees and andantioxidants in wheat genotypes:possible mechanism of water sress tolerance[J].Journal of Agronomy and Crop Science,2000,184(1):55.
[10] Camp W V,Inza D,Montagu M V.The regulation and function of tobacco superoxide dismutades[J].Free Radical Biology and Medicine,1997,23:515-520.
[11] 张强,李建龙,晏笳,等.温度胁迫对亚热带常用草坪草活性氧代谢相关酶的影响[J].草业科学,2004,21(10):83-86.
[12] Haissig B E.Influence of auxins and auxin synergists on adventitious primordium initiation and development[J].New Zealand Journal for Science,1974(4):311-323.
[13] Bassuk N L,Hunter L D,Howard B H.The apparent of polyphenol oxidase and phloridzin in the production of apple rooting cofactors[J].The Journal of Horticultural Science & Biotechnology,1981,56(4):313-322.
[14] Bhattacharya N C.Enzyme activities during adventitious rooting[M].Portland: Dioscorides,1989:88-101.
[15] 原牡丹,侯智霞,翟明普,等.IAA分解代谢相关酶(IAAO、POD)研究进展[J].农业生物技术科学,2008,24(8):88-92.
[16] Shinshi H,Noguchi M.Relationship between peroxidase,IAA oxidase and polyphenol oxidase[J].Phytochemistry,1975,14:1255-1258.
[17] Galston A W,Bonner J,Baker R S.Flavoprotein and peroxidase as components of the indole acetic oxidase system of pea[J].Archives of Biochemistry and Biophysics,1953,49:456-470.
[18] Pacheco P,Calderón X,Vega A.Flavonoids as regulators and markers of root formation by shoots ofEucalyptusglobulusraised in vitro[J].Plant Perox NewsLetter,1995,5:9-12.
[19] 宋金耀,何文林,李松波,等.毛白杨嵌合体扦插生根相关理化特性分析[J].林业科学,2001,37(5):64-67.
[20] 扈红军,曹帮华,尹伟伦,等.榛子嫩枝扦插生根相关氧化酶活性变化及繁殖技术[J].林业科学,2008,44(6):60-65.
[21] 曹帮华,扈红军,张大鹏,等.桑树硬枝扦插生根能力及其生根关联酶活性的研究[J].蚕业科学,2008,34(1):96-100.
[22] Gebhardt K.Activation of indole-3-acetic acid oxidase from horseradish and prunus by phenols and hydrogen peroxide (H2O2)[J].Plant Growth Regulation,1982,1(2):73-84.
[23] Levitt J.Response of plants to environmental stress[M].New York:Academic Press,1980:365-434.
[24] 张永峰,殷波.混合盐碱胁迫对苗期紫花苜蓿抗氧化酶活性及丙二醛含量的影响[J].草业学报,2009,18(1):46-50.
[25] 扈红军,曹帮华,尹伟伦,等.不同处理对欧榛硬枝扦插生根的影响及生根过程中相关氧化酶活性的变化[J].林业科学,2007,43(12):70-75.
