钠复合肥培育白刺强旱生植株的研究
2011-04-25段娇娇康建军于健龙杨自辉王锁民
段娇娇,康建军,于健龙,杨自辉,王锁民
(1.兰州大学草地农业科技学院,甘肃 兰州 730020;2.甘肃民勤荒漠草地生态系统国家野外科学观测研究站,甘肃 民勤 733300)
白刺(Nitrariatangutorum)属蒺藜科白刺属(Nitraria),是我国西北干旱荒漠区的优势建群种[1-2],具有极强的抗旱、耐盐碱和耐瘠薄能力,同时又是我国名贵中药材锁阳(Cynomoriumsongaricum)的寄主,具有重要的生态和经济价值。然而,由于人类的掠夺式开发和自然环境的恶化,这一重要野生资源植物出现了生长不良或大面积死亡的现象[3-4]。因此,对白刺栽培管理进行研究对有效保护并合理利用这一野生资源具有重要意义。
研究发现,Na+在植物的生长发育过程中起着十分重要的作用。Wang等[5]研究认为,多浆旱生植物适应干旱环境的有效策略之一是吸收并积累Na+,而不是拒排Na+。进一步的室内研究[6]表明,50 mmol/L NaCl不但能显著促进多浆旱生植物霸王(Zygophyllumxanthoxylum)的生长并提高其抗旱能力,而且能改善霸王幼苗在-0.5 MPa渗透胁迫下的光合能力,提高霸王植株的抗胁迫能力[7]。可见,Na+在促进多浆旱生植物的生长和增强其抗逆性方面起着重要的作用。基于上述研究,王锁民等[8]通过室内盆栽方法成功研制出一种能显著促进荒漠多浆旱生植物生长并提高其抗旱性的钠复合肥。在兰州市室外盆栽条件下,该钠复合肥有效地促进了霸王、梭梭(Haloxylonammodendron)、红砂(Reaumuriasongarica)和白刺的生长,并提高了其抗旱能力[9-10]。康建军等[11]在甘肃民勤对施用钠复合肥盆栽培育的梭梭沙地移栽后的试验表明,钠复合肥能显著促进干旱荒漠区梭梭的生长,但有关该钠复合肥对荒漠区白刺生长及抗旱性的影响尚未见报道。本研究以甘肃民勤荒漠区为试验点,研究施用钠复合肥对白刺生长及生态环境的影响,以期为大批量繁育抗旱性强的白刺植株及荒漠区植被的恢复与生态系统的重建提供理论及实践依据。
1 材料与方法
1.1试验区概况 研究区位于甘肃民勤荒漠草地生态系统国家野外科学观测研究站(38°34′ N,102°58′ E),平均海拔1 378 m,年均气温7.6 ℃;≥10 ℃年积温3 036.4 ℃·d,年均降水量113.2 mm,年蒸发量2 644.0 mm,属典型的干旱荒漠气候。多年来,由于上游来水逐年减少,地下水严重超采,地下水位以年均0.5 m以上的速度下降,现已下降为20 m以下;试验地0~50 cm沙层含水量约0.5%,土壤干旱。植被主要为大面积退化的白刺灌丛和衰败的栽培梭梭林,生态环境非常脆弱[12]。
1.2供试材料和供试肥料 试验用白刺种子于2009年8月底采自甘肃民勤荒漠草地生态系统国家野外科学观测研究站,千粒重为38.8 g,平均发芽率为69%;供试肥料为磷酸二铵和兰州大学草地农业科技学院牧草逆境生理与分子生物学实验室研制的钠复合肥[8]。
1.3供试土壤 供试土壤为甘肃民勤荒漠草地生态系统国家野外科学观测研究站当地土壤,土壤非常贫瘠,全氮含量为11.6 μmol/g,全磷含量5.28 μmol/g,Na+含量13.27 μmol/g,K+含量10.49 μmol/g,pH值7.8。
1.4材料培养与处理 2010年4月初,参照王锁民等[13]的方法,挑选籽粒饱满的白刺种子进行催芽处理。采用26 cm×28 cm一次性黑色塑料营养钵育苗,培养地点设在甘肃民勤荒漠草地生态系统国家野外科学观测研究站。试验设置3个处理,1)对照:不施用任何肥料;2)磷酸二铵:施(NH4)2HPO4(与钠复合肥含等量的N、P);3)钠复合肥:施研制的钠复合肥。每盆装土壤和肥料的均匀混合物8 kg,每个处理各80盆。浇足水后将整个营养钵埋于地表以下,以减少干旱条件下营养钵内土壤水分的散失,然后将催芽后的白刺种子均匀播于各盆中,每盆穴播20粒,覆盖湿沙土厚1 cm左右,覆盖薄膜。待种子出苗后,缓慢揭掉薄膜。其后每隔1周浇水1次,浇水量相同,并进行适当的养护管理使其正常生长。待白刺植株生长3个月后进行间苗,每盆保留生长一致的植株3株,充分浇水后进行干旱胁迫,每隔1个月充分补水1次,补水量相同。10月初生长期结束后测定相关指标。
1.5测定指标
1.5.1株高、根长、主茎直径和主根直径 用直尺量取株高和根长,用游标卡尺测定主茎直径和主根直径。
1.5.2鲜质量、干质量和根冠比 挖出白刺后,快速用蒸馏水冲洗表面灰尘,再用吸水纸吸干表面水分,立即分成根和地上部,分别称鲜质量。后将鲜材料放入105 ℃的烘箱中杀青10 min,再在80 ℃下烘干至质量不变,称干质量。
根冠比=根鲜质量/地上部鲜质量。
1.5.3植株体内Na+、K+含量 Na+、K+含量的测定参考Flowers和Hajibagheri[14]的方法。将烘至质量不变的白刺地上部和根系捣碎后浸入10 mL浓度为100 mmol/L冰乙酸中,密封试管,沸水浴2 h后冷却、过滤,稀释适当倍数后在火焰光度计(2655-00)上测定Na+、K+含量。
1.5.4土壤中Na+、K+含量 称取0.5和2.0 g风干土样,分别加入2 mol/L HNO3溶液10 mL和蒸馏水10 mL,振荡30 min,过滤,稀释适当倍数后,在火焰光度计(2655-00)上测定离子含量,测定值分别为交换性和可利用非交换性Na+、K+及水溶性Na+、K+含量。
土壤中钠钾离子总量=交换性和可利用非交换性钠钾含量+水溶性钠钾含量。
1.6数据处理 试验所得数据用SPSS 16.0 (SPSS Inc.,USA)软件分析,用Excel作图。
2 结果
2.1不同处理对白刺株高、根长、主茎直径和主根直径的影响 钠复合肥显著促进了白刺的生长(表1)。与对照和施(NH4)2HPO4肥的处理相比,钠复合肥培育的白刺株高分别增加了109%和45%,根长分别增加了95%和57%,主茎直径分别增加了83%和43%,主根直径分别增加了85%和22%。
2.2不同处理对白刺鲜质量、干质量和根冠比的影响 钠复合肥的施用显著增加了白刺的生物量(图1)。与对照和施(NH4)2HPO4肥的处理相比,钠复合肥培育的白刺地上部鲜质量分别增加了272%和81%,根系鲜质量分别增加了170%和49%(图1A);白刺地上部干质量分别增加了323%和102%,根系干质量分别增加了187%和59%(图1B)。钠复合肥的施用显著降低了白刺的根冠比(P<0.05),与对照和施(NH4)2HPO4肥的处理相比,其根冠比分别降低了38%和21%(图1C)。

表1 白刺株高、根长、主茎直径和主根直径的变化
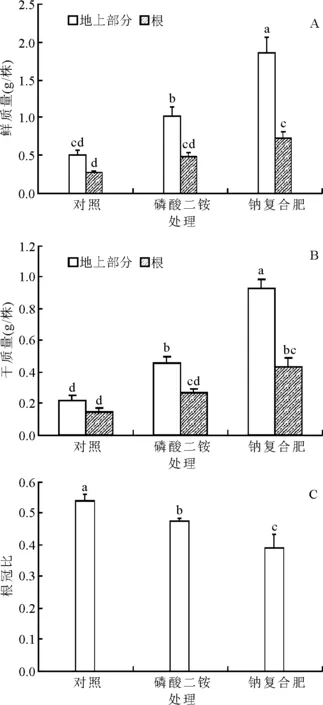
图1 不同施肥处理对白刺鲜质量、干质量和根冠比的影响
2.3不同处理对植株体内Na+、K+含量和Na+/K+的影响 钠复合肥显著提高了白刺体内Na+含量(图2A)。与对照和施(NH4)2HPO4肥的处理相比,钠复合肥培育的白刺地上部中积累的Na+分别增加了49%和24%,根中积累的Na+分别增加了14%和11%。不同处理之间白刺地上部和根中K+含量差异不显著(图2B)。与对照和施(NH4)2HPO4肥的处理相比,植株地上部中Na+/K+分别提高了62%和29%,而根中Na+/K+无显著差异(图2C)。

图2 不同施肥处理对白刺体内Na+、K+含量和Na+/K+的影响
2.4施用钠复合肥后白刺体内和土壤中Na+含量的动态变化 钠复合肥育苗钵土壤中Na+施用量为162 mg/kg。当白刺生长期结束后,育苗钵土壤中Na+施用量的22%被白刺植株吸收,67%残留在盆中,11%淋失到育苗钵外的土壤中,淋失的Na+占育苗前土壤中Na+含量的6%。残留在育苗钵中的Na+将会进一步被白刺吸收直到被充分利用(表2)。
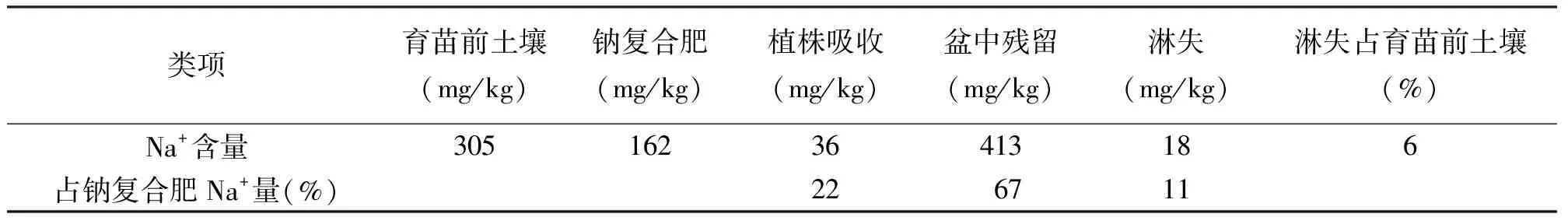
表2 钠复合肥中Na+含量的动态变化
3 讨论
干旱荒漠区的气候环境对植物的生存和繁衍极其严苛。在长期进化中,荒漠植物形成了一系列特殊的形态和生理抗旱机制。近年来的研究表明,荒漠多浆旱生植物能从含盐量很低的干旱土壤中吸收大量的Na+并储存在植株地上部,作为一种有益的渗透调节剂以维持体内较低的水势而促进植物吸水[5,15],Na+也可通过刺激植物根系生长而提高对水分和养分的吸收[6,16],从而促进植物的生长。本研究表明,与对照和施(NH4)2HPO4肥相比,生长期结束后,钠复合肥的施用显著促进了白刺根系和地上部的伸长生长,也使植株的主根和主茎显著增粗,从而提高植株对水分和养分的吸收和运输能力,有利于白刺的快速生长。同时,钠复合肥促进了白刺根系的伸长和加粗,进一步提高了植株“根系提水作用”,增加了浅层土壤水分,使植株能继续从表层土壤中吸收养分以促进生长[17-19]。
在干旱胁迫下,Na+的区域化作用引起植物细胞吸水膨胀,促进细胞分裂和体积增加,进而增大光合叶面积,使植物获得较多的碳水化合物[20]。同时,Na+能够替代K+调节保卫细胞膨压,有效控制CO2的进入,也可以激活叶绿素生物合成过程中的关键酶[21-22]及PSΠ活性[7],从而提高植物的光合效率和生物量。本研究表明,与对照和施(NH4)2HPO4肥相比,钠复合肥的施用显著增加了植株地上部和根系的生物量,证明Na+在白刺生长中起重要作用。此外,生长期结束后,钠复合肥的施用降低了白刺的根冠比,这与钠复合肥显著提高霸王和梭梭植株的根冠比结果相反[9,11],这可能是由于霸王和梭梭属于深根系植物[23],Na+可促进其根系的向下生长,而白刺属于浅根系植物[24],Na+则促进白刺植株侧根的伸展和地上部的生长。
植物体内存在一系列复杂的抗旱机制,其中渗透调节是主要的生理适应机制之一。一般认为,植物体内的渗透调节物质主要为无机离子和有机可溶性物质。对于荒漠旱生植物而言,在土壤含盐量非常低的条件下,体内会储存大量的Na+和K+,且Na+的累积量超过K+,表明Na+是其抵御干旱胁迫的有益渗透调节剂[5,25-26]。李景平等[27]对3种荒漠植物红砂、白刺和刺蓬(Cornulacaalaschanica)体内渗透调节机能的研究发现,Na+在其适应干旱环境中所起的渗透调节作用显著强于K+、Ca2+和可溶性糖等,并且地上部大于根系。本研究表明,施用钠复合肥显著促进Na+在白刺地上部的积累,对K+含量无显著影响,说明在植株体内Na+在代替K+行使渗透调节功能方面起着重要作用[28]。除此之外,钠复合肥中含有的硅也可能在植株抗旱性方面起着重要作用。研究表明,硅在植物体表形成特殊的“角质-双硅层”结构,这一结构可降低植株蒸腾[29-30],减少体内水分散失;硅还可改变植物在逆境中的形态结构,如减小功能叶与茎的夹角[31],增大植株的受光面积,从而提高其光合能力。目前通过施硅提高小麦(Triticumaestivum)和玉米(Zeamays)等禾本科植物抗旱性的报道已有很多[32],康建军等[注]康建军,王锁民,杨自辉.钠硅互作提高梭梭抗旱性的研究[J].中国沙漠(已接受).首次在藜科植物梭梭中进行了施硅研究,发现施加适量的NaCl或H2SiO3均可显著促进梭梭植株的生长并提高其抗旱性,而且适量的钠硅互作要比单施钠或单施硅更能显著促进梭梭植株生长并提高其抗旱性。然而,对蒺藜科植物施入硅的研究报道较少,施硅对蒺藜科植物生长发育的影响还有待于进一步的研究。
已有研究[33]表明,土壤中含有一定量盐分是白刺正常生长、繁殖的条件之一。本研究中施用的钠复合肥中Na+含量为162 mg/kg,每盆装土8 kg,即每盆施Na+量为1 296 mg。当生长期结束后,Na+施用量的22%被白刺植株吸收,67%残留在盆中,这部分Na+可作为白刺在沙地长年生长的Na+来源,可不断促进白刺植株生长并提高其抗旱能力。另外,在试验过程中,Na+施用量的11%淋失到盆外土壤中,其占育苗前土壤中Na+的6%,说明钠复合肥的施用对当地土壤生态环境造成的危害较小。
4 结论
与不施肥和施(NH4)2HPO4肥相比,钠复合肥培育的白刺株高、根长、主茎直径、主根直径、地上部和根系的生物量均有显著增加,且地上部的促进效果更为显著;同时钠复合肥的施用也显著增强了白刺的抗旱性,初步证实了钠复合肥在促进白刺生长并提高其抗逆性方面起着重要作用。施用钠复合肥盆栽育苗能有效降低Na+营养的淋失,提高白刺对Na+的利用效率,对当地土壤生态环境造成的危害较小。
[1]海西州农牧业区划大队,海西州区划办公室.青海省海西自治州农牧业自然资源及综合区划[M].北京:新华出版社,1995:11.
[2]范青慈,黄金嗣,杨阳.青海省木本饲用植物资源分布特点及作用[J].青海草业,1998(3):31-35.
[3]赵克昌.白刺属灌木在黄土丘陵荒山造林实验[J].干旱区资源与环境,1991,5(2):74-79.
[4]李光仁.干旱区自然白刺平茬效应初探[J].甘肃省林业科技,1999,24(3):40-41.
[5]Wang S M,Wan C G,Wang Y R,etal.The characteristics of Na+, K+an free proline distribution in several drought resistant plants of the Alxa desert[J].Journal of Arid Environments,2004,56:525-539.
[6]李三相.Na+与多浆旱生植物霸王抗旱性研究[D].兰州:兰州大学,2006.
[7]马清,楼洁琼,王锁民.Na+对渗透胁迫下霸王幼苗光合特性的影响[J].草业学报,2010,19(3):198-203.
[8]王锁民,周向睿,岳利军.钠复合肥及其应用和施用方法:中国,ZL200710018840.0[P].2011-03-16.
[9]王春梅.Na+在拒盐型小花碱茅、积盐型霸王逆境适应中的作用研究[D].兰州:兰州大学,2008.
[10]岳利军.三种荒漠植物育苗技术的研究[D].兰州:兰州大学,2009.
[11]康建军,王锁民,杨自辉,等.苗期施用钠复合肥增强梭梭幼苗抗逆性的初步研究[J].草业学报,2011,20(2):127-133.
[12]常兆年,李发江,韩福贵,等.民勤荒漠草地主要植物群落生境条件的比较研究[J].草业科学,2009,26(7):12-18.
[13]王锁民,岳利军,冯波.促进白刺种子快速萌发的方法:中国,ZL200710018697.5[P].2009-08-26.
[14]Flowers T J,Hajibagheri M A.Salinity tolerance inHordeumvulgare:ion concentration in root cells of cultivars differing in salt tolerance[J].Plant Soil,2001,231:1-9.
[15]Blumwald E,Aharon G S,Apsse M P.Sodium transport in plant cells[J].Biochemical et Biophysical Acta,2000,465:140-151.
[16]颜振德.甘薯品种的耐旱性及其鉴定方法的研究[J].作物学报,1964,3(2):183-189.
[17]Richads J H,Caldwell M M.Hydraulic lift:substantial nocturnal water transport between soil layers byArtemisiatridentatesroots[J].Oecologia,1987,73:486-489.
[18]陈亚明,傅华,张荣,等.根-土界面水分再分配研究现状与展望[J].生态学报,2004,24(5):1040-1047.
[19]杨鑫光.霸王对干旱胁迫的响应及根系提水研究[D].兰州:兰州大学, 2006.
[20]赵可夫,冯立田.中国盐生植物资源[M].北京:科学出版社,1993.
[21]Marschner H.Mineral Nutrition of Higher Plants[M].London:Academic Press,1995.
[22]Brownell P F,Bielig L M.The role of sodium in the conversion of pyruvate to phosphoenolpyruvate in the mesophyll chloroplasts of C4plants[J].Australian Journal of Plant Physiology,1996,23:171-177.
[23]盛晋华,乔永祥,刘宏义,等.梭梭根系的研究[J].草地学报,2004,12(6):91-94.
[24]孙祥,于卓.白刺根系的研究[J].中国沙漠,1992,12(4):50-54.
[25]Subbarao G V,Wheeler R M,Stutte G W,etal.How far can sodium substitute for potassium in red beet[J].Journal of Plant Nutrition,1999,22:1745-1761.
[26]Song J,Feng G,Tian C Y,etal.Osmotic adjustment trait ofSuaedaphyophora,HaloxylonammoderonandHaloxylonpersicumin field or controlled conditio[J].Plant Science,2006:113-118.
[27]李景平,杨鑫光,傅华.阿拉善荒漠区3种旱生植物体内主要渗透调节物质的含量和分配特征[J].草业科学, 2005,22(19):35-38.
[28]Flowers T J,Läuchli A.Sodium versus potassium:substitution and compartmentation[A].In:Läuchli A,Bieleski R L.Inorganic Plant Nutrition[M].Berlin:Springer-Verlag,1983:651-681.
[29]梁永超,张永春,马同生.植物的硅素营养[J].土壤学进展, 1993,21(3):7-14.
[30]Kim S G,Kim K W,Park E W,etal.Silion-induced cell wall fortification of rice leaves:A possible cellular mechanism of enhance host resistance to blast[J].Phytopathology,2002,92(10):1095-1130.
[31]马同生.稻田硅营养与我国目前硅营养的应用[J].土壤学进展,1990,18(4):1-5.
[32]郭兴华,郭正刚,刘慧霞,等.硅对植物的有益作用及其对草坪草研究的启示[J].草业科学,2010,27(3):55-61.
[33]卢树昌,苏卫国.重盐碱区白刺耐盐性及其利用研究[J].天津农学院学报,2004,11(4):30-35.
