干热胁迫对紫花苜蓿叶片生理特性的影响
2011-04-25王玉佳毕玉芬邵辰光
王玉佳,毕玉芬,姜 华,邵辰光
(云南农业大学动物科学技术学院,云南 昆明 650201)
随着全球气候的变暖和水资源短缺,植物的抗干热能力已成为农业研究中的重要问题。紫花苜蓿(Medicagosativa)是世界广泛栽培的豆科牧草,在促进农业产业结构调整、畜牧业可持续发展和生态治理方面发挥着重要作用[1]。以往有关紫花苜蓿抗逆性的研究大多集中在抗旱、抗寒、抗高温、抗病虫害、耐盐碱、耐酸铝性等方面,这些研究主要集中在单一逆境因子。目前干旱和高温常常协同发生在自然环境中[2],为了降低这种环境对农业带来的损失,许多学者更注重这方面的研究。有研究表明[3-5],干旱和高温协同发生比干旱或高温对植物生长和产量构成的危害要大。有研究表明,干旱高温胁迫影响植物的生理生化特性,主要是在玉米(Zeamays)[6],水稻(Oryzasativa)[7]、高羊茅(Festucaelata)和黑麦草(Loliumperenne)[8]、小麦(Triticumaestivum)[9]等植物,而对于紫花苜蓿干热胁迫的研究鲜见报道。本研究选取6份紫花苜蓿种质为研究对象,旨在为筛选适应干热地区的紫花苜蓿种质改良工作提供理论依据和技术支撑。
1 材料与方法
1.1材料 供试紫花苜蓿种质有6份,分别是:02,14,15,16,26和28号。02号种质取自云南农业大学草业科学试验基地,其余材料取自云南农业大学园林园艺温室(这些材料是2009年5月12日从建水县郊区种鹅厂试验地移栽到温室)。
1.2试验方法 试验采用盆栽方式,将取自云南农业大学草业实习基地的土壤与腐殖质和蛭石以10∶2∶1混匀装在直径40 cm、高30 cm的塑料盆中,灌水后将土压实。2010年4月17日把供试苜蓿枝条扦插在盆中,待新生枝株高为10 cm左右时,拔出弱株,每盆保留10个健壮的植株,在温室中进行培养。2010年7月4日进行试验,每个供试种质栽植6盆,其中3盆为对照,另3盆为干热胁迫处理。3盆对照材料置于室外(自然条件),每隔2 d浇水一次,空气湿度40%左右;干热胁迫的3盆材料在放入人工气候箱前浇水(花盆底部有水流出),14 h之后放入人工气候箱(PQX型)。人工气候箱光强为12 000 lx,空气湿度为30%,白天(12 h)温度为32 ℃,夜间(12 h)温度为25 ℃。分别在胁迫处理后的第4天、第8天、第12天取叶片进行生理指标的测定,并测定土壤含水量。之后对各处理进行复水(以花盆底部有水流出为准),把复水后的各处理放入人工气候箱,于第4天进行生理指标和土壤含水量的测定。对照各指标的测定时间与各处理时间相同。
1.3测定内容 土壤含水量采用烘干称量法测定,叶绿素含量采用比色法,相对电导率采用电导仪法,水分饱和亏缺(WSD)采用烘干称量法[10]。
1.4数据分析 用SPSS 17.0对测定结果进行相关性分析,绘图采用Excel 2003软件。
2 结果
2.1干热胁迫下紫花苜蓿根际土壤相对含水量的变化 紫花苜蓿根际土壤相对含水量在胁迫处理后的第12天达到9.38%,比胁迫第4天下降了64.82%,比胁迫第8天降低了48.57%(表1)。与对照相比,胁迫第4和8天的处理其土壤相对含水量都达到显著水平(P<0.05),胁迫第12天时各处理土壤相对含水量达到极显著水平(P<0.01)。以上结果表明,随着干热胁迫处理时间的延长,紫花苜蓿根际土壤相对含水量呈下降的趋势,胁迫时间越长,对土壤含水量的影响越严重。复水后,土壤相对含水量显著增加,但低于处理前的土壤相对含水量。这时的土壤相对含水量已经达到土壤田间持水量的40%~45%,达到重度水分胁迫水平。复水后各处理的土壤相对含水量与对照土壤相对含水量的差异达到显著水平(P<0.05),表明在胁迫条件下,紫花苜蓿植物体内水分亏缺严重,对土壤水分的消耗量增加,导致土壤含水量降低。

表1 对照及胁迫土壤相对含水量的变化 %
2.2干热胁迫下紫花苜蓿叶片水分饱和亏缺的变化 在胁迫第4天,26号种质叶片WSD显著高于其他种质(P<0.05),高出幅度为29.91%~53.27%;在胁迫第8天,26号种质叶片WSD显著高于除15号外的其他种质,高出幅度6.10%~57.13%;在胁迫第12天,14号种质叶片WSD显著高于其他种质,高出幅度为6.10%~91.96%;在复水第4天,14号种质叶片WSD显著高于其他种质,高出幅度为17.47%~48.11%(表2)。随着胁迫时间的延长,不同种质叶片WSD均表现为:第12天>第8天>第4天,在胁迫的第4~8天,叶片WSD上升幅度在7.80%~43.65%,在胁迫的第8~12天,叶片WSD上升幅度在6.40%~98.70%;各种质与各自对照相比,在第4天,只有26号种质叶片WSD达到显著水平,在第8、12天各种质叶片WSD均达到显著水平;复水后,各种质叶片WSD均显著下降,但均未达到对照水平。
2.3干热胁迫下紫花苜蓿叶片相对电导率的变化 在胁迫第4天,15号种质相对电导率显著高于其他种质(P<0.05),高出幅度为5.05%~50.12%;在胁迫第8天,02号种质相对电导率显著高于其他种质,高出幅度为5.89%~26.94%;在胁迫第12天,16号种质相对电导率显著高于其他种质,高出幅度为2.07%~57.59%;在复水第4天,02号种质相对电导率显著高于除15号种质外的其他种质,高出幅度为3.64%~10.96%(表3)。随着胁迫时间的延长,叶片相对电导率除16、15号种质在第8天较第4天下降,14号种质第12天较第8天下降,其他种质表现为第12天>第8天>第4天,在胁迫的第4~8天,相对电导率上升幅度为2.95%~52.44%,在胁迫的第8~12天,相对电导率上升幅度为8.53%~46.62%;各种质与各自对照相比,除14号种质外,其他种质在第12天都达到显著水平;复水后,除14号种质升高外,其他紫花苜蓿种质相对电导率都降低,但均未达到对照水平。
2.4干热胁迫下紫花苜蓿叶片叶绿素含量的变化 在胁迫第4、8天,16号种质叶绿素含量显著高于其他种质(P<0.05),高出幅度分别为10.15%~78.03%、25.01%~88.04%;在胁迫第12天,16号种质叶绿素含量显著高于除15和02号种质外的其他种质,高出幅度为9.09%~54.30%;在复水第4天,26号种质叶绿素含量显著高于其他种质,高出幅度为32.76%~59.85%(表4)。随着胁迫时间的延长,除15号种质外,其他种质叶绿素含量表现为第4天>第8天>第12天,在胁迫的第4~8天,叶绿素含量下降幅度在3.00%~24.73%,在胁迫的第8~12天,叶绿素含量下降幅度在2.63%~19.92%;各种质与各自对照相比,在第12天叶绿素含量都达到显著水平;在复水后4天,除16和28号种质外,其他紫花苜蓿种质叶片叶绿素含量都有所上升,除26号种质外,其他种质均未达到对照水平。

表2 干热胁迫、复水和正常生长条件下不同紫花苜蓿叶片水分饱和亏缺的变化 %
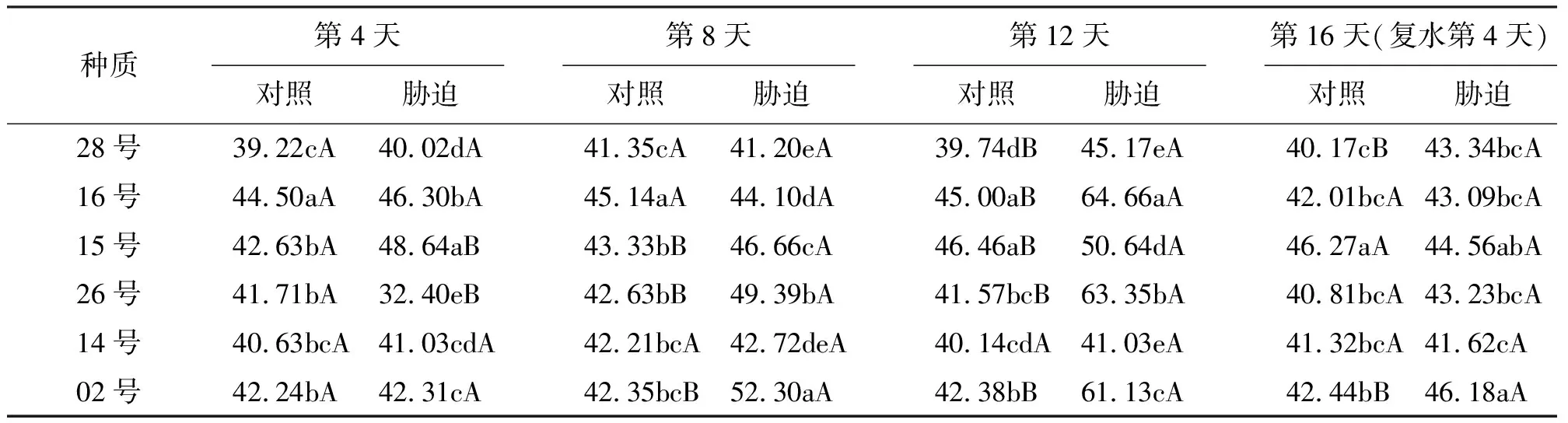
表3 干热胁迫、复水和正常生长条件下不同紫花苜蓿叶片相对电导率的变化 %

表4 干热胁迫、复水和正常生长条件下不同紫花苜蓿叶片叶绿素含量的变化 mg/g
2.5干热胁迫下紫花苜蓿叶绿素含量、叶片WSD和相对电导率的相关性分析 干热胁迫下各紫花苜蓿种质的叶绿素含量与叶片WSD呈显著负相关(r=-0.359,P<0.05),与相对电导率呈负相关(r=-0.052),表明在干热胁迫下,叶绿素含量越高,叶片WSD和相对电导率越小;而相对电导率与叶片WSD呈正相关(r=0.328),相关性未达到显著水平,表明在干热胁迫下,相对电导率越大,叶片WSD越大,反之亦然(表5)。
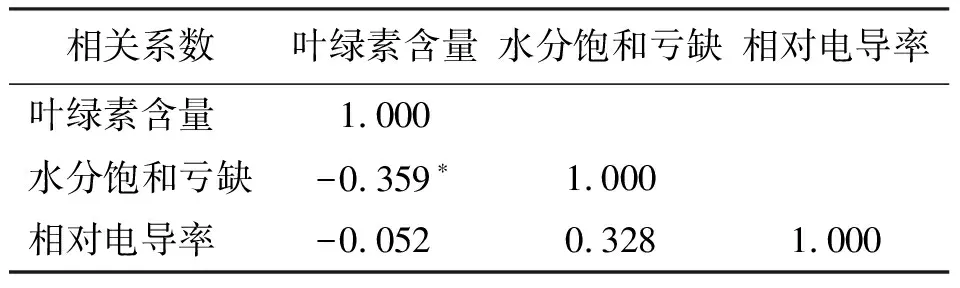
表5 干热胁迫下紫花苜蓿叶绿素含量、WSD和相对电导率的相关性分析
3 讨论
叶片水分饱和亏缺是衡量叶片水分状况的一个重要指标[10]。本结果表明,在干热胁迫中,随着胁迫时间的延长,紫花苜蓿叶片水分饱和亏缺呈逐渐上升的趋势,这与沈艳和谢应忠[11]、Jiang和Huang[5]在研究植物抗性方面的结论一致。在正常条件下,相同生长阶段,不同紫花苜蓿种质叶片水分饱和亏缺不同,这与植物本身的抗性有着密切关系;在干热胁迫第4天,14号种质的叶片水分饱和亏缺比对照低,这可能是胁迫条件还没达到对植株水分代谢产生影响的水平,或者是胁迫条件下植物产生了应激反应,使气孔导度降低,进而影响蒸腾速率[12]。
细胞膜相对透性的变化可以作为植物受伤害程度的指标之一。本研究表明,在干热胁迫下,紫花苜蓿叶片相对电导率大部分呈上升趋势,胁迫处理的紫花苜蓿叶片相对电导率都比对照的大,这与姜义宝等[13]对植物耐热性研究的结论一致。
本试验结果表明,随着干热胁迫时间的延长,叶绿素含量基本呈下降趋势,这与沈艳和谢应忠[11]的研究结果一致。赵凤云和宋忠俊[7]研究了干旱高温胁迫下转基因水稻的生理变化,结果表明在复合胁迫下叶绿素含量下降更大。一般认为抗旱性强的种质比抗旱性弱的种质相比,其叶绿素下降幅度较小,本研究表明,在干热胁迫初期,28和16号种质叶绿素含量下降幅度相对较小;在胁迫后期(胁迫12 d)16号种质下降幅度较大,而14和02号种质下降相对较小。本研究中,只有15号种质叶绿素含量在胁迫第4~8天呈上升趋势,其原因还有待于进一步研究。
本研究表明,紫花苜蓿根际土壤相对含水量在胁迫处理后的第12天达9.38%,比胁迫第4天下降了64.82%,比胁迫第8天降低了48.57%。在干热胁迫的第12天,紫花苜蓿叶片水分饱和亏缺、电导率达到最大、叶绿素含量降到最低,说明胁迫12 d已经严重影响了紫花苜蓿的生长,但是在复水后,6个紫花苜蓿种质都恢复生长,说明胁迫12 d不是6个紫花苜蓿种质的致死水平,紫花苜蓿种质对干热胁迫的临界水平,还有待于进一步的研究。
本研究相关性分析表明,紫花苜蓿叶绿素含量与叶片水分饱和亏缺呈极显著负相关,说明叶绿素含量越高,其叶片水分饱和亏缺越小,这一结论与沈艳和谢应忠[11]的一致。本研究结果支持了Kupper等[14]的学术观点,即紫花苜蓿的叶绿素含量与其保水能力有极大关系。不同苜蓿抗旱性和耐热性不同,有的种质抗旱但不耐热,有的耐热但不抗旱,有的则既抗旱又耐热,但是目前的研究大多都只集中在其中的一种抗性研究上,对于复合胁迫的研究还相对较少。本研究以干旱和高温两种因子互作,分析了紫花苜蓿对干热胁迫的生理响应,表明干热胁迫对紫花苜蓿的生长有严重的影响,克服了以往在抗性方面单一因子研究的局限性,丰富了抗性方面的研究内容,为今后更进一步的研究提供了理论依据。
4 结论
1)在干热胁迫下,同一胁迫时间不同紫花苜蓿种质叶片水分饱和亏缺、相对电导率、叶绿素含量差异性不同。随着胁迫时间的延长,6个紫花苜蓿种质叶片水分饱和亏缺和相对电导率基本呈上升趋势,叶绿素含量基本呈下降趋势。与对照相比,在达到了重度胁迫水平时,26和14号种质的叶片水分饱和亏缺最大;26号种质的相对电导率较大,叶绿素含量相对较低,综合这3个指标初步得出26号种质的耐干热性较差,而28号种质叶片水分饱和亏缺、叶绿素含量、相对电导率与对照相比变化幅度不是很大,初步得出28号种质耐干热性较好。
2)在处理水平上,与干热胁迫第4、8天相比,在干热胁迫处理的第12天,紫花苜蓿叶片水分饱和亏缺、相对电导率达到最大,叶绿素含量达到最小;在复水后,6个紫花苜蓿种质都有不同程度的恢复,说明胁迫12 d不是胁迫的临界水平。
3)通过相关性分析得出:在干热胁迫下,叶绿素含量越高,叶片水分饱和亏缺和相对电导率越小;相对电导率越大,叶片水分饱和亏缺越大。说明叶片水分亏缺会严重影响紫花苜蓿叶绿素的含量,对细胞膜造成伤害。
[1]高永革,李黎,刘祥,等.黄河滩区紫花苜蓿生产性能比较研究[J].草业科学,2008,25(7):59-64.
[2]Mittler R.Abiotic stress,the field environment and stress combination[J].Trends in Plant Science,2006,11(1):15-19.
[3]Craufurd P,Peacock J.Effect of heat and drought stress on sorghum[J].Experimental Agriculture,1993,29(1):77-86.
[4]Savin R,Nicolas M E.Effects of short periods of drought and high temperature on grain growth and starch accumulation of twomalting barley cultivars[J].Australian Journal of Plant Physiology,1996,23(2):201-210.
[5]Jiang Y W,Huang B R.Physiological responses to heat stress alone or in combination with drought:A comparison between tall fescue and perennial ryegrass[J].HortScience,2001,36(4):682-686.
[6]刘瑞侠,李艳辉,胡秀丽,等.干旱高温协同胁迫对玉米幼苗抗氧化防护系统的影响[J].河南农业大学学报,2008,42(4):363-366.
[7]赵凤云,徐忠俊.干旱高温胁迫下转基因水稻的生理变化[J].西北植物学报(英文版),2009,29(2):0240-0248.
[8]王贵平.甜菜碱提高小麦干旱高温耐性的生理机制研究[D].济南:山东农业大学,2009.
[9]叶尚红,张志明,陈疏影.植物生理生化实验教程[M].昆明:云南科技出版社,2004.
[10]刘红云,粱宗锁,刘淑明,等.持续干早及复水对杜仲幼苗保护酶活性和渗透调节物质的影响[J].西北林学院学报,2007,22(3):55-59.
[11]沈艳,谢应忠.干旱对紫花苜蓿叶绿素含量与水分饱和亏缺的影响[J].宁夏农学院报,2004,25(2):25-28.
[12]王玉佳,姜华,毕玉芬,等.紫花苜蓿光合作用对干热胁迫条件的生理响应[J].云南农业大学学报,2011,26(2):190-193.
[13]姜义宝,杨玉荣,王成章.高温胁迫下苜蓿生理生化特性研究[J].科学技术与工程,2007,7(5):820-823.
[14]Kupper H,Kupper F,Spiller M.Environmental relevance of heavy metal substituded chlorophylls using the example of water plants[J].Journal of Experimental Botany,1996,47:259-266.
