过量铁胁迫对豌豆幼苗光合特性和叶绿体膜的影响
2011-04-25蔺冬梅徐世健张新芳安黎哲杨晓明刘慧艳
蔺冬梅,徐世健,张新芳,3,安黎哲,3,杨晓明,刘慧艳
(1.甘肃省庄浪县农技推广中心,甘肃 庄浪 744600;2.兰州大学生命科学学院,甘肃 兰州 730000;3.中国科学院寒区旱区环境与工程研究所,甘肃 兰州 73000;4.甘肃省农业科学院,甘肃 兰州 730070)
铁是植物所必需的微量营养元素,在植物的生命活动(如光合作用、呼吸作用、氮代谢、DNA合成以及激素的合成)中起着重要作用。自20世纪初以来,植物铁营养一直受到国内外植物营养学界的普遍关注,并在缺铁原因、植物缺铁胁迫的适应机理以及铁的生理功能等方面的研究中取得了较大进展[1-2 ]。在热带和亚热带地区,具有较低氧化还原电位的酸性土壤中常会积累过量的亚铁盐,引起植物铁毒症[3-4]以及大豆(Glycinemax)、黄瓜(Cucumissativus)、亚麻(Linumspp.)等作物的生长不良现象都和Fe2+毒害有关[5]。研究表明,铁毒致病的生理机理是植物体内积累过量的铁以及铁化合物诱发多种活性自由基,进而导致脂质过氧化和膜的损伤[3,6]。细胞内叶绿体膜是一个由极性脂质分子组成的双分子层膜,具有正常功能的叶绿体膜处于流动的液晶态,膜的流动性保证了发生在膜上的光合作用得以正常进行。显然,叶绿体膜组分及膜流动性的变化对于揭示异常环境对作物光合作用的影响及其机理具有重要作用。Jayawardena等[7]、Yamanauchi和Yoshida[8]认为,铁毒的抗性机理主要在于叶片组织对铁的耐性或抗性。目前国内外关于过量铁对植物伤害和植物耐铁毒机理方面的研究取得了较大进展[3,9],而对过量铁胁迫下光合特性和叶绿体膜组成及功能相联系来探讨植物对过量铁胁迫的适应研究很少。为了探讨过量铁是通过气孔因素还是非气孔因素来抑制光合作用以及过量铁是否会通过改变叶绿体膜组分和功能进而影响光系统的活性,研究了水培条件下过量铁胁迫对豌豆幼苗光合特性和叶绿体膜组分及流动性的影响,为今后进一步研究铁毒对光合作用的影响机理提供参考,同时也为探明过量铁对植物的伤害机理提供理论依据。
1 材料与方法
1.1材料与处理 豌豆(Pisumsativum)由甘肃省农科院提供。饱满且胚完整的种子经70%酒精表面消毒5 min后,用蒸馏水反复冲洗,然后再经10% H2O2消毒10 min,用蒸馏水反复冲洗后,于光照培养箱培养,待种子露白后转入1/2剂量的Hoagland营养液中培养,待第3片叶完全展开时,进行4个浓度水平铁处理继续培养:100(正常对照)、200、400和600 μmol/L。Fe2+以Fe(Ⅱ)-EDTA形态供应,每3 d换一次营养液,用KOH或HCl调pH值至6.0,温度25 ℃,光照16 h,光照强度400 μmol/(m2·s),相对湿度60%,电动气泵连续通气。处理7 d后测定各项指标。
1.2测定方法
1.2.1光合参数的测定 各处理均选择长势一致的植株,取第3叶位的功能叶进行测定,每个处理测定3株。用LI-6400光合测定仪测定净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr),并计算水分利用效率(WUE=Pn/Tr),羧化速率(CE=Pn/Ci)。测定时大气压P为(100±0.1) kPa,CO2浓度为(380±10) μmol/mol,利用6400-O2LED红蓝光源控制光强PFD为800 mol/(m·s),湿度为60%~70%,叶室温度为25 ℃。
1.2.2叶绿素含量测定 叶绿素含量测定参考张志良[10]的方法,每个样品重复3次。
1.2.3叶绿素荧光动力学测定 用PAM-2100叶绿素荧光分析仪测定初始荧光(Fo)、最大荧光(Fm)、光化学猝灭系数(qP)、非光化学猝灭系数(qN)及光合电子传递速率(ETR)和光化学量子产量(Yield),并计算最大光化学速率(Fv/Fm)、潜在光化学效率(Fv/Fo)。5次重复,测定前各叶片暗适应30 min,每次重复随机选取3片叶子。
1.2.4叶绿体膜组分及流动性测定 叶绿体膜的提取及流动性的测定参考杨景宏和陈拓[11]的方法,膜脂肪酸测定参考Zhang等[12]方法略加修改。总脂提取以后,将提取的总脂于15%的NaOH/CH3OH溶液60 ℃水浴30 min进行皂化,待冷却至室温,加入酸化的CH3OH(6 mol/L HCl∶CH3OH,54∶46) 60 ℃水浴10 min进行甲酯化,并冷却至室温。用有机溶剂正己烷萃取后,将上相用碱性溶液(1.5% NaOH)进行纯化。2 919 r/min室温离心5 min,取上相蒸发浓缩后进行GC-MS分析。采用峰面积归一化法计算各种脂肪酸甲酯的相对百分含量。
1.2.5数据分析 用SPSS 13.0进行统计分析,利用Duncan多重比较法进行差异显著性分析。所有数据为3次重复的平均值,数据以平均值±标准误(mean±SE)来表示。
2 结果与分析
2.1过量铁处理对光合指标的影响 随着铁浓度的升高,幼苗净光合速率和蒸腾速率下降(图 1A)。与对照相比,净光合速率分别下降了17.16%、20.57%和45.30%;其中600 μmol/L铁处理时光合速率下降最明显,同时蒸腾速率也显著下降(P<0.05),分别下降了6.87%、12.70%和17.38%(图1A)。此外,气孔导度随铁浓度升高显著下降(P<0.05),分别下降了9.70%、47.98%和56.38%(图1B),结果表明叶片气孔导度变化规律与净光合速率的变化极其相似,这说明过量铁处理下,净光合速率的下降主要由气孔因素造成;叶片胞间CO2浓度也随着铁浓度升高而显著下降(P<0.05),与对照相比分别下降了8.19%、9.69%和16.92%(图1C),说明过量铁处理下气孔抑制影响了叶片的气体交换与CO2吸收,进而抑制了光合作用的进行;同时与对照相比,叶片水分利用效率和羧化速率随着铁浓度升高逐渐下降,幼苗水分利用效率分别下降了11.37%、6.03%和16.71%,羧化效率分别下降了9.81%、12.25%和17.65%(图1D)。
2.2对叶绿素含量及光谱吸收的影响
2.2.1对叶绿素含量的影响 与对照相比,叶绿素a、叶绿素b、总色素含量以及类胡萝卜素含量均呈现不同程度的下降趋势。同时,对照组和处理组间各色素差异显著(P<0.05)(图2)。过量铁处理下叶绿素含量的下降可能是叶片在遭受过量Fe胁迫时,植物细胞色素系统遭到破坏,导致叶绿素含量降低[13],在叶绿体中积累了过量铁,导致自由基大量产生并将其进行氧化,使叶绿素的含量逐渐减少。而色素含量的下降又直接造成光合作用的下降。同时从Fe2+浓度与叶绿素含量变化关系也可以看出,过量施Fe2+会明显降低叶片叶绿素含量。此外,过量铁胁迫导致类胡萝卜素含量下降,而类胡萝卜素尤其是β-胡萝卜素能猝灭不稳定的三线态叶绿素,具有强氧化作用,从而保护受光激发的叶绿素免遭光氧化的破坏,降低了单线态氧对光合膜的损伤。因此,类胡萝卜素含量的降低可能使叶绿素遭破坏,也在一定程度上抑制了植物光合作用的正常进行。
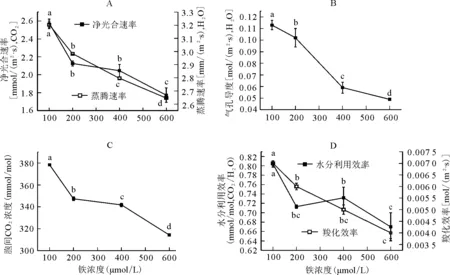
图1 过量铁胁迫对豌豆幼苗光合参数的影响
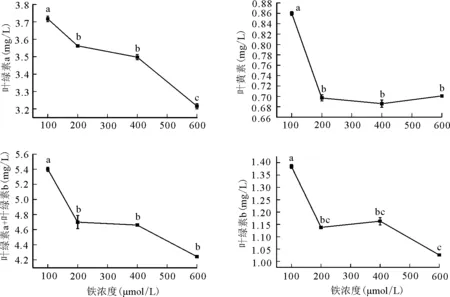
图2 过量铁胁迫对豌豆幼苗叶绿素含量的影响
2.2.2对叶绿素吸收光谱的影响 豌豆幼苗在过量铁处理后,叶绿素在可见光区仍然存在两个强的吸收带。红光区的最强吸收带在663 nm左右,蓝光区的最强吸收带在432 nm左右。叶绿素吸收光谱各曲线间相比较可以发现,除吸收峰的高低随铁浓度变化以外,各吸收曲线的形状或变化趋势基本一致,并没有出现吸收波的偏移(图 3),这说明过量铁只造成叶绿素含量的变化而对其分子结构并没产生破坏作用。
2.3对叶绿素荧光动力学影响
2.3.1对初始荧光和最大荧光的影响 与对照相比,随着铁浓度的升高,Fo逐渐上升且显著高于对照(P<0.05),其增长率依次为42.04%、47.41%和48.30%(图4A),与Fo变化相反,Fm随着铁浓度升高逐渐下降,下降率依次为4.03%、4.24%和34.33%(图4A)。从Fo变化规律图可以看出,200 μmol/L是一个关键点,高于200 μmol/L时,Fo趋于稳定,这表明PSRC反应中心受到了严重的破坏,受到了伤害或不可逆失活。此外PSⅡ(多亚基蛋白复合体)位于类囊体膜上,Fo的上升可能是过量铁胁迫导致类囊体膜结构的破坏引起的。
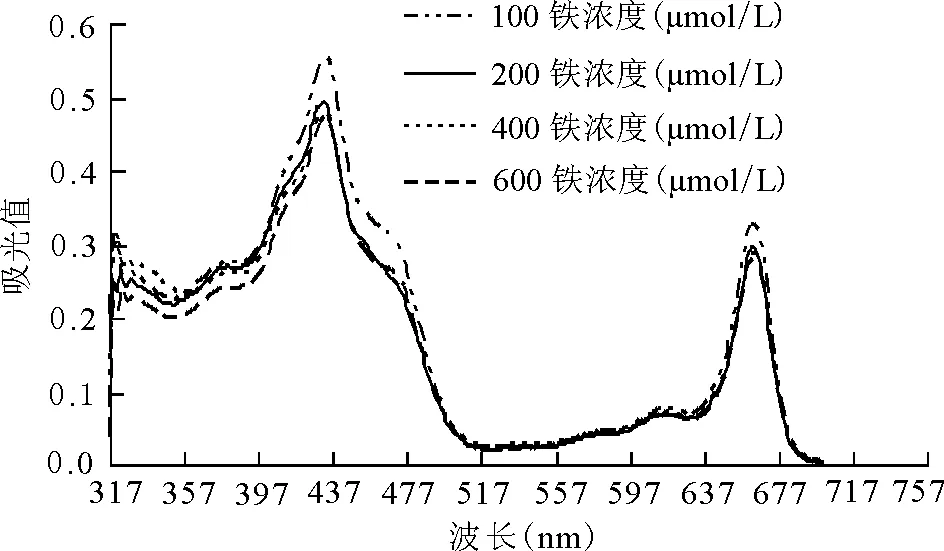
图3 过量铁胁迫对豌豆幼苗叶绿素吸收光谱的影响
2.3.2对最大光化学速率和潜在光化学效率的影响 与对照相比,过量铁导致Fv/Fm逐渐下降,其下降率依次为0.57%、1.03%和1.51%(图4B);与Fv/Fm变化相似,Fv/Fo随铁浓度升高而逐渐下降,其下降率依次为3.07%、4.13%和10.53%(图4B)。上述结果表明,过量铁胁迫时PSⅡ反应中心处于完全关闭时的量子产量下降,通过PSⅡ的电子传递量减少,对PSⅡ反应中心产生了损害,致使光能转化能力显著下降。
2.3.3对光合电子传递速率和光化学量子效率的影响 随着铁浓度升高,ETR与对照相比显著下降(P<0.05),其下降率依次为12.29%、14.93%和19.34%(图4C);与ETR相似,Yield也随铁浓度的升高呈下降趋势,其下降率依次为9.78%、13.71%和16.92%(图4C)。结果表明,过量铁胁迫降低了PSⅡ的原初光能捕获能力与光合电子传递能力,从而导致了光合系统功能的下降。
2.3.4对光化学猝灭系数和非光化学猝灭系数影响 与对照相比,过量铁胁迫下qP显著下降(P<0.05),其下降率依次为6.04%、15.66%和25.65%(图4D);与qP相反,qN随着铁浓度的升高呈现上升趋势,其增长率依次为0.31%、16.02%和17.56%(图4D)。结果表明,过量铁胁迫严重破坏了豌豆幼苗光合电子传递途径,使得光合电子传递活性不断下降,用于光化学反应的能量逐渐减少,而以热能形式散失掉的光能部分逐渐上升。
2.4对叶绿体膜组分及流动性的影响
2.4.1对叶绿体膜组分的影响 表1是过量铁胁迫下叶绿体膜脂肪酸组成的气相色谱分析结果。豌豆叶片叶绿体膜脂肪酸主要由豆蔻酸(14∶0)、棕榈酸(16∶0)、硬脂酸(18∶0)、亚油酸(18∶2)、亚麻酸(18∶3)组成,且以亚麻酸为主,含量超过60%。过量铁胁迫使叶片膜脂肪酸组分并没发生改变而使其配比发生了变化,各处理组饱和脂肪酸的相对含量都低于对照组,与此相对的是不饱和脂肪酸的含量则较对照组有所提高。与对照相比,随着铁浓度升高,棕榈酸含量逐渐下降,分别降低了1.91%、3.71%和25.07%,相反亚油酸含量上升,增长率分别为15.99%、0.94%和16.28%(表1)。结果表明,过量铁胁迫下叶片饱和脂肪酸含量逐渐下降,而不饱和脂肪酸含量上升,膜脂脂肪酸不饱和指数(IUFA )也上升。
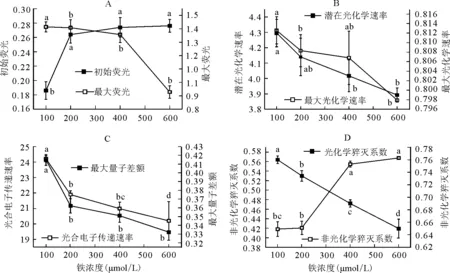
图4 过量铁胁迫对豌豆幼苗叶绿素荧光特性的影响
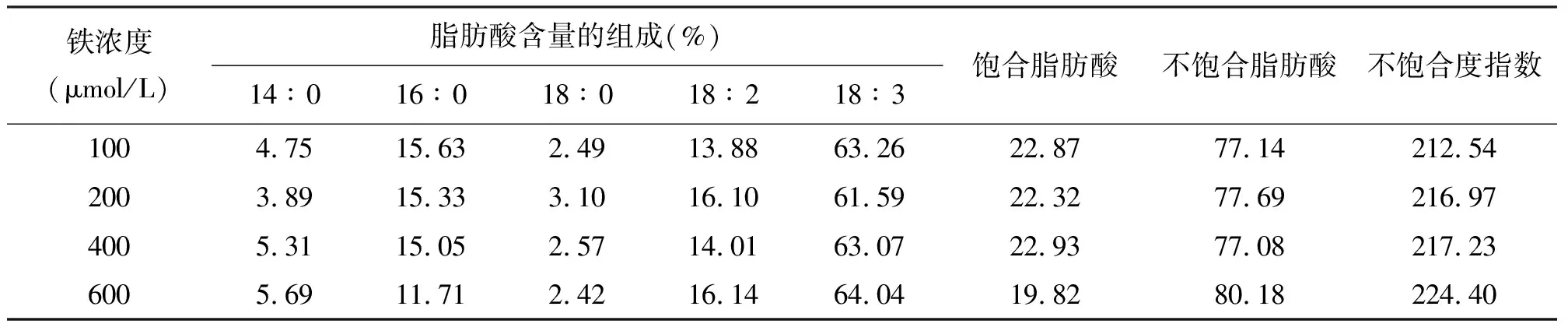
表1 过量铁胁迫下豌豆叶绿体膜脂脂肪酸组成
2.4.2对叶绿体膜流动性的影响 图5为过量铁胁迫处理后豌豆幼苗叶片叶绿体膜的ANS荧光扫描曲线图。经过量铁胁迫处理后的豌豆叶绿体膜的ANS荧光曲线峰值均低于对照组。以往的研究表明,与膜结合的ANS荧光强度的变化可以间接地反映膜脂流动性的变化,且荧光强度愈大,表明膜脂的流动性愈小[11]。过量铁处理提高了幼苗叶绿体膜的流动性,这与表1揭示的过量铁作用下豌豆叶绿体膜脂肪酸组分的变化是相对应的。因此,推测过量铁胁迫下叶绿体膜流动性的变化可能是由铁胁迫引起的膜不饱和脂肪酸升高所造成的。
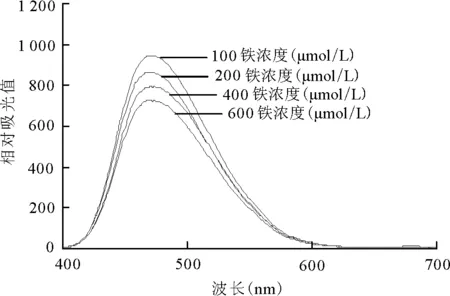
图5 过量铁胁迫对豌豆幼苗叶绿体膜流动性的影响
3 讨论
光合作用是高等植物生长发育和产量形成的基础,目前过量铁对植物光合作用的影响是铁胁迫生物学效应研究的重点。众所周知,逆境胁迫会导致植物净光合速率的下降,一般认为净光合速率的下降由两种因素引起:气孔因素和非气孔因素[14]。本研究表明,随着铁浓度的升高,铁胁迫引起叶片净光合速率、气孔导度和蒸腾速率均大幅度降低。此外,过量铁胁迫下豌豆幼苗的蒸腾速率、气孔导度迅速下降,叶肉细胞的水分利用效率以及羧化速率也呈现不同程度的降低,这与章艺和刘鹏[15]的研究结果一致。同时,研究发现豌豆幼苗虽然受到过量铁的毒害,但植物体尚没有完全失去其生理功能,光合作用机制没有被完全破坏,且光合作用的降低主要是由过量铁胁迫下光合作用发生了气孔抑制引起。
过量铁胁迫对光合作用的影响是多方面的,叶绿素荧光信号可反映逆境因子对光合作用的影响[16]。分析叶绿素荧光参数的变化有助于探明光合机构受影响的部位[17]。最大光化学速率常被用作表明环境胁迫程度的指标和探针,Fv/Fm降低表明PSⅡ潜在活性受损,植物受到了光抑制[18],而PSⅡ失活或被破坏则导致初始荧光的升高[19]。在本研究中,过量铁胁迫使叶片最大光化学速率逐渐下降,表明PSⅡ已经受到铁胁迫的损害。初始荧光变化反应植物逆境条件下受害程度,它的上升表明PSⅡ反应中心失活[20]。而在逆境环境下,PSⅡ反应中心失活将严重影响光化学连锁反应[19]。同时过量铁胁迫使原初光能转化效率下降,造成豌豆PSⅡ活性中心受损,使光合电子传递受阻,量子产额下降,从而推动碳同化循环的ATP加ADPH比例的失调,CO2同化速率下降,进而影响了豌豆幼苗光合作用的正常进行。
叶绿体膜是光合作用的场所,因此,研究过量铁胁迫对光合作用与叶绿体膜系统结构与功能的影响在揭示过量铁生物学效应的机理研究中具有重要意义。当然,叶绿体膜在植物光合作用的光捕获和电子传输反应中也起着重要作用[9]。Zhang等[12]和王萍等[21]研究发现,不饱和脂肪酸的增加就意味着膜流动性的升高,使膜脂产生物相变化,从凝胶相变为液晶相,膜脂的脂肪酸链由有序排列变为无序。脂肪酸配比发生变化,这种变化将导致膜上生化反应发生变化,从而引起光合能量利用效率发生改变。本研究表明,过量铁胁迫使叶绿体膜饱和脂肪酸含量下降,而不饱和脂肪酸含量相对升高,从而引起膜流动性升高,进而影响细胞膜的光合特性。另外,叶绿素作为膜上色素蛋白复合体的重要组成部分,过量铁胁迫下叶绿素含量的降低必将影响色素蛋白复合体的功能,使叶片光合速率下降,影响植物的正常生长发育。
4 结语
光合作用是高等植物物质代谢和能量转化的最初源泉,同时也是一个极其复杂的生理过程。植物的光合速率与植物叶片的自身因素如叶绿素含量、叶片厚度密切相关,又受光照强度、气温、空气相对湿度、土壤水分含量等外界因素的影响。本研究认为,过量铁胁迫可能通过降低光合色素含量、PSⅡ活性中心受损、破坏叶绿体膜的结构和功能等多种非气孔因素影响植物的光合作用,也可能通过气孔因素间接影响植物的光合作用。尽管对于铁与植物叶片光合作用的关系已开展了一些研究,但过量铁到底以何种方式影响光合作用在许多方面仍不是十分清楚。例如:1)铁毒引起植物体内叶绿素含量下降的具体机制如何?2)过量铁如何对气孔进行调控?3)过量铁是否通过影响矿质元素的吸收而间接抑制光合作用?因此,在今后的研究中应该进一步结合分子学以及生物化学的方法来研究铁毒胁迫下植物光合作用的生理和分子机制,进一步阐明光合作用与各胁迫因子间的特异性关系。
[1]Timperio A M,D’Amici G M.Proteomic,pigment composition,and organization of thylakoid membranes in iron-deficient spinach leaves[J].Journal of Experimental Botany,2007,58(13):3695-3710.
[2]Winder T L,Nishio J N.Early iron deficiency stress response in leaves of sugar beet[J].Plant Physiology,1995,108:1487-1494.
[3]Becana M,Moran J F.Iron-dependent oxygen free radical generation in plants subjected to environmental stress:toxicity and antioxidant protection[J].Plant and Soil, 1998,201:137-147.
[4]Majerus V,Bertin P.Effects of iron toxicity on osmotic potential,osmolytes and polyamines concentrations in the African rice (OryzaglaberrimaSteud)[J].Plant Science, 2007,173:96-105.
[5]邹邦基,何雪晖.植物的营养[M].北京:农业出版社,1985:216-217.
[6]Sailta S,Manisha G,Prakash C.Oxidative stress induced by iron inHydrinaverticinataroyle:response of anti-oxidants[J].Ecotoxicology and Environmental Safety,1997,138:286-291.
[7]Jayawardena S D G,Watabc T,Tanaka K.Relation between root oxidizing power and resistance to iron toxicity in rice[J].Report of Society of Crop Science and Breeding in Kinki (Japan),1977,22:34-38.
[8]Yamanauchi M,Yoshida S.The difference of leaf tissues tolerance for iron toxicity among rice leaves[J].P1ant Science and P1ant Nutrition,1982,28:983-988.
[9]Terry N.Iron stress-mediated changes in light-harvesting and electron transport capacity and its effects on photosynthesis in vivo[J].Plant Physiol,1983,71:855-860.
[10]张志良.植物生理学实验指导[M].北京:高等教育出版社,1998:103-115.
[11]杨景宏,陈拓.增强紫外线B辐射对小麦叶绿体膜组分和膜流动性的影响[J].植物生态学报,2000,24(1):102-105.
[12]Zhang Y F,Zhao Z G,Zhang M X.Seasonal acclimation of superoxide anion production,antioxidants,IUFA,and electron transport rates in chloroplasts of twoSabinaspecies[J].Plant Science,2009,176:696-701.
[13]刘新星,罗俊杰.豌豆幼苗在盐胁迫下的生理生态响应[J].草业科学,2010,27(7):88-93.
[14]周建,杨立峰.低温胁迫对广玉兰幼苗光合及叶绿素荧光特性的影响[J].西北植物学报,2009,29(1):0136-0142.
[15]章艺,刘鹏.高Fe2+对大豆叶片光合作用的影响[J].中国油料作物学报,2007,29(4):438-442.
[16]王恺,刘一明,王兆龙.假俭草和海滨雀稗对土壤铅污染胁迫的生理反应[J].草业科学,2010,27(2):32-38.
[17]胡文海, 喻景权.低温弱光对番茄叶片光合作用和叶绿素荧光参数的影响[J].园艺学报,2001,28(1):41-46.
[18]王玉萍,何文亮,程李香.不同海拔珠芽蓼叶片类囊体膜色素含量及光系统功能变化[J].草业学报,2011,20(1):75-81.
[19]高芸,程智慧.NaCl处理对番茄幼苗光合作用和叶绿素荧光的影响[J].干旱地区农业研究,2008,26(1):194-199.
[20]Demming A B,Adams W W.Photoprotection and other responses of plants to high light stress [J].Annual Review of Plant Physiology and Plant Molecular Biology,1992,43:599-626.
[21]王萍,张成军,陈国祥,等.低温对水稻幼苗类囊体膜脂肪酸组成和膜脂过氧化的影响[J].中国水稻科学,2006(4):401-405.
