沙打旺苗期对黄矮根腐病菌的抗性评价
2011-04-25俞斌华南志标李彦忠
俞斌华,南志标,李彦忠
(兰州大学草地农业科技学院,甘肃 兰州 730020)
沙打旺(Astragalusadsurgens)是豆科黄芪属多年生草本植物,属于直根深根系植物,因其抵御风沙能力强而得到“沙打旺”的美誉[1]。沙打旺作为优质牧草,具有耐盐碱、耐瘠薄、抗寒和抗旱等特性,20世纪70年代初,在我国黄土高原被大面积种植[2],到1986年底,在陇东黄土高原栽培面积近8.2万hm2[3],现广泛分布于我国东北、华北、西北等地[4]。在俄罗斯、日本、蒙古以及北美洲温带地区也广泛分布[5]。
沙打旺虽为多年生牧草,但其草地利用年限较短,经济利用期仅有2~3年,草地建植3年后,盖度从100%降低到60%,5年后开始出现衰退现象[6-8]。真菌性病害是造成沙打旺产量、品质降低和草地利用年限缩短的主要原因[9-12]。由沙打旺埃里砖格孢(Embellisiaastragalisp. nov. Li & Nan)引起的黄矮根腐病是沙打旺植株上新发现的最严重的病害之一,其不仅使沙打旺草地建植不良,而且使沙打旺草地的持久性缩短,严重影响沙打旺草地的生产力、利用寿命、牧草品质和种子产量[13-15]。该病菌可寄生于植物全株,在叶柄和茎秆中的分离率显著大于叶片和根部,引起植株系统发病,典型症状为叶斑、叶片黄化、茎秆矮化、茎秆变色、根颈和根腐烂,只在死亡植株表面产生分生孢子。病菌在种皮内、病株的茎基部、根颈、根中以及在死亡植株表面越冬,通过种子带菌远距传播,死亡病株上的分生孢子通过气流和雨水飞溅传播,在春秋两季发生侵染,病株带菌引起植株连年发病。土壤水分越高、植株越稠密,危害越重[13-14,16]。
用于控制植物病害的方法主要有:利用抗病品种、物理防治、生物防除及杀菌剂处理。使用杀菌剂和生物防除方法成本较高,尤其是使用大量化学性杀菌剂,还会污染环境,威胁生物安全。与之相比,利用抗病品种是控制植物病害最经济、最安全、最有效的方法[17-19]。
然而,目前关于沙打旺抗黄矮根腐病的抗病品种筛选,国内外鲜见报道。因此,评价沙打旺对埃里砖格孢的抗病性对于沙打旺黄矮根腐病的防治具有重要的意义。本研究评价我国的10份沙打旺材料在幼苗阶段对黄矮根腐病的抗病性,是温室和田间抗病性评价的重要基础工作,以期为通过利用抗病品种防治沙打旺黄矮根腐病提供理论依据。
1 材料与方法
1.1沙打旺种子 本试验收集了中国沙打旺主要种植区的10份材料,分为育成品种、地方品种和野生材料(表1)。种子保存在兰州大学草地农业科技学院种子库中(4 ℃,黑暗),种子发芽率依照国家种子检验规程[20]操作。

表1 沙打旺种子材料
1.2沙打旺埃里砖格孢 本试验接种病原真菌为沙打旺埃里砖格孢模式种MHLZU-HX0401,分离自甘肃省环县(37.12° N、106.82° E,海拔1 650 m)发病沙打旺植株茎部,并于22 ℃恒温培养箱(Sanyo Incubator,Japan)中,WHDA(wheat hay decoction agar)培养基上密封培养3个月。
1.3接种方法 将沙打旺种子分别经过1%次氯酸钠溶液处理10 min和75%酒精溶液处理3 min后,用无菌水冲洗3次,置于无菌滤纸上晾干[21]。然后用灭菌镊子将种子均匀摆放在培养皿中埃里砖格孢菌落边缘(接种处理),每皿10粒,每5皿一个重复,共5个重复,随机摆放在22 ℃恒温培养箱中黑暗培养。未接种处理为将表面消毒的种子放置于不接种的WHDA空白培养基表面培养。
1.4数据测量 按照国家种子检验规程[20],每天统计种子的发芽率,其中第3天的发芽率定义为种子的发芽势[22]。
于第15天用直尺测量幼苗苗长、根长,并将幼苗以培养皿为单位置于80 ℃烘箱中烘36 h后[21],称量幼苗干质量(Mettler Toledo,AL104),然后计算出接菌苗比未接菌苗干质量的降低比例。
1.5抗病性评价 每3 d随机选取4皿接种幼苗,于显微镜(Leica DM 2500,200×)下测量菌丝体在幼苗表面上的扩展长度。然后将其截成数段(视幼苗根茎长度确定段数,每段0.5 cm),于0.05%的苯胺蓝染液中沸煮15~30 s,用蒸馏水冲洗后在显微镜下(400×),测量幼苗根、茎中菌丝的分布长度和深度[23]。
于第15天计算发病率、死亡率,并依据变色与坏死部分的总长度占整个幼苗长度的比例评价症状强度(symptom intensity,SI):0=无变色与坏死,1=1.0%~10.0%,2=10.1%~30.0%,3=30.1%~50.0%,4≥50.1%,5=幼苗死亡[13]。然后用公式[24]计算出病情严重度(disease severity index,DSI)。
最后将所有材料依据病情严重度分类:免疫=0,抗病=0.1%~20.0%,中抗=20.1%~40.0%,中感=40.1%~60.0%,感病>60.0%[25-26]。
1.6统计分析 所有数据用Microsoft Excel 2003作图,并用SPSS 13.0分析。
2 结果
2.1发芽率和发芽势 所有材料接种沙打旺埃里砖格孢后的最初阶段,发芽速度都有所增加,发芽势均显著高于未接种种子(P<0.05)(表2)。之后未接种种子的发芽率上升较快而接种种子的发芽率上升缓慢。接种后15 d时,所有沙打旺材料的发芽率均高于70%,其中8份材料的沙打旺种子在埃里砖格孢处理中发芽率均小于未接种种子,但差异不显著(P>0.05)。埃里砖格孢对杂花和宁夏彭阳沙打旺种子的发芽率未产生影响(表2)。
2.2苗长和根长 与未接种幼苗相比,所有接种幼苗的苗长均有所降低,其中鄂尔多斯、河南、辽宁阜新、内蒙早熟、宁夏彭阳5个栽培品种以及固原野生沙打旺苗长的降幅均高于20%;而普通、陕西榆林、杂花和中沙一号苗长的降幅也接近10%,并且前6份材料与后4份材料苗长降幅差异显著(P<0.05)(表3)。与未接种对照相比,埃里砖格孢显著增加了所有沙打旺材料幼苗的根长(P<0.05),增幅均高于90%。其中鄂尔多斯、宁夏彭阳根长的增幅显著高于河南和辽宁阜新根长的增幅(P<0.05),其余材料介于其间(表3)。
2.3幼苗干质量 埃里砖格孢显著降低了10份沙打旺材料幼苗的干质量(P<0.05),其中鄂尔多斯、固原野生、河南、辽宁阜新、内蒙早熟和宁夏彭阳的幼苗干质量降幅均高于或接近40%,而普通、陕西榆林、杂花和中沙一号幼苗干质量的降幅均低于30%,并且前6份材料幼苗干质量的降幅显著高于后4份材料的降幅(P<0.05)(表3)。
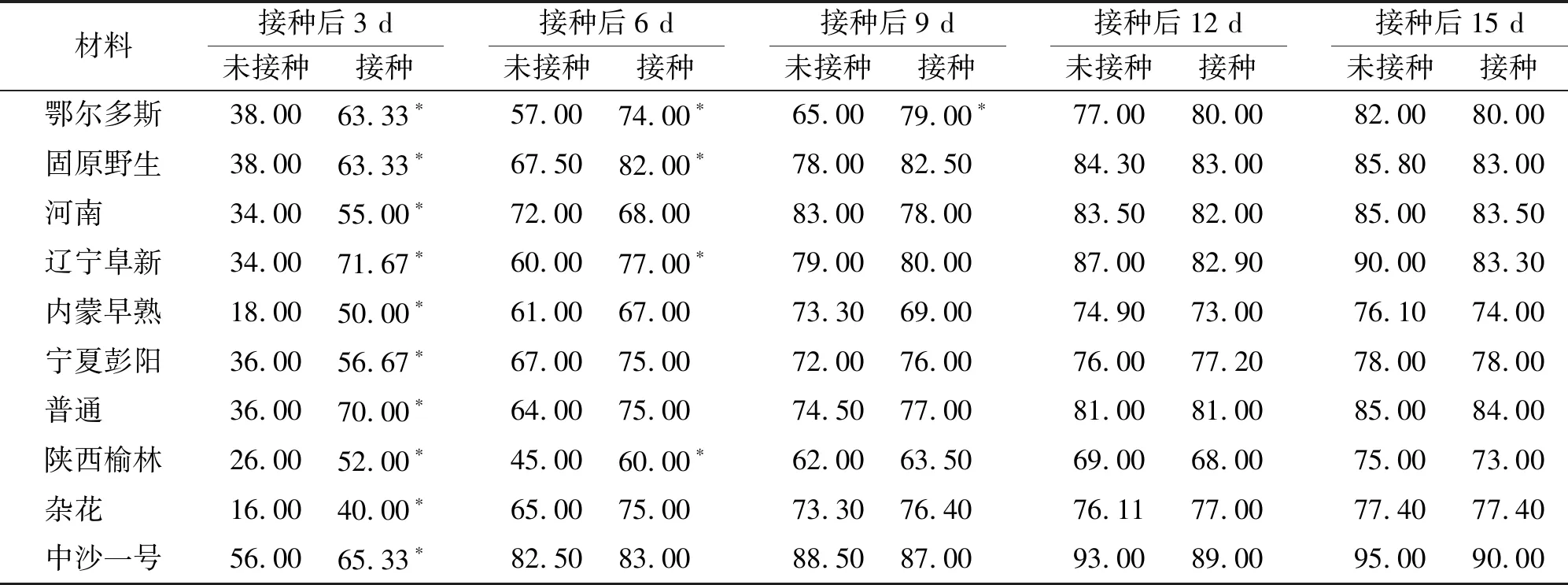
表2 埃里砖格孢对沙打旺种子发芽的影响 %
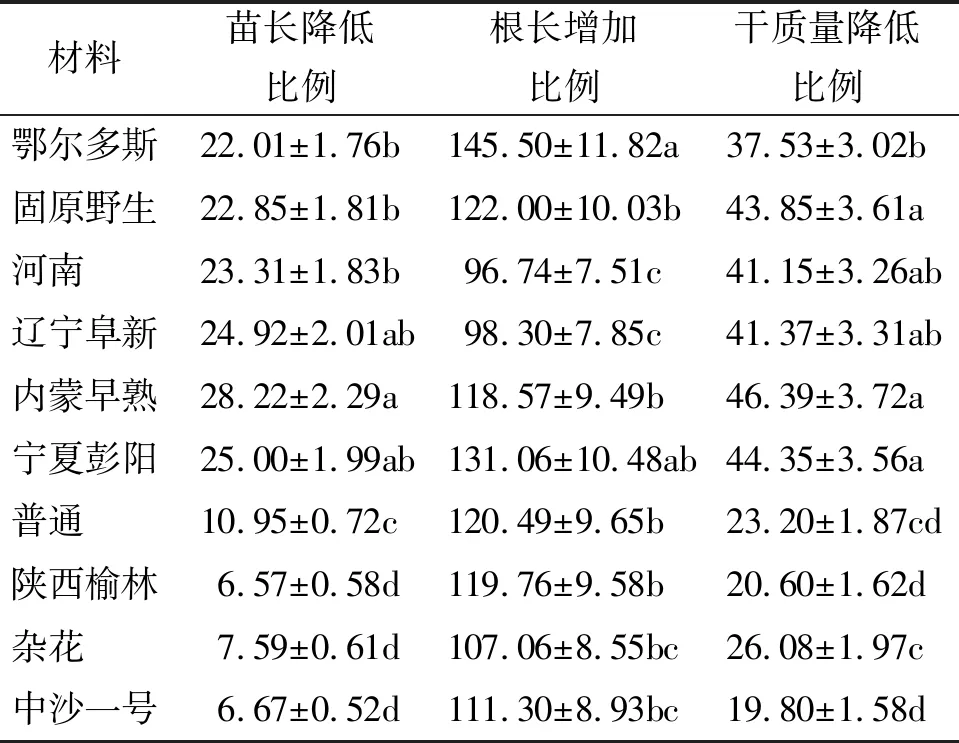
表3 埃里砖格孢对沙打旺幼苗苗长、根长及干质量的影响 %
2.4病原菌扩展水平 在10份沙打旺材料的接种幼苗上,埃里砖格孢菌丝都呈扩展生长的趋势。5次测量,各材料幼苗上菌丝扩展长度均差异显著(P<0.05)。菌丝扩展长度由大到小依次为:内蒙早熟、宁夏彭阳、固原野生、辽宁阜新、河南、鄂尔多斯、普通、杂花、陕西榆林、中沙一号(表4)。其中,埃里砖格孢菌丝在固原野生、辽宁阜新、内蒙早熟、宁夏彭阳沙打旺上的扩展长度显著大于在鄂尔多斯、普通、陕西榆林、杂花、中沙一号上的扩展长度(P<0.05)。不同测量时间,同一材料幼苗上的菌丝扩展长度也差异显著(P<0.05)(表4)。

表4 接种沙打旺埃里砖格孢后幼苗中菌丝的扩展长度 cm
2.5病原菌侵入水平 在沙打旺幼苗中,埃里砖格孢菌丝也向幼苗内部入侵。接种后3 d时所有材料均有超过58%的幼苗表面分布有埃里砖格孢菌丝;接种后6 d时10个沙打旺材料中均有超过3%幼苗的皮层中检测到埃里砖格孢菌丝;接种后15 d时埃里砖格孢菌丝侵入沙打旺各材料幼苗髓部,侵染率超过5%(表5)。其中,侵入速度较快的有鄂尔多斯、固原野生、内蒙早熟和宁夏彭阳沙打旺,侵入速度较慢的有普通、陕西榆林、杂花和中沙一号沙打旺。接种后15 d时在固原野生、内蒙早熟和宁夏彭阳沙打旺的部分幼苗上观察到菌丝已经于根茎处产孢(表5)。

表5 沙打旺幼苗在埃里砖格孢菌丝侵入不同水平下的侵染率 %
2.6抗病评价 所有材料的幼苗在接种后发病率、死亡率、症状强度和病情严重度均差异明显。内蒙早熟和宁夏彭阳的发病率、死亡率、症状强度和病情严重度均显著高于其他材料(P<0.05),而陕西榆林和中沙一号的各项抗病相关指标则具有较低的值(表6)。通过分析以上指标可以得到如下结果:在10个沙打旺材料中,无免疫材料;抗病材料为陕西榆林和中沙一号;中抗材料为普通和杂花;中感材料为鄂尔多斯、固原野生、河南和辽宁阜新;感病材料为内蒙早熟和宁夏彭阳(表6)。
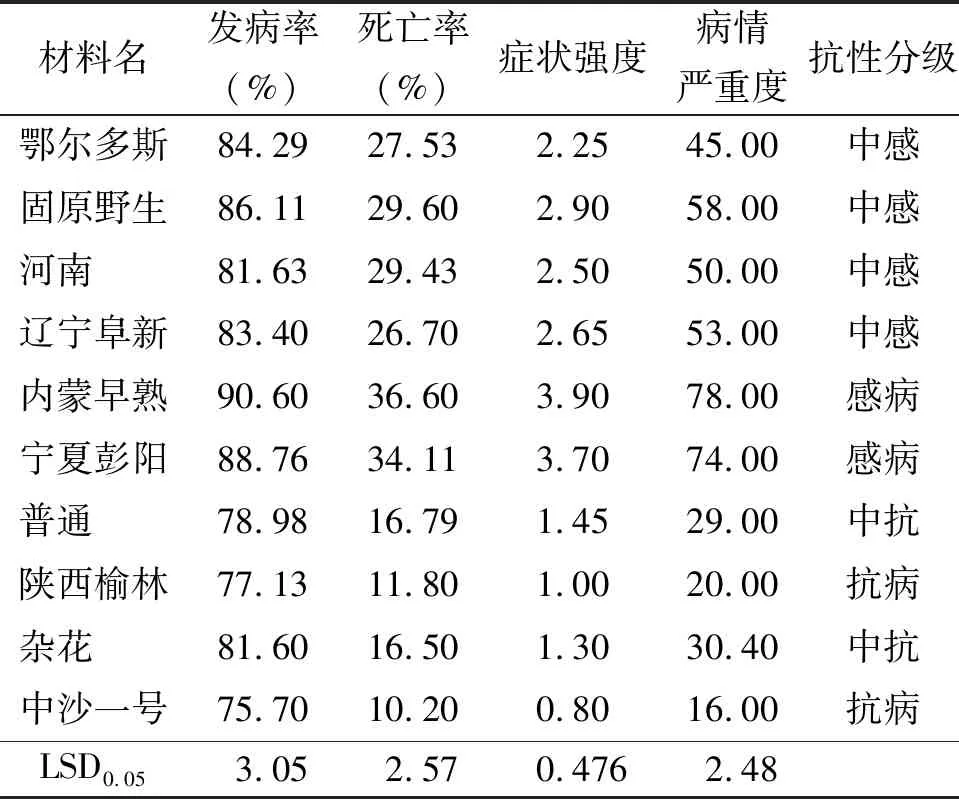
表6 发病率、死亡率、症状强度、病情严重度和抗性分级
3 讨论
本研究在室内评价了10份沙打旺材料对黄矮根腐病的抗病性。根据埃里砖格孢对沙打旺种子发芽率、发芽势、苗长、根长、苗干质量、菌丝在幼苗中的扩展和侵入水平等指标的综合分析,得出在幼苗阶段抗病性较强的材料为陕西榆林和中沙一号,抗病性较弱的材料为内蒙早熟和宁夏彭阳,其余材料介于其间。
埃里砖格孢未显著降低参试沙打旺材料的发芽率,但在接种初期短时间内加速了种子的萌发,提高了存活率,与Li和Nan[15]的研究结果一致。埃里砖格孢显著提高了10份沙打旺材料幼苗的发芽势,这可能与病原菌影响了寄主的激素平衡或与病原菌产生的次生代谢物有关[27]。根苗长的变化是植株感病后的农艺性状表现,也是不同沙打旺材料抗病性评价的重要依据[28]。本研究发现,病原菌显著降低了其中6份沙打旺材料的苗长,与Li和Nan[15]的研究结果一致,但所有材料的幼苗根长显著增加。健康幼苗的根较短,粗壮,但感病幼苗的根显著增长、变细,有背向菌落中心生长的趋势,并且与不同材料间抗病水平差异的趋势不同。这可能与病原菌受到侵染后,植株中赤霉素总量减少,脱落酸浓度偏高,或其他激素平衡受到扰动有关,而与植物抗病水平无关[29],具体原因有待进一步研究。同时,埃里砖格孢侵染导致所有材料幼苗干质量显著下降,是发芽率降低、死亡率上升、株高下降以及病情指数上升导致的发病与坏死的综合表现。
对病原菌菌丝扩展与侵入的观察统计发现,本研究中陕西榆林和中沙一号对沙打旺埃里砖格孢的抗性较强,菌丝在这两个材料的幼苗表面扩展较慢,菌丝侵入时,在不同水平下幼苗侵染率也低于其他材料。与之相反,内蒙早熟和宁夏彭阳在这两个指标中表现较差。这与寄主的抗侵入和抗扩展机制有关。当病原菌侵染时,寄主表皮细胞壁通常膨大,有时形成类胶状沉淀层,而在抗病材料根部的壁旁区,会积累大量的多糖,并伴随萜类和酚类化合物的合成,导致细胞壁增厚[29]。当病原菌侵入后,植株维管组织的细胞会表现坏死现象,坏死细胞可能导致寄主积累胶状物质、胼胝质、木质素、木栓质和酚类物质,这些物质可限制病原菌对维管组织的进一步侵染[31-32],但具体机理尚需深入研究。
发病率、死亡率以及病情严重度是评价植物抗真菌病害的常用指标。本研究中内蒙早熟和宁夏彭阳的发病率、死亡率和病情严重度都显著高于其余材料,结合其他数据可以得出这两份材料属于感病材料。说明这些指标直接反映了幼苗对病原菌的抗性水平,并能够在温室及田间条件下植物抗真菌病害评价中广泛应用,如羽扇豆(Lupinusalbus)[33]、印度黄檀(Dalbergiasissoo)[25]及冬小麦(Triticumaestivum)[26]的抗病研究中都有广泛使用。
本研究中,种子在萌发时就与埃里砖格孢菌落接触,加速了侵染过程并提高了侵染强度,突出植株发病症状,使得研究结果真实可靠。本研究评价了10份沙打旺材料对埃里砖格孢的抗病性,初步筛选出抗病与感病材料,是今后温室、田间抗病评价的重要基础工作。另外,不同材料的幼苗抗病机理尚不明确,也是今后应予以重点研究的方向。
[1]苏盛发.沙打旺[M].北京:农业出版社,1985.
[2]伊虎英,鱼宏斌.辐射诱发超导早熟沙打旺的选育[J].草业科学,1989,6(3):18-21.
[3]甘肃畜牧厅.甘肃省牧草区划[M].北京:中国农业出版社,1991.
[4]聂素梅,孙启忠,闫志坚,等.影响沙打旺生长衰退因素试验研究[J].内蒙古草业,2002(3):36-38.
[5]Frame J.Astragalusadsurgens[A].In:Frame J.Forage Legumes for Temperate Grasslands[M].Rome,ltaly and Enfield,NH,USA:FAO and Science Publishers,2005:51-54.
[6]孙启忠,桂荣.科尔沁沙地沙打旺草地衰退规律与恢复技术研究[J].草地学报,2000,8(4):253-261.
[7]关秀琦,邹厚远,鲁子瑜,等.黄土高原草地生产持续发展研究Ⅰ.沙打旺人工草地衰退后的草种更替[J].水土保持研究,1994(3):56-60.
[8]芦满济,杜福成,杨志爱.冷温半干旱黄土丘陵区荒坡地沙打旺系统生态效能的调查研究[J].草业科学,1994,11(2):48-51.
[9]孙启忠,桂荣,那日苏,等.赤峰地区不同生长年限沙打旺生产力的研究[J].中国草地,1999(5):29-34.
[10]赵明轩.庆阳地区沙打旺病害调查报告[J].草与畜杂志,1995(1):33-34.
[11]尹亚丽,南志标,李春杰,等.沙打旺根部入侵真菌的研究[J].草原与草坪,2006(1):45-48.
[12]南志标.沙打旺种带真菌——环境,致病力及防治[J].草业学报,1998,7(1):12-18.
[13]Li Y Z,Nan Z B,Hou F J.The roles of anEmbellisiasp.causing yellow stunt and root rot ofAstragalusadsurgensand other fungi in the decline of legume pastures in northern China[J].Australasian Plant Pathology,2007,36:397-402.
[14]Li Y Z,Nan Z B.A new species ofEmbellisiacausing a disease of standing milk-vetch in China[J].Mycologia,2007,99(3):406-411.
[15]Li Y Z,Nan Z B.Symptoms and etiology of new disease,yellow stunt and root rot of standing milk-vetch in Northern China[J]. Mycopathologia,2007,163:327-334.
[16]Li Y Z,Nan Z B.Nutritional study onEmbellisiaastragali,a fungal pathogen of milk vetch (Astragalusadsurgens)[J].Antonie van Leeuwenhoek,2009,95:275-284.
[17]南志标.建立中国的牧草病害可持续管理体系[J].草业学报,2000,9(2):1-9.
[18]Chattopadhyay S,Ali K A,Doss S G,etal.Evaluation of mulberry germplasm for resistance to powdery mildew in the field and greenhouse[J].Journal of General Plant Pahtology,2010,7(6):87-93.
[19]王省芬,田海燕,马峙英,等.黄萎病菌诱导下陆地棉抗病品种SSH文库的构建[J].棉花学报,2008,2(1):3-8.
[20]王彦荣,孙建华,余玲,等.GB/T 2930.4-2001牧草种子检验规程发芽试验[S].北京:中国标准出版社,2001.
[21]方中达.植病研究方法[M].北京:中国农业出版社,1998.
[22]郑秀芳,李彩霞,周希豪,等.沙打旺种子萌发特性研究[J].种子,2007(6):43-45.
[23]李春杰,南志标.苜蓿种带真菌及其致病性测定[J].草业学报,2000,9(1):27-36.
[24]Graham J H,Devine T E,Hanson C H.Occurrence and interaction of three species ofColletotrichumon alfalfa in the mid-Atlantic United States[J].Phytopathology,1976,66:538-541.
[25]Harsh N S K,Chandra S,Uniyal K.Screening resistance ofDalbergiasissooclones againstGanodermalucidumroot rot disease in field conditions[J].Forest Pathology,2011,41:221-226.
[26]Peterson G L.Reaction of selected winter wheat cultivars from Europe and United States to Karnal bunt[J].European Journal of Plant Pathology,2009,125:497-507.
[27]李彦忠,南志标.埃里砖格孢属真菌的研究进展及展望[J].草业学报,2009,18(1):171-178.
[28]李彦忠.沙打旺(AstragalusadsurgensPall.)黄矮根腐病(Embellisiaastragalisp.nov.Li & Nan)的研究[D].兰州:兰州大学,2007.
[29]Matheussen A M,Morgan P W,Frederiksen R A.Implication of gibberellins in head smut (Sporisoriumreilianum) ofSorghumbicolor[J].Plant Physiology,1991,96:537-544.
[30]Daayf F,Nicole M,Boher B,etal.Early vascular defense reactions of cotton roots infected with a defoliating mutant strain ofVerticilliumdahliae[J].European Journal of Plant Pathology,1997,103(2):125-136.
[31]Bowers J H,Nameth S T,Riedel R M,etal.Infection and colonization of potato roots byVerticilliumdahliaeas affected byPratylenchuspenetransandP.crenatus[J].Phytopathology,1996,86(6):614-621.
[32]Linsell K J,Keiper F J,Forgan A,etal.New insights into the infection process ofRhynchosporiumsecalisin barley using GFP[J].Fungal Genetics and Biology,2011,48:124-131.
[33]Luckett D J,Cowley R B,Richards M F,etal.BreedingLupinusalbusfor resistance to the root pathogenPleiochaetasetosa[J].European Journal of Plant Pathology,2009,125:131-141.
