皮肤源祖细胞促进创面神经的修复☆
2011-04-19黄勇祁少海舒斌毛任翔谢举临徐盈斌刘旭盛
黄勇祁少海舒斌毛任翔谢举临徐盈斌刘旭盛
·论 著·
皮肤源祖细胞促进创面神经的修复☆
黄勇*祁少海△舒斌△毛任翔△谢举临△徐盈斌△刘旭盛△
目的 体内实验研究皮肤源祖细胞对皮肤创面神经修复的影响。方法 分离、培养昆明鼠皮肤源祖细胞,并用CM-DiI进行标记。将30只昆明鼠随机分为细胞移植组,单纯培养基组和空白组,通过尾静脉注射观察细胞在体内的迁移,检测创面的愈合率和PGP9.5的表达。结果 皮肤源祖细胞表达Fibronectin和Nestin;伤后第1、2周,皮肤源祖细胞逐渐迁移至皮肤全层,并在皮肤毛囊处亦可见;细胞移植组的创面愈合率分别为31.08%±1.74%,64.20%±1.45%明显高于单纯培养基组和空白组(23.85%±1.59%,49.81%±2.10%;22.63% ±1.02%,49.51%±1.10%);细胞移植组PGP9.5荧光密度(11.60±1.67,16.60±1.14)明显高于单纯培养基组和空白组(P<0.05)。结论 皮肤源祖细胞参与了创面愈合,同时促进了创面处的神经再生,有利于创面神经修复,可能成为修复神经损伤的种子细胞。
神经再生 创面 干细胞
机体组织的创伤或缺血往往伴随着神经的损伤。神经再生与创面修复同步进行,并在修复过程中起着重要作用。截瘫与糖尿病患者由于存在神经营养障碍,常常导致创面迁延不愈[1]。不仅如此,创面愈合后,由于缺乏皮下神经、神经末梢,患者常存在感觉过敏(如瘙痒),感觉迟钝等症状,严重影响了患者的生活质量[2]。近年来,应用干细胞修复周围神经损伤逐渐受到关注[3-4]。本实验中,通过制备鼠皮肤创面模型,观察静脉注射皮肤源祖细胞(skin-derived percursors,SKPs)体内迁移,及其对皮肤神经再生修复的影响。
1 材料与方法
1.1 实验动物 购自中山大学动物实验中心,出生1~3 d的SPF级昆明小鼠,及4~6周龄雄性昆明小鼠30只,购自中山大学动物实验中心,体质量25~30 g,适应性饲养2周后进行实验。
1.2 SKPs的培养、鉴定与标记 鼠SKPs的分离培养、鉴定见文献[5],并将第三代细胞置于含2%胎牛血清的DMEM/F12培养基中培养,观察细胞形态变化。
取第三代皮肤源祖细胞,胰酶消化2 min,含胎牛血清的培养基终止消化,吸管吹打、将细胞球团分离成单个细胞。以2 μg/mL CM-DiI标记液(美国Molecular Probes公司)37℃孵育5 min,再置入4℃冰箱孵育15 min,1500转/min离心5 min,弃去上清液,PBS漂洗3次,完成标记。用新鲜培养基(不含生长因子和血清)重悬,定容至细胞浓度为1×107~2.5×107个/mL,避光备用。
1.3 模型制作和分组 30只4~6周龄雄性昆明小鼠随机分为3组,细胞移植组,单纯培养基组和空白组。以10%水合氯醛(0.1 mL/20 g)腹腔注射麻醉,动物脱毛剂脱毛,背部制作1个直径大小为1.0 cm的圆形全层皮肤缺损创面。细胞移植组尾静脉注射CM-DiI标记的细胞,单纯培养基组尾静脉注射新鲜培养基,空白组为仅为创面。创面覆盖凡士林油纱、包扎、单笼饲养。分别于移植细胞后第1、2、4周处死小鼠,取全层创面标本均置于液氮中保存备用。
1.4 计算创面愈合率 制创后记录创面面积为原始创面面积,于取材时拓模记录各时相点创面面积为未愈创面面积。创面收缩率=(原始创面面积-未愈创面面积)/原始创面面积×100%,采用Image-Pro Plus 6.0软件 (美国Media Cybernetics公司)进行计算。
1.5 SKPs的迁移和免疫组织化学 以8 μm厚度冰冻切片,避光保存。观察前滴加DAPI(Sigma公司)染核,室温下孵育10 min,PBS漂洗10 min×3次,在荧光显微镜下观察SKPs在皮肤的迁移情况。
采用生物素标记的免疫荧光试剂盒检测表皮下及真皮层Protein Gene Production 9.5(PGP 9.5,abcam公司)的表达[2],以此反映皮肤神经再生情况。每个标本PGP 9.5荧光密度的评估方法为:每张切片在低倍镜下(10×10)找出表皮下及真皮层PGP 9.5高表达区,然后在高倍镜下(10×40)随机选取5个视野计算荧光光点个数,均数为该张切片表皮下及真皮层PGP 9.5荧光密度值。每个标本观察10张切片,均数为该标本表皮下及真皮层PGP 9.5荧光密度值。
1.6统计学方法 采用SPSS 11.0进行统计学分析,数据均以±s表示,单因素方差分析、方差齐性检验及样本均数两两比较的q检验(Newman-Keuls法),检验水准α=0.05。
2 结果
2.1 SKPs的体外培养 原代细胞培养3 d后,少部分细胞呈悬浮生长,其他细胞贴壁并逐渐死亡,悬浮细胞生长速度增快,形成克隆球团。克隆球团逐渐增大,一般含30~50个细胞。免疫荧光检测细胞表达巢蛋白、纤维连接蛋白。将第三代皮肤源祖细胞置于含2%胎牛血清的DMEM/F12培养基培养10 d后,克隆球团逐渐贴壁,部分细胞胞体伸出长突起,呈双极、多极及锥形,类似神经细胞形态;部分细胞胞内可见透亮圆形脂滴(图1)。荧光免疫细胞化学检测 SKPs表达 Fibronectin和Nestin。
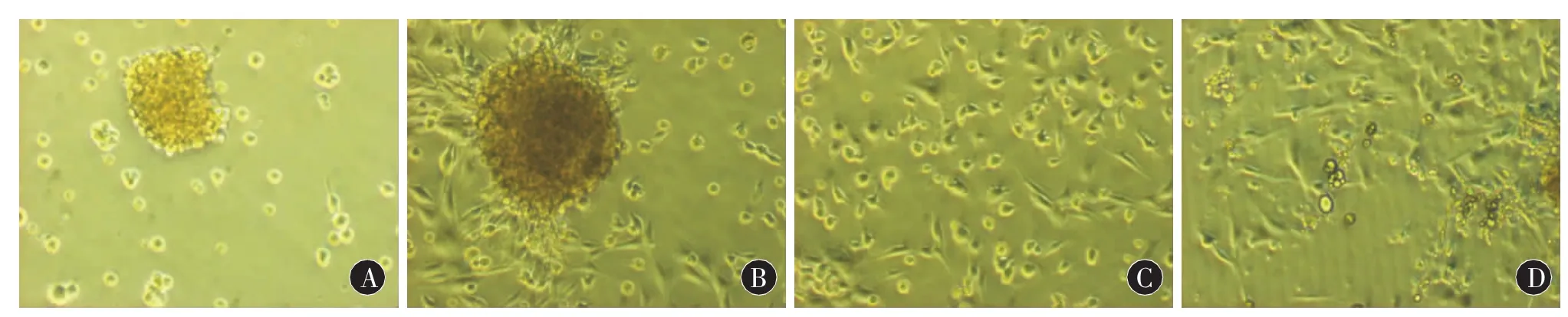
图1 A:第三代皮肤源祖细胞的形态学观察,倒置显微镜(100×);B:在含有2%胎牛血清的DMEM/F12培养基中培养,克隆球团贴壁,倒置显微镜(100×);C:培养10 d后,部分细胞似神经细胞形态,倒置显微镜(100×);D:培养10 d后,部分细胞胞体内有脂滴形成,倒置显微镜(100×)
表1 不同时间各组创面愈合率(%,±s)

表1 不同时间各组创面愈合率(%,±s)
1)与A组(细胞移植组)比较,单因素方差分析,P<0.05
组别细胞移植组单纯培养基组空白组1周2周31.08±1.74 23.85±1.591)22.63±1.021)64.20±1.45 49.81±2.101)49.51±1.101)
表2 不同时间各组PGP9.5表达(个,±s)

表2 不同时间各组PGP9.5表达(个,±s)
1)与A组(细胞移植组)比较,单因素方差分析,P<0.05
组别细胞移植组单纯培养基组空白组1周2周4周11.60±1.67 7.20±1.481)6.60±1.521)16.60±1.14 11.20±1.301)11.00±1.581)20.40±2.07 20.00±2.00 20.00±1.58

图2 A:尾静脉注射CM-DiI标记的SKPs,伤后第2周,SKPs分布在皮肤全层,毛囊处亦可见(荧光显微镜200×);B:细胞移植组中,伤后第1周PGP9.5的表达(荧光显微镜200×)
2.2 伤后创面愈合率 伤后1,2周,细胞移植组创面愈合率显著高于单纯培养基组、空白组 (P<0.05)(表1)。
2.3 细胞迁移及体内分化 在体外用CM-DiI标记皮肤源祖细胞,其标记率为100%。移植1周后,在背部创面处及其周边部位可见到CM-DiI标记皮肤源祖细胞,2周时细胞逐渐迁移至皮肤全层,在皮肤附属器毛囊处亦可见(图2A)。PGP9.5分布在表皮钉突及真皮层的毛囊鞘 (图2B),各组PGP9.5的荧光密度见表2。伤后1,2周,细胞移植组PGP9.5的表达明显高于单纯培养基组、空白组(P<0.05)。
3 讨论
皮肤作为人体最大的器官,是一个极其敏感的神经依赖性器官。因此,在其创伤修复调节过程中,神经因素占有重要地位,而且创面微血管的再生也与神经支配有关,血管与神经的再生、发育是相辅相成的。周围神经的修复贯穿创面愈合的整个过程[6-7]。有学者认为[2],周围神经的修复一方面由健存的神经轴突的延伸长入,另一方面可能由局部的干细胞增殖、分化而来,那么动员干细胞向神经组织分化,就有可能促进创面的神经再生修复,进而有利于促进创面愈合。
皮肤源祖细胞在2010年在皮肤真皮层分离出,表达Nestin同神经干细胞[3],而且Toma等[8]发现皮肤源祖细胞在含10%FBS的培养基中可分化成神经元细胞和神经胶质细胞。本课题组在SKPs的培养过程中加入了 3-叔丁基-4-羟基茴香醚(BHA)和二甲基亚砜(DMSO),成功将细胞定向分化为神经元细胞[5,9],并且在体内实验中发现SKPs参与了糖尿病鼠模型中的创面修复。但是在创面修复过程中,SKPs是否转化为神经细胞参与了周围神经的修复尚未可知。
通过尾静脉注射CM-DiI标记的SKPs,可以在伤后第1,2周被观察到迁移至创面处,并定位于表皮层与真皮层毛囊处。伤后第1,2周,细胞移植组的创面愈合率明显高于其他两组,因此再次实验证明了SKPs参与了创面修复。蛋白基因产物PGP9.5是一种神经细胞质蛋白,已广泛用于探索神经再生以重新支配靶器官的标记[10]。在实验中,细胞移植组可见在真皮毛囊鞘和表皮钉突处有PGP9.5表达,同相关研究结果相似[11],表明SKPs在创面处各种损伤信号的刺激下向周围神经细胞分化,抑或分泌了促神经再生的因子。
因此,在本实验中可以看出,皮肤源祖细胞与神经干细胞表达相似,但较其易于获得,分布广泛,在体内参与了创面的修复,其可能机制为除了直接参与表皮和真皮重建外,还可能参与了创面的神经修复,进而有利于促创面愈合信号的释放,提示皮肤源祖细胞可能成为治疗神经系统损伤的种子细胞。
[1] 付小兵.软组织创伤修复与再生研究的发展方向[J].创伤外科杂志,2004,(3):237-239.
[2] 祁少海,柯昌能,利天增,等.真皮源干细胞复合人血浆促进皮肤创面神经修复的实验研究[J].中华显微外科杂志,2006,(4):282-283.
[3] 邓全军,张建宁,王志涛,等.大鼠骨髓间充质干细胞神经分化潜能的体内外研究[J].中国神经精神疾病杂志,2008,(1):17-22.
[4]Choi BH,Zhu SJ,Kim BY,et al.Transplantation of culturedbone marrow stromal cells to improve peripheral nerve regeneration[J].Int J Oral Maxillofac Surg,2005,34(5):537-542.
[5] 钟聪,舒斌,祁少海,等.皮肤源祖细胞体外诱导神经元样细胞的实验研究[J].中华损伤与修复杂志(电子版),2010,(2):154-160.
[6] 程飚.神经支配与创面愈合[J].中国危重病急救医学,2004,(5):313-317.
[7]Vilches JJ,Ceballos D,Verdu E,et al.Changes in mouse sudomotor function and sweat gland innervation with ageing[J].Auton Neurosci,2002,95(1-2):80-87.
[8]Toma JG,Akhavan M,Fernandes KJ,et al.Isolation of multipotent adult stem cells from the dermis of mammalian skin[J].Nat Cell Biol,2001,3(9):778-784.
[9] 舒斌,祁少海,黄勇,等.皮肤源祖细胞的培养、鉴定和体外诱导分化[J].中华实验外科杂志,2007,24(10):1181-1182,1281.
[10]Verdu E,Navarro X.Comparison of immunohistochemical and functional reinnervation of skin and muscle after peripheral nerve injury[J].Exp Neurol,1997,146(1):187-198.
[11]Ohsawa T.Neuron-specific PGP9.5 expression in rat hair follicle development and cycle[J].J Dermatol Sci,2001,26(2):100-105.
(责任编辑:李 立)
In vivo study on the effect of Skin-derived precursors(SKPs) on neural repair in skin wounds.
HUANGYong,Qi Shao-hai,SHU Bin,MAO Ren-xiang,XIE Ju-lin,XU Ying-bin,LIU Xu-sheng Department of emergency and burns,the First Affiliated Hospital,Sun Yat-sen University,Guangzhou 510080,China.Tel:020-87755766.
Objective To study the effect of Skin-derived precursors(SKPs)on neural repair in skin wounds in vivo.Methods SKPs were isolated,cultured and identified in vitro and were then labeled with CM-DiI.Thirty Kunming mice were divided into 3 groups randomly:cell transplantation,culture media and control groups.The labeled cells were injected to mice in cell transplantation group through vena caudalis.Cell migration,wound healing rate,and the expression of PGP9.5 were detected at 1,2,4 weeks post skin wound.Results Fibronectin and Nestin expression was detected in SKP2.At 1, 2 post wound weeks, SKPs gradually migrated to whole layer of skin including the papillae of hair and whisker follicles.The wound healing rates in cell transplantation group were 31.08%±1.74%and 64.20%±1.45%,which were higher than those in other groups(23.85%±1.59%,49.81%±2.10%;22.63%±1.02%,49.51%±1.10%),and the fluorescence densities of PGP9.5 were also higher in cell transplantation group than in other groups(P<0.05).Conclusions SKPs are involved in skin wound healing,and promote nerve regeneration,which may become the seed cells for repairing nerve damage.
Neural regeneration Wound Stem cell
R651.3
A
2011-03-14)
☆ 广东省科技计划项目(编号:2010B031100008);创伤、烧伤与复合伤国家实验室开放基金(编号:SKLKF200808);广东省自然科学基金博士科研启动项目(编号:8451008901000894)
* 中山大学附属第一医院急诊外科(广州 510080)
△ 中山大学附属第一医院烧伤外科
(E-mail:knowledgeslave@yahoo.com.cn)
