负载hTERTC27基因的树突状细胞对胶质瘤细胞的杀伤效应☆
2011-04-19龚汉贤何蕾黎祥喷李艺彭英
龚汉贤何蕾黎祥喷李艺彭英
·论 著·
负载hTERTC27基因的树突状细胞对胶质瘤细胞的杀伤效应☆
龚汉贤*何蕾*黎祥喷*李艺*彭英*
目的 探讨负载hTERTC27基因的树突状细胞(dendritic cells,DCs)治疗胶质瘤的可行性。方法利用重组腺病毒(recombinant adenovirus,Adv)将hTERTC27基因转染到DCs,Western blot杂交鉴定hTERTC27蛋白的表达。实验分为3组:hTERTC27转染的DCs,单纯强化绿荧光蛋白(EGFP)转染的DCs和单纯的DCs。CCK8法检测各组DCs对淋巴细胞的增殖作用及诱导的细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTL)对胶质瘤细胞U87的杀伤活性,ELISA法检测T细胞上清中白介素-2(IL-2)和 干扰素-γ(IFN-γ)的表达。结果hTERTC27转染的DCs组对T细胞的增殖作用以及T细胞上清IL-2、IFN-γ的浓度均高于其余两组,当效靶比为40∶1时,这组T细胞对U87的杀伤率(50.4%±2.95%),也明显高于EGFP转染DCs组(38.0%±1.81%)以及单纯DCs组(33.7%±2.03%)(P=0.001)。结论 hTERTC27基因转染的DCs能诱导CTL反应,对端粒酶阳性的U87具有显著的杀伤效应。
树突状细胞 胶质瘤 hTERTC27 细胞毒性T淋巴细胞
端粒酶与细胞的衰老和永生化密切相关,它的激活对肿瘤的发生、发展起着重要作用[1]。端粒酶逆转录酶(TERT)是端粒酶的一个催化亚单位,在调控端粒酶活性中最具有特异性,被认为是理想的肿瘤相关抗原(TAA)[2]。hTERTC27(C27)是一个27 kD的人端粒酶逆转录酶C-末端多肽。树突状细胞(dendritic cells,DCs)是功能最强大的抗原呈递细胞,在抗肿瘤免疫反应中发挥至关重要的枢纽作用[3]。本实验利用腺病毒把hTERTC27的基因转染到DCs上,观察其在体外能否刺激T细胞的增殖和诱导细胞毒性T细胞(CTL)的活性,初步探讨其诱导的抗肿瘤机制,为临床应用提供实验依据。
1 材料与方法
1.1 研究对象 SPF级C57BL/6小鼠20只,体质量(20±2)g,购自中山大学中山医学院实验动物中心。胶质瘤细胞U87购自中科院上海细胞库。胎牛血清购自Gibco公司,重组小鼠GM-CSF和重组小鼠IL-4购自R&D公司,PE标记抗小鼠CD80、CD86、MHC-Ⅱ单抗购自Biosciences公司,脂多糖(LPS)购自Sigma公司,CCK8购自Dojindo公司。
1.2 培养与纯化小鼠骨髓来源的DCs 无菌剥离C57BL/6小鼠的股骨和胫骨,剪至红骨髓。将骨髓冲至筛网中,过滤离心,弃上清后加红细胞裂解液,裂解5 min,加入RPMI-1640离心,细胞沉淀加入RPMI-1640完全培养基(含10%胎牛血清),接种至6孔培养板,加入10 ng/mL的rmGM-CSF、5 ng/mL的rmIL-4。第3 d换含相同浓度细胞因子的完全培养液。至第5 d半量换液并补足细胞因子。至第6 d与200 ng/mL LPS共培养24 h后,轻轻吹打收集所有的悬浮细胞。
1.3 流式细胞仪检测DCs表型 收集培养至第7 d的 DCs,调整细胞密度为1×106/mL,按试剂说明书加入PE标记的抗小鼠单克隆抗体CD80、CD86和MHC-Ⅱ,设立空白对照,4℃避光反应30 min,PBS洗两次,流式细胞检测仪检测。
1.4 利用重组腺病毒转染基因 6孔板中加入1× 106/mL的DCs,分别加入感染复数(MOI)=200的病毒液AdvC27-EFGP和Adv-EGFP,每组3个复孔,37℃的培养箱中培养48 h,荧光显微镜下观察结果。
1.5 Western blot分析hTERTC27蛋白表达 按感染复数(MOI)=200的浓度加入Adv-hTERTC27-EGFP(AdvC27-EGFP),Adv-EGFP至DCs中,提取转染48 h的DCs细胞蛋白,经10%的SDS-聚丙烯酰胺不连续分离胶(SDS-PAGE)电泳后,移至硝酸纤维素膜,用含5%脱脂奶粉的TBST封闭1 h,与兔抗的hTERT抗体4℃孵育过夜,TBST洗3次,与Peroxidase标记的兔抗IgG室温下作用1 h,TBST洗3次用ECL发光液作用45 min,X线胶片曝光显影。
1.6 同种异体混合淋巴细胞反应(MLR)检测T细胞的增殖情况 将C57BL/6小鼠脾脏分离出来,制备成单细胞悬液,用Ficoll分离液分离出单个核细胞,将单个核细胞悬液过尼龙毛柱获取纯化的T淋巴细胞[4]。将浓度为1×105/mL AdvC27-EGFP-DCs、Adv-EGFP-DCs和单纯的DCs(n=3)接种到96孔板中,作为刺激细胞(S);将同种异体 T细胞作为反应细胞(R),使刺激细胞:反应细胞(S∶R)为1∶40、1∶20、1∶10和1∶5,每组3个复孔。培养3 d,在培养结束前6 h每孔加入20 μL的CCK8,于酶标仪450 nm处读取吸光度值。
1.7CCK8法检测CTL的杀伤活性 利用DMEM培养液(内含10%的胎牛血清)里,于37℃、含5% CO2的培养箱中培养胶质瘤细胞U87。收集该细胞按每孔1×104个细胞的密度接种于96孔板中,作为靶细胞,以分别转染了AdvC27-EGFP、Adv-EGFP的DCs及DCs共同培养24 h的T细胞作为效应细胞,效靶比为5∶1、20∶1和40∶1,另外设只有靶细胞和只有效应细胞的对照,每组 3个复孔,共培养 48 h,用CCK8法检测各组在波长450 nm下吸光度值。按下式计算CTL的杀伤活性杀伤率=[1-(效靶孔值-效应孔值)/靶细胞孔值]×100%
1.8 转基因淋巴细胞分泌细胞因子的检测 将浓度为1×105/mL转染了AdvC27-EGFP、Adv-EGFP的DCs和单纯的DCs接种到96孔板中,作为刺激细胞,按刺激细胞:反应细胞(S:R)为1∶10加入淋巴细胞,每组3个复孔,培养 3 d,收集各孔上清,检测IL-2和IFN-γ的含量,具体步骤按ELISA试剂盒说明书进行。
2 结果
2.1 DCs的分离、培养及鉴定 成功培养出成熟的小鼠骨髓来源的DCs。培养至第7 d,大量细胞悬浮起来,部分聚集成团生长,集落分散。悬浮的细胞体积较大,形态不规则,有大小不等的毛刺状、星状或者树突状的突起。见图1。
2.2 DCs表型检测鉴定 流式细胞仪检测显示加入 LPS刺激后的 DCs表面标志 CD80、CD86和MHC-Ⅱ均高表达,阳性率分别为87.3%,88.8%和93.8%,表明我们成功培养出成熟的DCs。见图2。
2.3 重组腺病毒作为载体转染基因 分别加入感染复数(MOI)=200的病毒液rAd-C27和rAd-EGFP,37℃的培养箱中培养48 h,荧光显微镜下可观察到两组的DCs细胞均有大量的绿色荧光蛋白的表达。rAd-C27组表达率约为70%,而rAd-EGFP组的表达率约为75%(图3)。
2.4 hTERTC27蛋白的鉴定 Western blot鉴定中,仅 AdvC27-EGFP转染的 DCs可以检测到hTERTC27蛋白表达;而转染Adv-EGFP和空白对照的DCs,均未能检测到hTERTC27蛋白存在,提示hTERTC27基因转染成功(图4)。
2.5 转染的DCs刺激同种异体增殖能力的检测
在同种异体混合淋巴细胞反应(MLR)中,随着刺激细胞/反应细胞 (S/R)比值的增大,AdvC27-EGFP DCs组的T细胞增殖明显增多,而Adv-EGFP DCs组及DC组的T细胞增殖活性不明显。当S/R≥1∶10时,AdvC27-EGFP DCs与其余两组相比,具有更强的刺激T淋巴细胞增殖的能力(P<0.01),而Adv-EGFP DCs组及DC组相比差异亦无统计学意义(P>0.05),见表1。
2.6 CTL对U87细胞的特异性杀伤活性 随着效靶比的增高,三组CTL的杀伤率均有增高,但AdvC27-EGFP DCs组的杀伤率增高的趋势更加明显。当效靶比为40∶1时,AdvC27-EGFP DCs组的杀伤率为(50.38%±2.95%),明显高于Adv-EGFP DCs组(38.32%±2.21%)和 DC组(35.7%±2.03%)(P=0.001)。见表2。
2.7 T细胞上清IL-2和IFN-γ的浓度 AdvC27-EGFP DCs组中T细胞上清IL-2和IFN-γ的 浓度较高,IL-2:(75.54±5.32)pg/mL,IFN-γ:(60.86± 2.61)pg/mL;Adv-EGFP DCs组中 IL-2:(51.83± 1.39)pg/mL,IFN-γ:(15.10±1.36)pg/mL。DCs组中 IL-2:(57.23±6.30)pg/mL,IFN-γ:(16.33± 0.29)pg/mL。可见,AdvC27-EGFP DCs组的 IL-2和IFN-γ的浓度均高于其余两组(P<0.01),见表3。

图1 倒置显微镜下观察小鼠骨髓来源的DCs(×200)
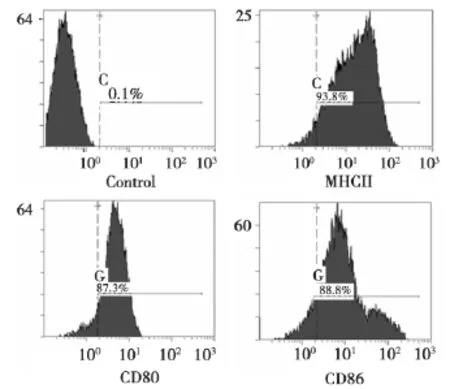
图2 小鼠骨髓来源的DCs表面标志物

图3 EGFP蛋白在DCs细胞的表达。A为AdvC27-EGFP DCs转染的DCs;B为Adv-EGFP转染的DCs。左图为荧光显微镜下图像,右图为倒置显微镜下图像。

图4 western blot测定各组DCs中hTERTC27蛋白的表达。
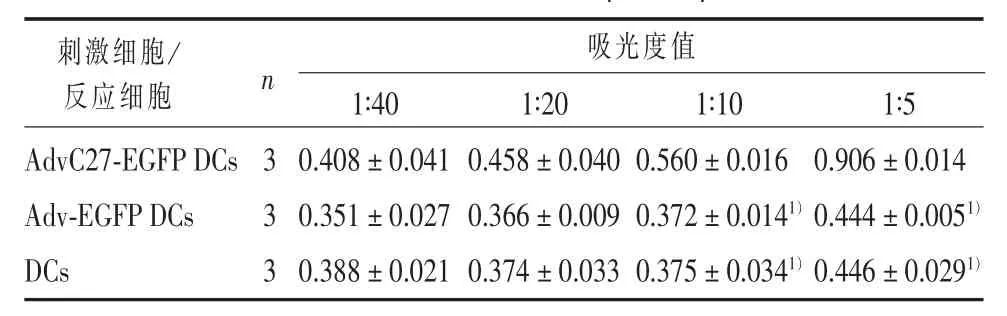
表1 同种异体混合淋巴细胞反应(MLR)中的刺激作用

表2 不同效靶比T细胞对靶细胞的CTL杀伤活性

表3 T细胞上清中IL-2和IFN-γ的浓度比较
3 讨论
近几年,以肿瘤抗原作为靶点的肿瘤疫苗吸引了越来越多的注意,因为相对其他非手术途径,它具有更高的特异性和更少的毒性。肿瘤疫苗可以分为肽/蛋白疫苗、肿瘤细胞疫苗、DNA疫苗、重组病毒疫苗和DCs疫苗。其中DCs疫苗具有明显的优势,因为它能呈递抗原肽或者DNA编码的抗原,刺激免疫细胞,触发免疫反应。在本实验中,我们发现AdvC27-EGFP-DCs不仅能够促进T细胞增殖,而且能引发CTL溶解肿瘤细胞。但是,有报道称[5],在小鼠体内AAV-/Adv-hTERTC27病毒鸡尾酒仅能引起NK细胞反应,而不能刺激T细胞的反应。这结论与本实验结果明显不相符合。我们猜测这是因为:AAV-/Adv-hTERTC27内包含的抗原过少,不足以引发细胞免疫反应;本实验中的DCs能摄取、加工并呈递抗原,从而增强抗原引起的免疫作用。Nestle等[6]报道,在临床实验中负载肿瘤相关肽或者肿瘤裂解物的DCs能够促发人体免疫反应,抑制肿瘤生长。可是单独的黑色素瘤抗原,没有DCs,就不能引起具有统计意义的临床反应。由此可见,DCs能够减少或者避免肿瘤细胞的免疫逃避,DCs疫苗是肿瘤免疫治疗的理想途径之一。
人端粒酶逆转录酶(hTERT)可作为广泛的肿瘤相关抗原,是肿瘤治疗理想靶点。V hTERT蛋白包含1032个氨基酸,经过不断地分析,已经筛选出很多种可能的抗原肽[7]。hTERTC27,作为hTERT的C末端 27 kD的多肽,p973和 p988是目前确定里面包含的抗原肽[8]。这两种抗原肽在体内外均可以诱导CD8+T淋巴细胞杀伤hTERT+的肿瘤细胞[9]。这也是本实验中观察到AdvC27-EGFP-DCs引起的CTL明显高于其他组的重要原因。
细胞因子是细胞间信号肽的大家族的成员,能够调节肿瘤的免疫反应,在肿瘤治疗中起重要的作用。IL-2能够提高细胞毒性T淋巴细胞和NK细胞溶解细胞的能力,提高基因的表达从而翻译出具有细胞毒性的颗粒成分,如穿孔素和颗粒蛋白酶[10]。IFN-γ是细胞免疫的主要影响因子之一,它既能诱导CTL和辅助性T淋巴细胞的分化,又能提高MHC-I和MHC-II的表达,促进抗原呈递给淋巴细胞[11]。本实验,AdvC27-EGFP-DCs组中T淋巴细胞上清的IL-2和IFN-γ明显增多,这可能也是实验组能够促进CTL杀伤肿瘤细胞的重要原因之一。
[1]Souiden Y,Bouraoui A,Chaieb K,et al.Telomeres and telomerase as targeted therapies in cancer treatment[J].Bull Cancer,2010,97(9):1087-1104.
[2]Liu JP,Chen W,Schwarer AP,et al.Telomerase in cancer immunotherapy[J].Biochim Biophys Acta,2010,1805(1):35-42.
[3]Tuettenberg A,Becker C,Correll A,et al.Immune regulation by dendritic cells and T cells——basic science,diagnostic,and clinical application[J].Clin Lab,2011,57(1-2):1-12.
[4] 李春晖,焦保华.骨髓基质干细胞对脑胶质瘤大鼠的免疫调节作用[J].中国神经精神疾病杂志,2007,33(7):408-411.
[5]Huo L,Yao H,Wang X,et al.Inhibition of melanoma growth by subcutaneous administration of hTERTC27 viral cocktail in C57BL/6 mice[J].PLoS One,2010,5(9):e12705.
[6]Nestle FO,Alijagic S,Gilliet M,et al.Vaccination of melanoma patients with peptide-or tumor lysate-pulsed dendritic cells[J].Nat Med,1998,4(3):328-332.
[7]Beatty GL.Vonderheide RH.Telomerase as a universal tumor antigen for cancer vaccines[J].Expert Rev Vaccines,2008,7(7):881-887.
[8]Huo LF,Tang JW,Huang JJ,et al.Cancer immunotherapy targeting the telomerase reverse transcriptase[J].Cell Mol Immunol,2006,3(1):1-11.
[9]Carpenter EL,Vonderheide RH.Telomerase-based immunotherapy of cancer[J].Expert Opin Biol Ther,2006,6(10):1031-1039.
[10]Antony GK,Dudek AZ.Interleukin 2 in cancer therapy[J].Curr Med Chem,2010,17(29):3297-302.
[11]Browne SK,Holland SM.Immunodeficiency secondary to anticytokine autoantibodies[J].Curr Opin Allergy Clin Immunol,2010,10(6):534-41.
The killing effect induced by dendritic cells transduced with hTERTC27 gene on Glioblastoma Cells.
GONG Hanxian,HE Lei,LI Xiangpen,LI Yi,PENG Ying.Department of Neurology,the Sun Yat-Sen Memorial Hospital,Sun Yat-Sen University,Guangzhou 510120,China.Tel:020-81332833.
Objective To explore the feasibility oftreatment with dendritic cells(DCs)transduced with hTERTC27 for glioma. Methods hTERTC27 gene was transduced to the DCs by recombinant adenovirus and hTERTC27 protein was detected using western blot.The DCs were divided into 3 groups: hTERTC27-transfected DCs,EGFP-transfected DCs and DCs only.T cells proliferation and cytotoxic T lymphocytes(CTL)response to U87 cells induced by DCs were detected in each group using CCK8.The concentration of interleukin-2(IL-2)and interferon-γ(IFN-γ)in the supernatants of T cells were detected by using ELISA.Results T cell proliferation and the concentration of IL-2 and IFN-γ were higher in the hTERTC27-transfected DCs than in the other groups.The cytotoxic rate against U87 in the hTERTC27-transfected DCs was(50.4%±2.95%)at the ratio of effect/target cells of 40∶1,which was much higher compared with EGFP-transfected DCs group(38.0%±1.81%)and the DCs only group(33.7%±2.03%)(P=0.001). Conclusions hTERTC27 gene-transduced DCs can induce CTL response and has strong killing effect on hTERT+U87 cells.
Dendritic cells Glioma hTERTC27 CTL
R741.05
A
2011-03-10)
(责任编辑:甘章平)
☆ 国家“863”计划项目 (编号:2007AA021101)
* 中山大学孙逸仙纪念医院神经内科(广州 510120)
(E-mail:docpengy@yahoo.com.cn)
