粗榧的抗寒性研究
2011-04-19王箭
王箭
(北京东方园林股份有限公司,北京071000)
1 引言
低温对植物的危害是一个世界性的问题,不仅会限制植物的栽种范围,也会造成植物的冻伤或冻害,是我国园林中的重要自然灾害之一,也是园林绿化引种的一个重要障碍。自20世纪末引起人们注意后,国内外许多学者从细胞和分子生物学水平对植物的抗寒性进行了研究,并取得了一些重大进展。生物膜的结构动态变化是研究抗寒机理的重要问题,早在1912年,M aximov就认识到,膜与植物抗寒性关系的重要性,并提出质膜发生部位,膜的性质、结构和相变可能是寒害的原初反映的重要指标,Lyons(1973)认为植物遭受零上低温伤害时,只要温度降到某一域值,生物膜首先发生物相变化,膜脂从液晶相转变为凝胶相,膜脂上的脂肪酸链由无序排列变为有序排列,膜的外形和厚度发生变化,膜上可能产生孔道或龟裂,因而膜的透性增大,膜内离子和基质失去平衡,膜结合酶的活性发生改变,进一步引起膜结合酶和游离酶反应速度失去平衡。由于以上一系列的变化,使物质代谢失调和有毒物质如己醇、己醛、r-酮酸、酚、绿原酸等在组织内积累,当寒害使膜降解时,便产生组织受害或死亡,如果尚未达到降解的程度,当温度恢复正常时,植物可以逐步恢复正常,不会受害死亡,可见,膜脂发生相变是园林植物造成冷害的最原初反应,由此引发膜结构的改变,膜流动性变小,代谢紊乱等一系列生理生化问题。
粗榧为红豆杉科榧树属,常绿灌木或小乔木,高达12m,树皮灰色或灰褐色,树形优美,产于长江流域及以南地区,多生于海拔 600~2 200m的花岗岩、砂岩或石灰岩山地;是我国特有树种,在我国南方有广泛的园林应用,但在北方应用较少。低温是限制粗榧在北方园林应用的主要因子之一,在苗木引种过程中发现,北方冬季的低温可对粗榧造成明显伤害,导致枝条枯死,难以形成应有的园林景观。本实验对低温胁迫下的粗榧进行细胞膜透性的测定、细胞保护酶活性与丙二醛(MDA)的测定、蛋白质的测定,以期对粗榧在生物膜的结构动态变化方面与其抗寒性的关系进行研究,进而为其在城市园林绿化中的应用提供理论依据。
2 材料与方法
2.1 研究方法和指标测定
2.1.1 冷冻处理
供试材料为粗榧一年生枝条,采自保定市易县清西陵林场。试验共设7个处理,每个处理3次重复[1]。
在2月下旬采集粗细一致的枝条,用蒸馏水洗净,剪成15cm长的枝段,用蒸馏水洗净后分7组装入聚乙烯膜中,置于超低温冰柜中进行人工冷冻处理,第1批每处理冷冻12h后取出进行指标测定,第2批每处理冷冻24h后取出进行指标测定。共设0℃、-10℃、-15℃、-20℃、-25℃、-27℃、-30℃7个温度梯度[2]。
2.1.2 细胞膜透性的测定
将冷冻后的枝条剪成2cm小段(避开芽眼)混合均匀,再用无离子水洗3遍,用吸水纸吸干后放入电子天平称量,再放入三角瓶,按每克材料加10m L无离子水,真空渗入10min。静置16h,再用 DDSIIA型电导仪测定电导值,再将三角瓶封口,在98℃恒温水浴煮1h,取出静置14h,再测定总电导值[4]。以相对电导率表示细胞膜透性大小。
2.1.3 细胞保护酶活性与丙二醛(MDA)的测定
(1)酶液提取:取经冷冻处理后的植物枝条,用刀片刮下皮,称取0.5g剪碎,置于冰浴的研钵中,加1m L、50mmol/L、pH 7.8的磷酸缓冲液及少量石英砂,在冰浴环境下充分研磨至无粗纤维为止。倒入离心管中,转移过程中用4m L、pH 7.8磷酸缓冲液洗净研钵并入离心管。匀浆于4℃10 000r/min离心15min,上清液即为酶提取液。离心完后将上清液倒出。此酶液用于SOD、POD、MDA的测定。
(2)SOD活性测定[3]。采用 NBT光化还原法[5],于4m LSOD反应液中加 100μLl酶提取液、100μL核黄素,立即置于4 000 lux荧光灯下进行光还原反应,15min后用黑纸遮光,终止反应。另作一组不加酶液其他处理同前作为对照,以pH值为7.8磷酸缓冲液调零点,在 7200分光光度计上于560nm波长下比色测其OD值。
(3)POD活性测定[3]。采用愈创木酚法[6],于3m LPOD反应体系中含2.91m L、10mmol/L磷酸缓冲液,50μL20mm ol/L愈创木酚,20μL酶液及20μL40mmol/L双氧水。于小试管中充分混合,在34℃恒温水浴中反应10m in。后加20μL20%三氯乙酸(TCA)终止酶活性。以pH值为7.0磷酸缓冲液调零点,在470nm波长下测其光密度。
(4)MDA含量测定[3]:采用 TBA法[7]。于试管中加入2.5m L0.5%TBA,1m l酶提取液,沸水浴30m in,冷却后在 4 000/min离心 10min,测其532nm、600nm波长的消光值,以pH值为7.8磷酸缓冲液调零点。
2.2.4 蛋白质的测定
取酶提取液0.1m L放入试管中,加入5m L考马斯亮蓝G-250试剂,充分混合,放置2min后在595nm比色,记录吸光度值,并通过标准曲线查得蛋白质含量。
2.2 实验结果分析
2.2.1 冷冻处理对细胞膜透性的影响
细胞膜是细胞感受环境胁迫最敏感的部位,低温冻害可破坏细胞膜结构,引起细胞膜透性变化。通过测定电导值的变化,可反映出所测材料的细胞膜伤害程度,进而判断植物抗寒性的大小[4]。由图1、2可以看出,枝叶的相对电导率随温度降低而提高。冷冻处理12h后,在-27℃时,相对电导率为60%。冷冻处理24h后,在-27℃时,相对电导率为65%,说明-27℃时其细胞膜已受到严重损伤。一般认为,电解质渗出率(即相对电导率)达到50%时的温度为组织的半致死温度(LT50)[8]。本实验在枝条经24h冷冻处理后,在-27℃时,相对电导率高于50%,说明粗榧的半致死温度为-27℃。
2.2.2 冷冻处理对细胞保护酶活性的影响
(1)SOD酶活性的变化。冷冻处理后植物枝条SOD酶活性的变化如图3、4所示。结果表明,经过12h冷冻处理后,植物树皮SOD酶活性呈现出先下降,然后上升,再下降,此后又上升的趋势,而树叶呈现的是先上升后下降的趋势,最大值均出现在-20℃,最小值均出现在-27℃;经过24h冷冻处理后,植物树皮SOD酶活性呈现出先上升,然后下降,此后再上升的趋势,树叶则依然是先上升后下降,最大值均出现在-20℃,最小值均出现在-27℃。-27℃的低温显著提高了植物枝条的SOD酶活性,而SOD酶活性的提高可减轻低温伤害,这表明粗榧可通过提高SOD酶活性来避免低温伤害[5]。
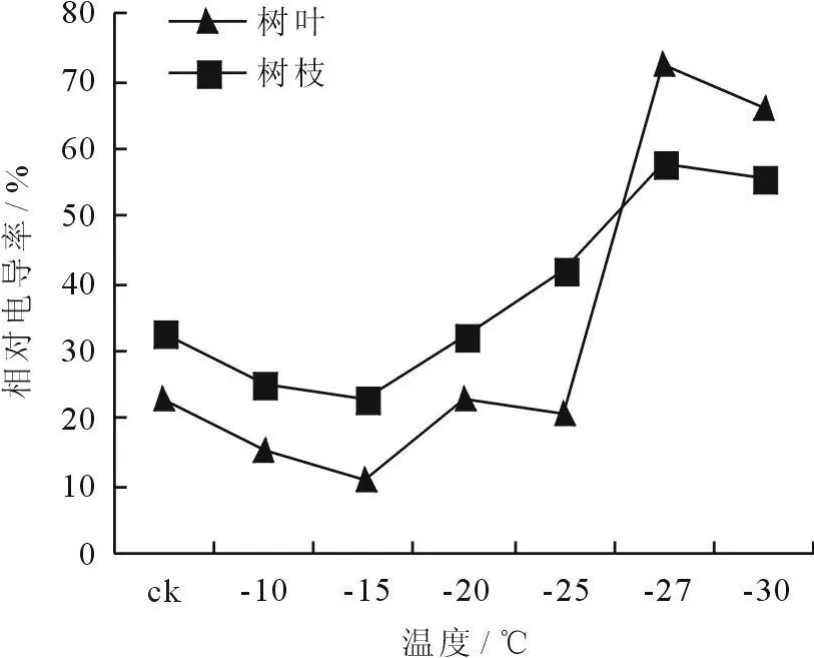
图1 冷冻处理12h后枝条相对电导率的变化
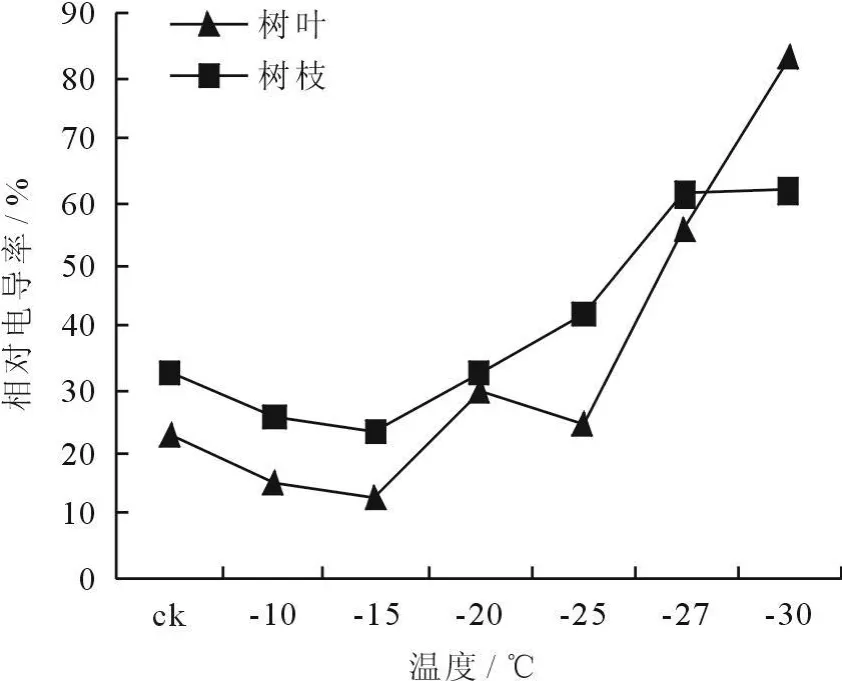
图2 冷冻处理24h后枝条相对电导率的变化

图3 冷冻处理12h后枝条SOD酶活性的变化
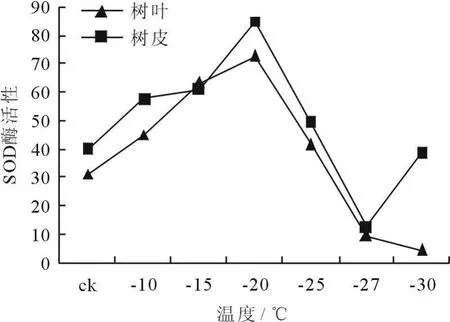
图4 冷冻处理24h后枝条SOD酶活性的变化
(2)POD酶活性的变化。冷冻处理后植物枝条POD酶活性的变化如图5、6所示。结果表明,经过12h冷冻处理后,植物树皮POD酶活性呈现先升后降的趋势,最大值出现在-25℃,而树叶则呈现先上升后下降然后再上升的趋势,最小值出现在-25℃;经过24h冷冻处理后,树皮的POD酶活性呈现先升后降的趋势,最大值出现在-20℃,树叶的变化趋势则是先降后升然后再降,最大值出现在-25℃。POD是植物对膜脂过氧化的酶促防御系统中的重要保护酶,在冷冻处理初期,POD酶活性的上升可能是植物细胞对低温胁迫因子的一种保护性应激反应。随着冷冻处理温度的降低,POD酶活性下降,表明冷冻对酶产生伤害,从而加剧了膜脂过氧化作用。

图5 冷冻处理12h后枝条POD酶活性的变化
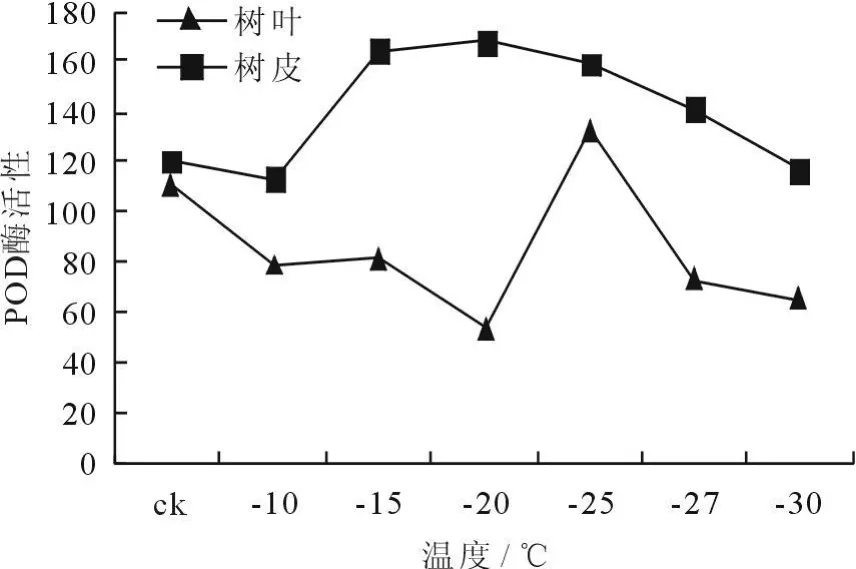
图6 冷冻处理24h后枝条POD酶活性的变化
2.2.3 冷冻处理对MDA含量的影响
冷冻处理后植物枝条MDA含量的变化如图7、8所示。从图7看出,树皮经12h冷冻处理后,MDA含量呈现先上升后下降,再上升再下降的趋势,而树叶的MDA含量呈现出先下降后上升再下降的趋势。MDA是膜脂过氧化作用的终产物,也是反映细胞膜系统受害的重要指标之一,因此,冷冻处理后植物枝条内MDA含量增加,表明低温伤害致使细胞膜脂过氧化作用增强,细胞膜系统受害加重[6]。而枝条在-25~-30℃之间,MDA含量有所下降,这可能是植物对低温环境暂时适应的结果。从图8看出,树皮和树叶经24h冷冻处理后,MDA含量均呈现出先上升,然后下降,此后又先上升后下降的趋势,表明植物在冷冻处理的初始阶段细胞膜系统受害严重,随着温度的降低,枝条对低温环境产生了抗逆性,MDA含量降低,细胞膜系统受害减弱。
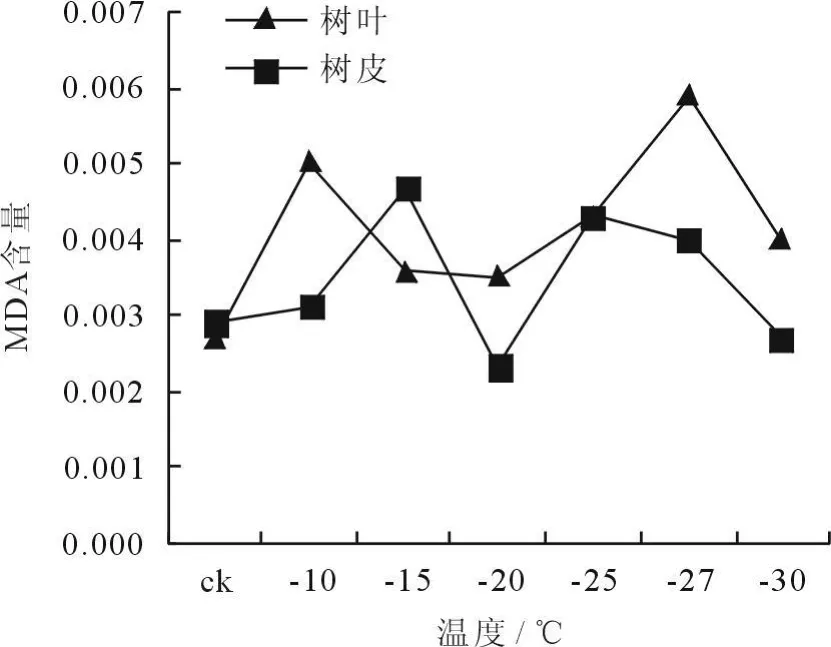
图7 冷冻处理12h后枝条MDA含量的变化
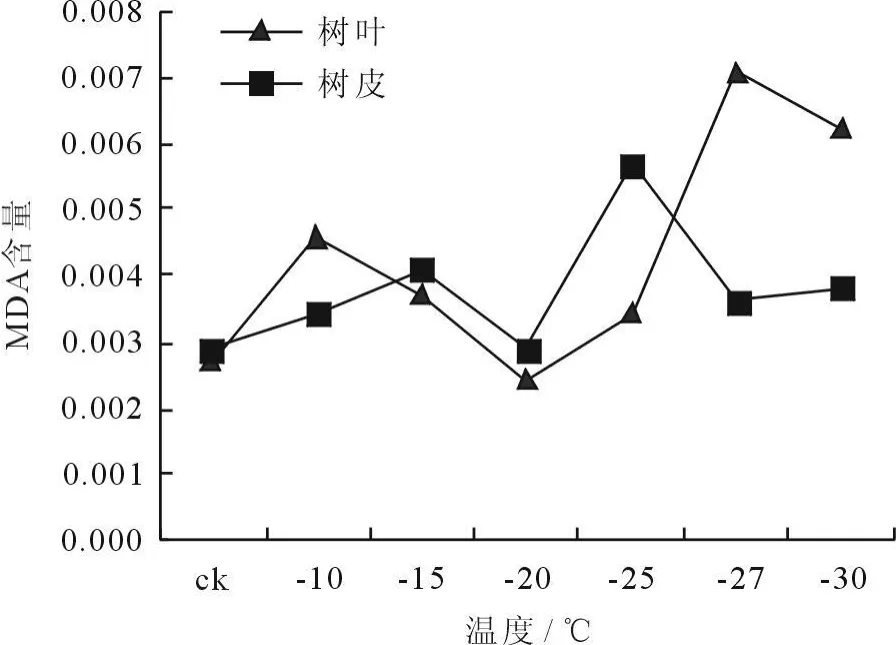
图8 冷冻处理24h后枝条MDA含量的变化
2.2.4 冷冻处理对蛋白质含量的影响
冷冻处理后植物枝条蛋白质含量的变化如图9、10所示。从图9看出,树皮经12h冷冻处理后,蛋白质含量呈现出开始时基本没有变化然后上升的趋势,树叶则呈现出先平稳然后先升后降的趋势。蛋白质含量的多少也是反映细胞膜系统受害的重要指标之一,因此,冷冻处理后植物枝条内蛋白质含量增加,细胞膜系统受害加重。从图10看出,树叶和树皮经24h冷冻处理后,蛋白质含量均呈现出先上升,然后下降,此后又上升的趋势,表明植物在冷冻处理的初始阶段细胞膜系统受害严重,随着温度的降低,枝条对低温环境产生了抗逆性,蛋白质含量降低,细胞膜系统受害减弱。
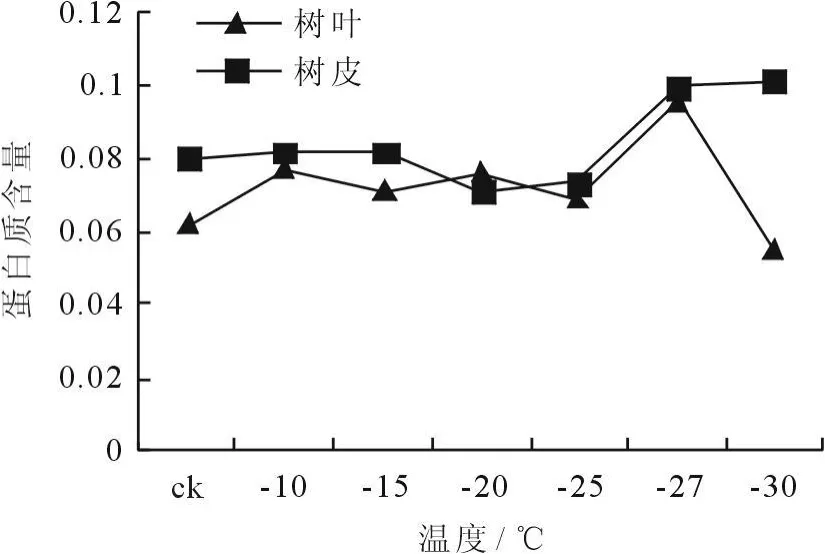
图9 冷冻处理12h后枝条蛋白质含量的变化
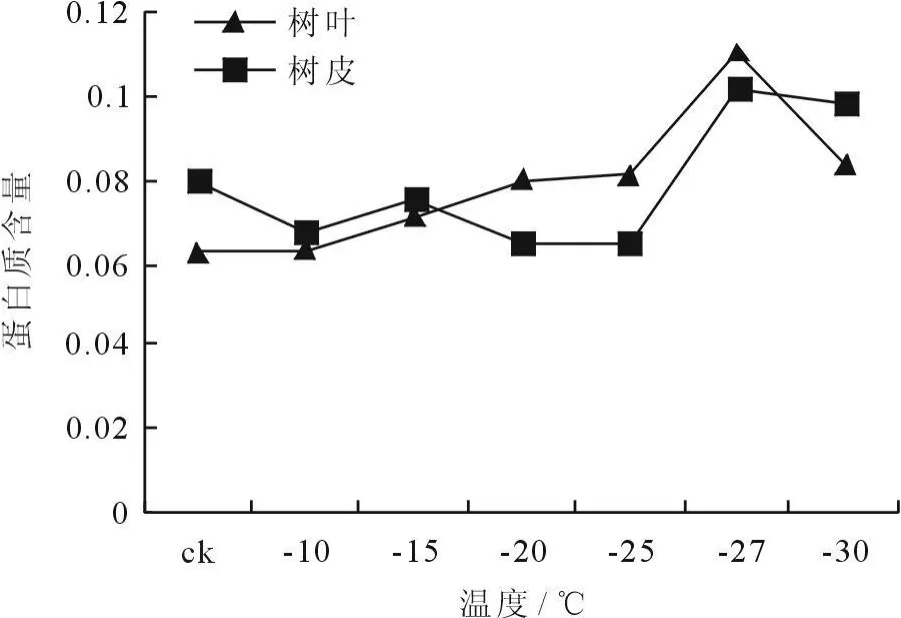
图10 冷冻处理24h后枝条蛋白质含量的变化
3 结语
(1)细胞膜是细胞与环境之间的界面和屏障,是物质交换的主要通道,各种不良环境因素对细胞的影响往往首先作用于这层主要由类脂和蛋白质所构成的生物膜。细胞膜既能接受与传递环境信息,又能对环境胁迫作出反应。低温、高温、干旱、盐渍和大气污染物等的伤害都会影响质膜的结构和功能,往往表现为透性变大或丧失,细胞内物质大量向外渗漏,外渗的电解质主要是 K+,约占外渗物的20%,Ca2+大约是K+的0.1%,葡萄糖、氨基酸及低聚糖类等占80%。以往研究表明,细胞膜透性随处理温度的下降而增加。它与受害组织的伤害程度呈正相关,当膜透性处于可逆性增加时,可能反映植物细胞对寒冷的适应变化;当处于半可逆性增加时,则说明遭受冷害的标志;当处于不可逆性增加时,己是植物细胞因冷致死的结果。因此,质膜透性的测定常用作不同植物抗性研究中的一个生理指标,而较常用和简便易行的方法,就是测定组织外渗液的电导率或K+浓度。低温下,植物组织外渗液中的电解质特别是K+含量就会比正常组织增加,通过测定外渗液电导率的增大或K+浓度的增高,就可反映出质膜受损伤的程度。细胞膜是细胞感受环境胁迫的最敏感的部位[16]。关于低温半致死温度反应植物抗寒性的原理,Rajashekar等[4]证明了低于logistic曲线方程拐点温度时,植物组织中液态水迅速减少,并推论这是由于组织内冰晶扩散屏障的消失,即质膜结构上的变化所致。一般认为,电解质渗出率(即相对电导率)达到50%时的温度为组织的半致死温度(LT50)[8]。本实验中,枝条经24h冷冻处理后,在-27℃时,相对电导率几乎没有变化,维持在55%~60%之间,相对电导率高于50%,说明-27℃时其细胞膜已受到严重损伤,因此,我们可以直观的推测粗榧的低温半致死温度为-27℃。
(2)当植物遭受低温胁迫时,植物细胞的膜保护酶活性下降,内源抗氧化剂含量减少,致使抗膜脂过氧化能力下降,因此,植物抗寒性的高低也表现在冷胁迫期间细胞内源抗氧化剂含量和膜保护酶活性的稳定性方面,低温胁迫下活性细胞内源抗氧化剂含量和膜保护酶活性就成为了衡量植物抗寒性的一个重要指标之一。SOD、POD等是植物对膜脂过氧化的酶促防御体系中重要的保护酶[5]。在细胞保护酶系统中,SOD主要作用是清除超氧自由基。POD在保护酶中主要起到酶促降解H 2O2的作用。一般而言,细胞内的活性氧与防御系统之间保持着平衡[12]。低温使植物体内O2-增加,降低保护酶活性,这在香蕉(Musa nana Lour.)和大蕉(musa sapientum L.)[13]等多种植物上得到证实。低温胁迫过程中,SOD、POD活性出现先升高,这可能是植物细胞对低温胁迫主动适应的方式之一,这表明植物组织的抗性获得是一个逐渐的过程;而后SOD、POD活性下降,可能是植物细胞膜保护酶系统受到损伤,造成最终的活性降低。MDA作为膜脂过氧化最终产物,能够抑制细胞保护酶活性和降低抗氧化物的含量,从而加剧了膜脂过氧化程度[14],反应细胞受伤害的一个重要指标。在试验过程中MDA含量出现先升高再降低趋势,这种现象可能与在降温过程中,植物体通过增加酶促保护系统中某种酶的活性(SOD、POD),来发挥其保护作用,抑制低温引起的或减少O2-的积累,从而降低MDA含量,但随着稳定进一步降低,酶促保护系统受到破坏,清除自由基的能力下降,MDA含量又回升。低温能增加植物体内O2-等活性氧含量,降低SOD活性,膜脂过氧化作用加强[9]。
(3)MDA含量是细胞膜脂质过氧化作用水平的反映[9]。其与植物所受逆境胁迫程度有关。植物受害越重,MDA积累量越多;表现在抗性方面,则为植物抗逆性强,MDA积累量少;植物的抗寒性强,则MDA的积累量少。低温胁迫下,细胞内活性氧代谢的平衡被破坏从而有利于活性氧的产生。活性氧过剩的毒害之一是引发或加剧膜脂过氧化作用,造成细胞膜系统的损伤。因而作为膜脂过氧化产物,MDA含量变化是质膜损伤程度的重要标志之一。低温引起细胞膜系统受损是林木低温伤害的一个重要原因,这是因为林木在低温胁迫下会导致活性氧代谢的失调和自由基的积累,并进一步导致细胞结构的损伤和生理代谢的紊乱。在连续的低温胁迫下,枝条中MDA含量增加。无论是在哪一个胁迫温度下,其细胞内MDA的含量、均较前一个胁迫温度中细胞内的MDA含量要高。
(4)低温下蛋白质的变化一般表现为,随着温度的下降蛋白质含量呈上升趋势。并且蛋白质含量与抗寒性呈正相关。抗寒性越强,蛋白含量越高;抗寒性越差,则蛋白含量越低,但无论是抗寒性强或弱,蛋白含量均随温度的下降而增加,但抗寒性强的,增加幅度大,抗寒性差的,增加的幅度小。
(5)植物受到低温胁迫后,其生理变化是错综复杂的,并受多种因素综合影响。本实验综合相对电导率、细胞保护酶活性、丙二醛含量和蛋白质含量多个角度评定其抗寒性,结果表明,人工冷冻条件下,粗榧枝条的半致死温度在-27℃左右。为了进一步准确推断粗榧的低温半致死温度,我们利用logistic曲线方程结合相对电导率计算的粗榧枝条半致死温度为-27.3℃,与上述结果基本一致。
(6)粗榧原产于长江流域及以南地区,树形优美,是我国南方应用很广的园林树木但由于受到低温的限制在我国北方尚未广泛应用。本试验的结果表明,粗榧枝条的低温半致死温度为-27℃,说明其可忍耐此低温胁迫,因此,粗榧可在冬季气温高于-27℃的地区栽植应用,低于-27℃的地区栽植,在冬季应采取防寒保护措施。
[1]张德舜,刘红权,陈玉梅.八种常绿阔叶树种抗寒性研究[J].园艺学报,1994,21(3):283~287.
[2]马 燕,陈俊愉.几种蔷薇属植物抗寒性指标的测定[J].园艺学报,1991,18(4):189~ 193.
[3]王荣富.植物抗寒指标的种类及其应用[J].植物生理学通讯,1987(3):49~ 55.
[4]张宪政.作物生理研究法[M].北京:农业出版社,1992.
[5]王爱国,邵从本,罗广华.丙二醛作为植物脂质过氧化指标的探讨[J].植物生理学通讯,1986,22(2):55~57.
[6]杨盛昌,谢潮添,张 平.冷锻炼对低温胁迫下夏威夷椰子膜脂过氧化及保护酶活性的影响[J].植物资源与环境学报,2002,11(4):25~ 28.
[7]王建华,刘鸿先,徐 同.超氧化歧化酶(SOD)在植物逆境和衰老生理中的作用[J].植物生理学通讯,1989(1):1~7.
[8]周碧燕,梁立峰,黄辉白.低温和多效唑对香蕉及大蕉超氧物歧化酶和脱落酸的影响[J].园艺学报,1995,22(4):331~335.
[9]刘西平,王妹清.低温对栾树幼苗衰老与脂质过氧化关系[J].西北林学院学报,1995,10(4):72~75.
[10]刘鸿先,曾韶西,王以柔.低温对不同耐寒力的黄瓜幼苗子叶各细胞器中SOD的影响[J].植物生理学报,1985(1):48~57.
[11]由继红,杨文杰,李淑云.不同品种紫花苜蓿抗寒性的研究[J].东北师范大学学报,1995(10):102~105.
[12]袁玉欣,王 颖,裴保华,等.低温诱导对紫穗槐、刺槐抗寒性的影响[J].植物生态学报,1996,20(1):65~73.
[13]严寒静,谈 锋.自然降温过程中栀子叶片膜保护系统的变化与低温半致死温度的关系[J].植物生态学报,2000,24(1):91~95.
