混合酸中各酸组分的分别测定方法探讨
2011-04-13田云全母玉凤牛晓东
田云全,母玉凤,彭 鹏,牛晓东,张 斌
吐哈油田公司,新疆 鄯善 838202
1 概述
目前,吐哈油田公司涉酸作业应用越来越广泛;同时针对不同的用途,包括清洗、酸化、解堵,等等,酸液的组成各不相同,同时含有其他非酸组分,比如防膨剂(粘土稳定剂)、缓蚀剂、阻垢剂、铁离子稳定剂、杀菌剂,等等,组成比较复杂。
为了加强对涉酸作业的监督力度,油田公司各二级单位监督部门认识到了了解作业队伍所配酸液的组成情况的必要性。
针对油田公司的要求,结合目前尚无混合酸中各酸组分的分别测定方法这一实际情况,我们开发出了这一方法,以期实现混合酸中各酸组分的分别测定。
目前,油田公司涉酸作业包括洗井、解堵、酸化等等,所配酸液的主要组分一般为以下几种:盐酸;盐酸+氢氟酸;盐酸+磷酸;盐酸+氢氟酸+磷酸。除此之外,有些酸液中还含有氟硼酸。同时,酸液中还含有缓蚀阻垢剂、分散剂、杀菌剂、铁离子稳定剂、粘土稳定剂等,以达到缓蚀阻垢、分散、杀菌、铁离子稳定、目的地层稳定等目的。
2 测定的基本原理
1)盐酸、氟硼酸是强酸,在水溶液中完全电离成离子,没有分子形式存在;
2)混合酸中氟硼酸可用专用的检测方法可单独检测出含量;
3)氢氟酸是弱酸,在水溶液中只有部分电离成离子,其他以分子形式存在。未电离的分子和已电离生成的离子形成缓冲溶液,它们之间的平衡叫做电离平衡。电离平衡是一种化学平衡,化学上用电离平衡常数K表示这种平衡的大小。
HF←→H++F-。在25℃时,其水溶液的电离平衡常数为KHF=7.2×10-4,负对数 PKHF=3.14,[H+][ F-]/[ HF]= 7.2×10-4。
4)磷酸是强酸,但同时又是多元酸,在水溶液中是分步电离的,其水溶液中同时存在着H3PO4、H+、H2PO4-、HPO42-、PO43-。
(1)H3PO4←→H++H2PO4-,在25℃时,电离平衡常数为K1=7.6×10-3,负对数 PK1=2.12,[H+][ H2PO4-]/[ H3PO4]= 7.6×10-3;
(2)H2PO4-←→H++HPO42-,在25℃时,电离平衡常数为K2=6.3×10-8,负对数 PK2=7.20,[H+][ HPO42-]/[ H2PO4-]=6.3×10-8;
(3)HPO42-←→H++PO43-,在25℃时,电离平衡常数为K3=4.4×10-13,负对数 PK3=12.36,[H+][ PO43-]/[ HPO42-]=4.4×10-13。
5)电离平衡是一种动态平衡,改变溶液中某一离子,如氢离子的浓度,则原有的平衡被打破,直至建立起新的平衡,但原有的电离平衡常数不发生改变。
在某一条件下,酸液的氢离子浓度是一定的,其负对数PH值也是一定的。如果向酸液中加入一定量的标准氢氧化钠溶液,就会发生中和反应,但遵守质量守恒定律和化学反应的一般规律。
6)以弱酸HA为例,中和反应前[HA](假想为未电离,全以分子形式存在)=中和反应后生成的[H+]+[A-]+未反应的[HA]。未电离的分子HA和已电离生成的离子H+及A-形成缓冲溶液,溶液的pH值可用下式计算:
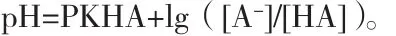
同时,中和反应前[HA]-未反应的[HA]=消耗的标准氢氧化钠溶液的量。
这就为混合酸中各酸组分的分别测定提供了可能。
3 盐酸+氢氟酸混合酸中盐酸、氢氟酸的分别测定方法
基于上述原理,设酸液中盐酸的浓度为xmol/L,氢氟酸的浓度为ymol/L,取样体积为Vml,用于滴定的标准氢氧化钠溶液浓度为Cmol/L。
采用电位滴定法,用标准氢氧化钠滴定溶液滴定。当pH值达到PKHF即3.14时,溶液中[F-]=[HF],即溶液中除盐酸有98%与标准氢氧化钠滴定溶液反应外,还有一半的氢氟酸与标准氢氧化钠滴定溶液发生反应。被滴定的盐酸和氢氟酸的量等于氢氧化钠的消耗量,即:

式中,A-标准氢氧化钠溶液的消耗体积,ml。
随着滴定的继续进行,当pH值达到8.30时,氢氟酸可看成完全电离,溶液中的酸被标准氢氧化钠滴定溶液完全滴定。被滴定的盐酸和氢氟酸的量等于氢氧化钠的消耗量,即:

式中,B-标准氢氧化钠溶液的累积消耗体积,含A,ml。
由(1)、(2)式,可解出:
x=C(1.96B-2A)/(0.96V),即酸液中盐酸的浓度。
y=C(2A-B)/(0.96V),即酸液中氢氟酸的浓度。
4 盐酸+磷酸混合酸中盐酸、磷酸的分别测定方法
设酸液中磷酸的浓度为xmol/L,盐酸的浓度为ymol/L,取样体积为Vml,用于滴定的标准氢氧化钠溶液浓度为Cmol/L。
类似于“盐酸+氢氟酸混合酸中盐酸、氢氟酸的分别测定”一节:
1)当pH值达到7.20时,可得:

式中,A-标准氢氧化钠溶液的消耗体积,ml。
2)当pH值达到8.30时,可得:

式中,B-标准氢氧化钠溶液的累积消耗体积,含A,ml。
此时,由(3)、(4)式,已可解出x、y。
3)当pH值达到11.00时,可得:

式中,D为标准氢氧化钠溶液的累积消耗体积,含B,ml。
4)当pH值达到12.36时,可得:

式中,E为标准氢氧化钠溶液的累积消耗体积,含D,ml。
由(3)、(4)、(5)、(6)式之任意二式,即可解出 x、y,即酸液中盐酸及磷酸的浓度。
5 盐酸+氢氟酸+磷酸混合酸中盐酸、氢氟酸、磷酸的分别测定方法
设酸液中盐酸的浓度为xmol/L,氢氟酸的浓度为ymol/L,磷酸的浓度为zmol/L,取样体积为Vml,用于滴定的标准氢氧化钠溶液浓度为Cmol/L。
类似于“盐酸+氢氟酸混合酸中盐酸、氢氟酸的分别测定”、“盐酸+磷酸混合酸中盐酸、磷酸的分别测定”二节,
1)当pH值达到3.14时,可得:

式中,A- 标准氢氧化钠溶液的消耗体积,ml。
2)当pH值达到7.20时,可得:
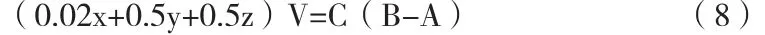
式中,B-标准氢氧化钠溶液的累积消耗体积,含A,ml。
3)当pH值达到8.30时,可得:

式中,D为标准氢氧化钠溶液的累积消耗体积,含B,ml。
由(9)式可求出z,即酸液中磷酸的浓度,再由(7)、(8)二式,即可解出x、y,即酸液中盐酸及氢氟酸的浓度。
6 现场应用情况
经过现场应用试验,获得了较为令人信服的效果,也得到了油田公司二级单位监督部门的认可。我站连续几年得到此项监测工作的工作量。
7 一步工作的方向
在实验室内,配成一定组成的盐酸+氢氟酸、盐酸+磷酸、盐酸+氢氟酸+磷酸几种混合酸液,用上述方法测定,对实验结果进行对比分析,验证本论文所提出的测定方法的可靠性。
[1]华中师范大学,东北师范大学,陕西师范大学版编著.分析化学[M].2版(附录表一).高等教育出版社,1981.
