氢键缔合水分子与水的反常膨胀探析
2011-04-11吴茂江
吴茂江
(宁夏师范学院化工学院,宁夏固原 756000)
一般物质由于温度影响,其体积表现出热胀冷缩的性质,而且凝固时体积缩小。但也有少数物质有热缩冷胀的现象,如水、锑、铋、液态铁等,在某种条件下恰好与上面的情况相反,出现反常现象。本文欲从氢键缔合分子的角度探讨水的这种反常现象。实验证明,水在0℃到4℃这一范围内,其体积随着温度的升高不但不增大,反而缩小;当水的温度高于4℃时,它的体积才会随着温度的升高而增大。水为什么在这一温度范围内会有这种反常膨胀的现象呢?
1 有关水的背景知识
1.1 水的密度
1 g纯水体积随温度变化见图1[1]。
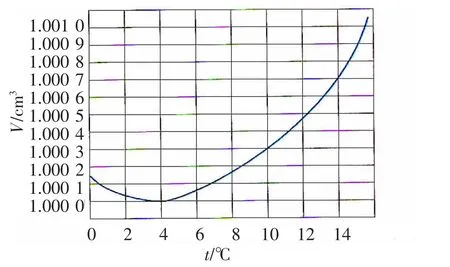
图1 1g纯水体积随温度变化的曲线
一般对纯水的描述是无色、无味、无嗅的液体;在1个大气压时,水的沸点是100℃,冰点是0℃;在4℃(严格地说是3.98℃)时1 m3水质量为1 000 kg,密度最大;但是温度高于或低于4℃时,水的密度就减小,即体积增大。水在凝固成冰时体积增大,密度减小,所以冰总是浮在水面上,在4℃以上,水的密度随温度变化的情况,与一般物质类同。
1.2 水分子的结构
根据近代结构理论的研究和X射线的实验证实,在H2O分子中的三个原子核呈等腰三角形排列,即水分子的空间构型呈V形,H-O-H键角为104°45′,O-H距离为0.096 nm,H-H距离为0.514 nm。氧原子外层电子(2S22P4)经杂化与两个氢原子的两个电子构成两个O-H共价键及两对孤对电子,见图2。H2O是极性分子,两个氢原子带正电,氧一侧带负电,水分子的偶极距很大,为1.84 D。
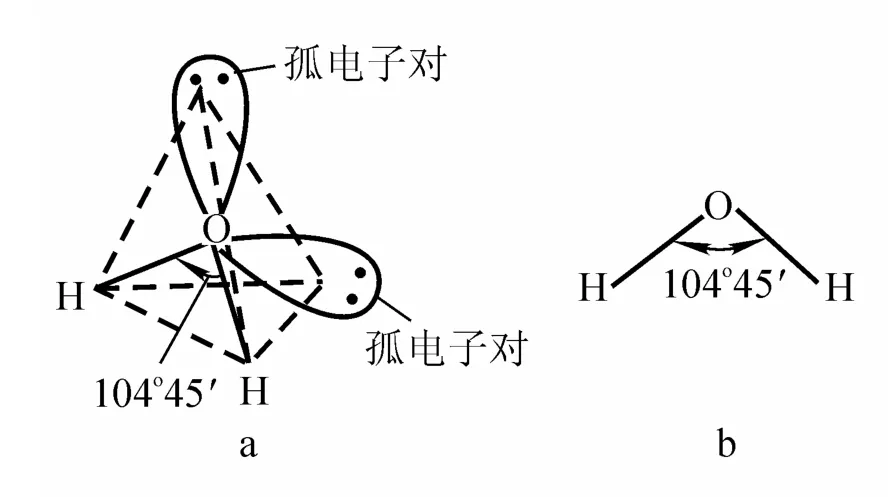
图2 水分子的结构
1.3 冰的结构
冰的水分子间氢键达到饱和,排列有序,其结构为六方晶系晶格,分子间有较大的空隙,见图3。在不同温度和压力下,冰的结构可以有13种相变[3]。
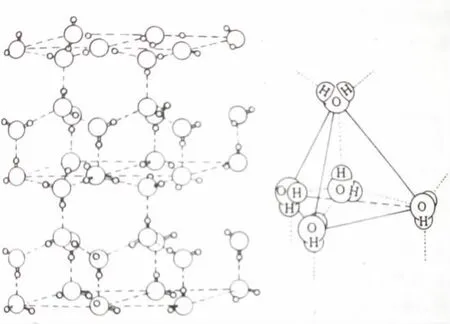
图3 冰的结构和其中氧原子的四面体结构
1.4 水分子间的氢键
水分子间可形成很强的氢键。因为氧原子的电负性较强,氢原子的核外仅有一个电子与氧原子共同形成共价键,共用电子对强烈地偏向氧原子一边,氢核几乎被裸露出来,于是氧原子显负电性,氢原子显正电性。O-H键中几乎裸露的氢核与另一水分子中的氧原子间产生静电吸引作用,这种静电吸引作用形成为氢键虚线表示氢键。
每个水分子可以同邻近的4个水分子形成4个氢键。因为每个水分子在正极一方有两个氢核,可与另外2个水分子的氧形成氢键,在负极一方有氧的两对孤对电子,可与另外2个水分子的氢形成氢键,见图4。
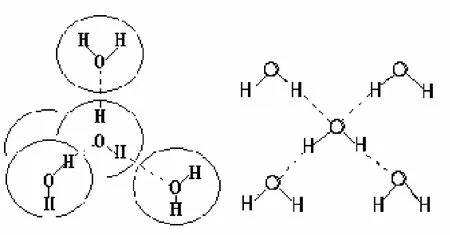
图4 冰中形成的氢键
1.5 水分子的缔合
水分子具有很强的极性,可以互相结合为较复杂的分子。在液态水里,除H2O外,还含有这种复杂的水分子,其组成为 (H2O)n,n值可以为2,3,4……等。它们存在着如下的平衡关系:
n H2O⇌(H2O)n+Q
物质由简单的分子结合成复杂的分子而物质的性质不改变的现象叫做分子的缔合。水的缔合程度随温度而改变,在沸点时测得水的相对分子质量为18.64,此时水蒸气是由96.5%单分子(H2O)和3.5%的二分子体(H2O)2所组成[3]。在液态时,水中为二分子体和三分子体 (H2O)3,见图5。在冰点时,全部水分子缔合成一个巨大的缔合分子,结构很疏松[4]。
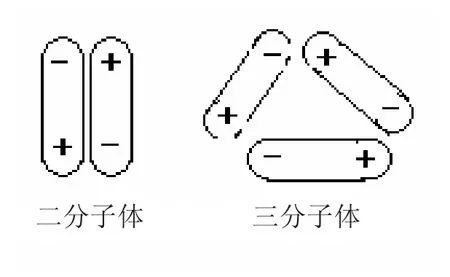
图5 水分子的缔合
2 有关水反常膨胀原因的解释
对水的反常膨胀,目前有如下几种解释。
2.1 微冰结构论
在0℃的水中,除了有大冰块与水共存之外,还有很多微冰存在,而这些微冰的内部又有较大的空隙,这种水常称为具有微冰结构的水,也称具有“冰山”结构的水。显然,在这种水中,微冰的块状越大 (但它仍是肉眼看不见的微冰),数目越多,水的密度就越小。当0℃水被慢慢加热时,微冰就要局部“熔化”,即微冰更加微小。被熔化的部分变成较自由的水分子,并且这些水分子还能钻进微冰的空隙之中,水的密度也因此而增加。但这只是问题的一方面,另一面是:当水被加热时,水分子的热运动速度必然同时增加,这必然导致水分子间距离的增加。在水被加热的过程中,这两种效应同时出现,且它们同时影响着水的密度。从0℃到4℃之间,前一种效应是矛盾的主要方面,水的密度随着温度的升高而增加,在4℃以上继续加热时,后一种效应是矛盾的主要方面,即水的密度随着温度的升高而减小;而在4℃ 时 (实为3.98℃),水中的微冰结构很少,且水分子的热运动又不甚剧烈,所以,此时水的密度最[5]。
2.2 晶体结构论
在冰的晶体结构中,水分子 (冰晶体的分子)以一定方向排列在晶体点阵内,每个水分子都被另外4个水分子包围,这4个水分子形成一个四面体,水分子间相互作用力性质使得在冰的晶体中水分子的排列一定是这种形式,这种排列方式比较松散,体积较大。
用X射线研究液态水的结构时,发现在低温的液态水中,在一定程度上还保留着冰的四面体结构,就是说在低温的液态水中有着非常微小的冰的结晶。根据推算,接近0℃时的水约包含着0.60%的这种微晶体,当温度逐渐升高时,这种微晶体逐渐地被破坏,它的体积就逐渐变小,因而密度逐渐变大,因为这种微晶体具有象冰一样的晶体结构,它的体积比同质量水的体积大。反过来说,它的温度从4℃降到0℃时,这种微晶体逐渐增加,体积逐渐变大,密度逐渐变小,出现反常膨胀。
2.3 极性分子论
水是由很多不断运动着的水分子组成的。根据实验和近代结构理论研究结果知道,在水分子一端带正电荷、一端带负电荷、由于水分子极性的影响,在温度从0℃逐渐升至4℃时,水分子的排列秩序发生改变,使水分子的堆积变得紧密,从而使密度变大。当温度升高到4℃以上时,水分子的动能大了,运动速度加快了,堆积紧密的分子逐渐疏松,运动范围也扩大了,这时候水的密度也逐渐变小了。
2.4 分子缔合论
水在4℃密度最大,高于或低于此温度时密度都要减小。这是由于在4℃时,水主要以二分子缔合形式(H2O)2存在,紧密堆积,因密度最大。温度升高,缔合程度减小,达沸点时只有少数缔合分子。因此,自4℃起,随温度的升高水的密度减小,一般物体热胀冷缩的规律在水的自身占了主导地位。自4℃温度下降,缔合程度增大,三分子缔合的数目增加,趋向冰的结构,冰点时全部分子结合成巨大的缔合冰分子,在冰水中水分子的排布是每1个氧原子有4个氢原子近邻 (2个共价键,2个氢键),这样一种排布导致成一种敞开结构,也就是说冰的结构中有较大的空隙,所以自4℃随温度下降其密度也逐渐减小[6]。
3 氢键缔合水分子与水的反常膨胀
从上述解释水的反常膨胀现象的各种观点看,都有一定的理论依据,应该考虑。但笔者认为,从氢键缔合水分子理论解释更为科学合理一些。
3.1 氢键与水分子的缔合作用
由于氢键的作用,氢原子一方面以共价键形式与氧原子结合形成水分子H2O,另一方面水分子中氢原子与另一水分子中的氧原子形成氢键的结果使两个或两个以上水分子结合成比较复杂的分子。OH…O中氢键的键能为18.83 kJ/moL,是弱键,容易因吸热而破裂,使缔合分子离解。简单水分子与缔合分子同时可相互转化而建立平衡。
缔合过程放热,离解过程吸热。温度升高,有利于缔合分子离解;温度降低,有利于简单水分子的缔合。显然,水中的氢键数与温度有关。温度降至0℃,水结成冰时,全部水分子形成为巨大的缔合分子。
3.2 氢键与冰晶体的空间结构
O-H键与一个O结合形成O-H…O键后,由于H的半径比O的半径小很多,如果有第3个O靠近它们时,则第3个O受已结合的H的斥力比受H的引力大得多而被斥开。所以O-H键只能和1个O结合形成O-H…O键。因此,氢键具有饱和性。同时,O-H…O呈直线相互作用时,两个O之间距离最远,斥力最小,形成氢键最强,体系最稳定。所以氢键在直线方向上形成,这就是氢键的方向性。
在水分子之间形成的氢键的方向性使水分子按一定方向缔合成复杂的缩合分子,见图6A;冰中每个水分子都被相邻的4个水分子形成的四面体所包围。同时每个水分子又都位于某个四面体的顶点,位于四面体体心的水分子通过4个氢键与四面体4个顶角的4个水分子相联系,由无数个这种四面体结构在空间有规则周期排列的结果形成冰的空间结构。因此冰晶体的空间结构中每个水分子周围只能有4个水分子,而不能像一般晶体那样紧密排列,见图6B。设想水分子紧密堆积,则1 g冰的体积只有0.5×10-6m3,但事实上1 g冰的体积是1.09×10-6m3。可见,冰晶体空间结构是一个敞开的结构,分子间有较大的空隙,显然氢键的方向性导致了冰晶体空间结构较疏松。冰具有多孔的“网状”立体结构。
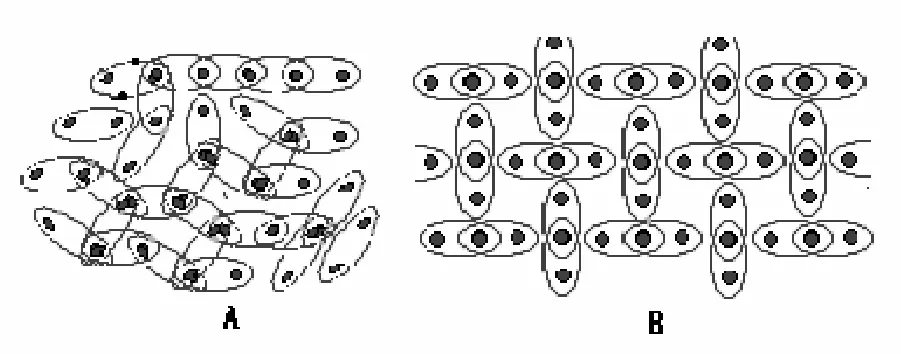
图6 水分子和冰分子平面图
3.3 氢键与水的反常膨胀
当冰吸热熔解为水后,15%的氢键破裂,冰的多孔结构遭到破坏,巨大的缔合分子离解为许多较大的缔合分子和单分子,它们之间不受氢键方向性的支配,可以任意排列,堆积得比较紧密,因而冰熔解时吸热而体积缩小,反之,水结成冰时体积膨胀。显然,这种反常膨胀是氢键作用的结果。
当水的温度从0℃逐渐升高到100℃过程中,将产生两种效果。其一,温度升高,分子动能增大,分子间平均距离增大,因而导致水的体积增大。其二,温度升高,氢键进一步破裂,缔合分子进一步离解,大的缔合分子减少,小的缔合分子增多,由于小的缔合分子间的排列比大的缔合分子紧密,因而导致水体积的缩小。4℃以上的水温度升高时,第一种效果占优势,因而4℃以上的水与一般物质一样,遵循物质的热胀冷缩原理;在0℃~4℃范围内,水的温度升高时,第2种效果占优势,因而两方面的总效果导致水的体积缩小。表现为热缩冷胀。
4 结束语
水的反常膨胀现象,原因肯定与水分子具有特殊的结构有关,但对水分子结构的研究,目前科学界还没有统一的认识,因此对水的密度反常变化的原因还没有统一的解释。笔者上述的讨论,还是处在浅层次的解释上,还希望有关专家作更科学合理的解释。
[1]袁运开.科学(七年级下册)[M].上海:华东师范大学出版社,2002.
[2]王凯雄.水化学[M].北京:化学工业出版社,2001.
[3]杨德壬.无机化学[M].北京:高等教育出版社,1993.
[4]于学舜,徐化民,李钟岐,等.化学[M].呼和浩特:内蒙古人民出版社,1980.
[5]肖春模,刘翠霞.无机化学[M].济南:山东教育出版社,1984.
[6]董树岐,连凤羽,曲行文.化学教学手册[M].长春:吉林人民出版社,1984.
