稻秆降解复合菌系的筛选及其生长特性的研究
2011-04-10种玉婷李文哲郑国香李成毅
种玉婷,李文哲,郑国香,李成毅,刘 爽
(东北农业大学工程学院,哈尔滨 150030)
随着石油等化石燃料的枯竭,寻找可代替化石燃料的新能源成为世界各国科学家的首要任务。纤维素因其是地球上产量最大且经济环保的可再生能源物质,对于缓解未来的能源危机有着重要意义[1-3]。
近年来,随着纤维素生物降解机理研究的不断深入,如何发挥降解过程中微生物之间的协同与微生物生态系统的稳定性作用成为木质纤维素类物质降解的研究热点[4-5]。因而充分利用自然界微生物间的协同关系,直接从自然环境中筛选能够降解木质纤维素的复合菌系成为一个新的研究趋势[6]。王伟东等以高温期的堆肥样品为材料,筛选构建了一组木质纤维素分解菌复合系,该复合系在50℃培养条件3 d就可使滤纸崩溃率达到90%以上[7-8]。崔诗法等从腐烂的枯枝落叶中分离到一组分解能力较强的纤维素分解复合系St-13[9],该复合系5 d内可使滤纸完全崩溃,液体培养到14 d时能够分解玉米秸秆中85.27%的纤维素,总失重率为58.03%。这些都为加速复合系的研究以及天然纤维素资源的利用开辟了新的道路。
本研究以较难降解的稻秆为碳源,并控制培养温度为35℃的中温条件,筛选出一组稻秆降解率较高的复合系,命名为LZF-12。并探索了其生长特性和生长条件,为该菌系的进一步优化提供了重要理论依据。
1 材料与方法
1.1 材料
1.1.1 土样来源
分别从森林、沼泽边等多处不同地点采取土样24份,分别命名为样品1-24号,进行筛选。
1.1.2 培养基
稻秆的预处理:先将稻秆浸泡在1%NaOH溶液中24 h,再用清水反复冲洗干净,于50℃烘箱烘干后将其剪成长度约为1 cm左右。
分离培养基:NaCl 0.5%,酵母粉0.1%,蛋白胨0.5%,CaCO30.3%,经处理的稻秆1%,pH自然,121℃灭菌20 min。
1.2 测定方法
1.2.1 纤维素分解菌群生长曲线的测定
用250 mL的锥形瓶装入200 mL分离培养基,接入20 mL种子液,35℃静置培养,每隔12 h取样,用752型分光光度计测定600 nm时的吸光度,以未接菌的培养基作对照。
1.2.2 稻秆失重的测定
将发酵结束后的发酵液用八层纱布过滤,然后用盐酸和硝酸的混合液冲洗纱布中剩余物,以除去残留的菌体和碳酸钙,再用清水反复冲洗多次,最后置于烘箱中烘至恒重[10]。
2 结果与分析
2.1 复合菌系LZF-12的筛选
初次筛选时,取24份土样分别接种于分离培养基中,定期跟踪观察滤纸变化,以滤纸崩解程度作为初期筛选的指标。在滤纸降解的旺盛时期以10%的接种量将培养液转接至新鲜培养基中,如此反复转接下去。以滤纸完全被降解掉所用的时间长短来衡量菌系的降解能力,多数样品在传代过程中因其对滤纸分解能力弱而被淘汰,而10和12号样品因其良好的滤纸降解能力和稳定的菌群特性被连续转接下去,以稻秆作为主要碳源定向驯化后,经过三十多次的传代培养,最后获得一组降解效果较好且稳定的菌系,命名为LZF-12。
2.2 复合菌系LZF-12的形态观察
通过光学显微镜和电子显微镜对复合菌系的生长形态进行了观察。在低倍的光学显微镜下对培养7 d的菌液进行观测,发现(见图1-A)复合系LZF-12主要由杆菌组成,且菌体密集。这表明此时菌群代谢旺盛,消耗底物的速率也相对较快。由于不同的复合菌系自身菌群的多样性不同,往往表现出不同的形态特征。如刘震东等[10]获得的高温降解纤维素复合菌系主要是由长杆菌构成。而培养发酵中期的样本在电子显微镜的放大结果显示,LZF-12的菌群组成比较复杂,从外观形态来看,粗细、长短不一,从数量上看杆菌占优势。同时,杆菌之间夹杂着少量的球状菌、梭状菌和哑铃状菌等,如图1-B标注。这表明,LZF-12中的菌群多样,菌系彼此共生在同一个环境中。

图1 LZF-12发酵中期的形态特征Fig.1 Conformation character of LZF-12 in mediumterm fermentation
2.3 复合菌系LZF-12的生长特性
2.3.1 LZF-12的生长曲线
以稻秆为主要碳源培养复合菌系LZF-12,600 nm下测定的生长曲线见图2。微生物经过1~5 d的对数生长期后达到最高值,OD600值为3.107,之后又开始下降,从7 d开始OD600呈现平稳状况,其值变化很小。由图2可知,复合系从初始到峰值大致可分为三个增殖阶段,其增殖速率依次下降。在接种后的前24 h复合系呈快速生长状态,24 h后其增长速度明显下降,而由后面试验可知,培养基的溶解氧也是在24 h内快速下降到最低值的,由此可推断复合系的总体活性很有可能跟培养基内的溶解氧有关系,当复合系中的好氧菌将培养基中95%以上的氧消耗尽时,所形成的微好氧环境必定会抑制好氧菌的生长,致使复合系的总体增殖速度下降。从图2中曲线我们可以看出在72 h左右又出现一转折点,从72到120 h左右为复合系增殖的最后阶段,由曲线倾斜度可知该阶段微生物数量增加缓慢,而这一时间段与试验中复合系对滤纸的快速降解阶段相吻合,可能是该时间段复合系开始利用培养基中较难利用的纤维素类物质所致。随着结构复杂的纤维素类物质被降解成易利用的低糖类成分,发酵液内微生物的数量反而下降,这可能是由于复合菌系在消耗碳源的同时,产生了大量的挥发酸等产物,随着这些产物的积累,反馈抑制了微生物体内相应酶的活性,从而影响微生物菌群的生长。该阶段,复合系对稻秆的分解与对培养基中各种酸类物质的降解达成一个动态平衡的状态,故其生长曲线显示出较平稳的状态。
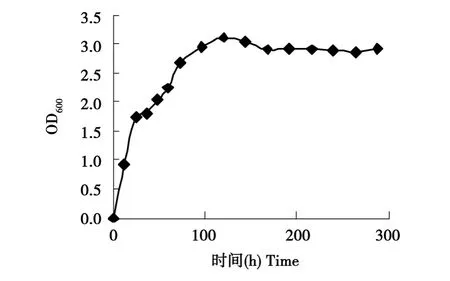
图2 复合菌系LZF-12的生长曲线Fig.2 Growth curve of complex system LZF-12
2.3.2 发酵液的DO值变化
以10%的接种量将复合系接种于分离培养基中,35℃静置培养。每24 h测其DO值(见图3)。新鲜分离培养基DO值为2.3 mg·L-1左右,含氧量较为丰富。由图3可以看出在接菌后的二十几个小时内,DO值由初始的2.3 mg·L-1急剧下降到0.07 mg·L-1,之后瓶内DO值基本都维持在0.07~0.09 mg·L-1之间,在192 h之后又开始缓慢下降,到发酵结束后其DO值为0.05 mg·L-1左右。在发酵的初期,溶氧的急剧下降说明该菌系有好氧性菌株存在,当DO值降至0.07 mg·L-1的微好氧环境时,体系内的好氧菌的生长受到抑制。在此后的培养中,培养基一直处于微好氧环境,而且试验复合系对滤纸的快速降解过程也是在这样的环境中完成的,这说明微好氧的环境更适合该菌系对木质纤维素物质的降解,而复合系中的好氧菌在前期快速消耗体系内的溶解氧,为微好氧菌的增殖和降解提供了有利的环境。二者的有机配合共同促进了复合系对木质纤维类物质的降解。
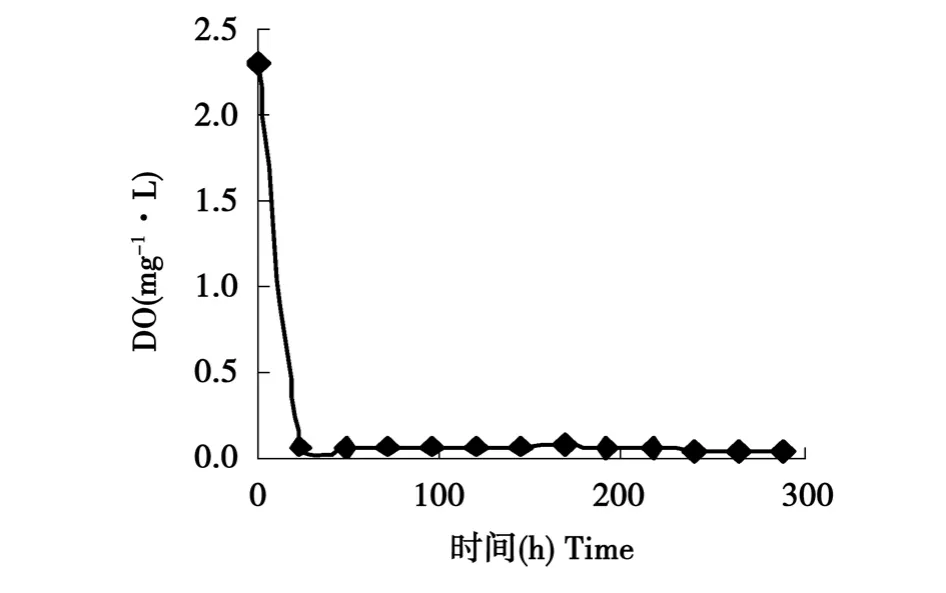
图3 发酵过程中的DO值的变化Fig.3 Change of DO value in fermentation
2.3.3 不同初始pH对发酵体系内pH变化的影响
将发酵培养基的初始pH调到4.0,5.0,6.0,7.0,8.0,9.0,10.0,接种量为10%,35℃条件静置培养,每24 h监测反应体系内的pH值。结果见图4。
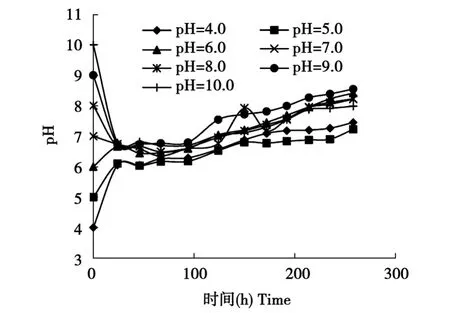
图4 不同初始pH下发酵液的pH变化Fig.4 Changes of ferment liquid pH with different initial pH
由图4可见,不同初始pH的各试验组,接种后其发酵液内的pH均有向中性靠拢的趋势,pH为4~5的发酵液在24 h时回升到6左右,其余的发酵液均在24 h时维持在7左右,在之后的48 h内各发酵液的pH基本没有变化,从100 h左右起,各发酵液的pH呈缓慢上升趋势。由此可见,复合系表现了很强的pH调节能力,总的规律是先将pH调到中性或微酸性,在此阶段,复合系先利用培养基中容易消化的糖类物质,并将其转变成有机酸,从而导致pH的下降。随着产生的有机酸被分解或转化后,pH又开始缓慢回升,这与复合系对底物的利用相吻合。
2.4 复合菌系LZF-12的降解特性观察
2.4.1 LZF-12的滤纸降解特性
复合菌系LZF-12降解滤纸的表观现象表明,在滤纸崩溃的整个过程中,前期降解速度较慢,如图5-a~b所示,接菌后的前3 d滤纸变化不明显,84 h左右时开始观察到滤纸变软变薄,而在之后的培养中滤纸降解明显加快。可以清楚的看到从液面下1 cm处至底端的滤纸降解非常明显,到100 h左右时滤纸从液面下1 cm处断裂浸入到培养基中,在120 h左右时断裂的滤纸完全被降解掉。复合菌系LZF-12内的菌群在前期生长过程中,先利用培养基中较易利用的营养成分进行快速繁殖,到84 h以后菌群利用滤纸现象逐渐明显,自身菌群繁殖速度达到一个相对稳定的状态,直至120 h左右滤纸完全被消耗。

图5 复合菌系LZF-12降解滤纸的过程Fig.5 Course of filter paper degradation by complex system LZF-12
2.4.2 LZF-12的稻秆降解特性
本组试验是选用数根稻秆茎,用细绳将其捆绑一起置于培养基中。图6-A和B分别是稻草叶面经复合菌系作用前后的扫描电子显微照片,对比发现,对照(A图)的细胞排列整齐、规则平整,而B中经菌作用后的叶片表面的表皮细胞、硅化/木栓细胞列等已经被破坏和撕裂开,结构破坏明显,细胞表面的蜡质层也被破坏掉,有利于细菌的侵入。由图6-C可知,在复合系LZF-12的作用下,稻茎中起粘连和支撑作用的薄壁组织在复合系的作用下被降解掉,导致7天左右稻秆便软化浸入培养基中。图6-D显示,复合菌系已经完全侵入稻草的内部结构组织,破坏维管组织周围的细胞结构,使包裹其中的大维管束裸露并呈现出来,同时可以清晰的看到菌群已经大量的在维管组织及其他组织细胞之间生存集聚,从而加剧对底物稻草的破坏程度和速度,见图6-D所标示。
2.4.3 不同培养条件对复合系降解效果的影响
将复合菌系分别置于静置和摇床条件下培养,温度均为35℃,摇床转速为100 r·min-1。280 h后测稻秆的失重。从图7可以看出,从整个发酵过程来看,两条曲线的变化趋势比较相似,在接种后的前70 h内降解速率比较快,可能是复合系先利用稻秆中的糖类、果胶类物质,待将包裹其中的半纤维素、纤维素类物质释放出来,开始诱导相关的酶系从而对其降解,由于纤维素类物质结构的复杂性,所以降解速度也相对慢些。整个过程中,摇床条件下的稻秆失重率始终高于静置条件下的,但最终的降解率又非常接近,分别为64.94%和62.84%,这与前文所说的微好氧环境更适合复合系对纤维素物质的降解似乎有矛盾,其实不然,由于瓶口密封较好,且摇床转速也较低,所以瓶中溶氧并没有太大提高,倒是摇床条件下瓶中营养物质混合均匀,更有利于复合系的吸收利用。考虑到摇床条件下在后期的发酵中会消耗较大能量,选择在静置条件下对复合系进行驯化培养。

图6 复合菌系LZF-12降解稻草的表观特征Fig.6 Apparent character of straw degredating by LZF-12

图7 不同培养条件下复合系对稻秆的降解能力Fig.7 Capacity of degradation under different culture condition
3 讨论
稻秆是一种较难被降解利用的天然纤维素类物质,经碱处理的稻秆其纤维素、半纤维素、木质素总含量占70%左右,纤维类含量较高。纤维素的降解是在几种不同的酶的协同作用下完成的,参与降解的酶系属于诱导型,因此复合系先利用培养基中容易利用的碳源进行增殖,待将其消耗殆尽时开始诱导降解纤维素的酶系,否则较高的易利用碳源浓度会抑制纤维素酶的合成[11-13]。复合系LZF-12对滤纸的降解过程也体现了这一点,即复合系LZF-12先利用培养基中容易利用的碳源进行增殖,大约在接种后前70 h左右,这时瓶中滤纸基本无变化,当复合系达到一定数量、易利用的碳源被消耗掉时,开始诱导复合系产生降解纤维素类物质的相关酶系,从而对滤纸进行降解。
在复合系LZF-12的作用下,7 d左右稻秆被破坏明显,起支撑和粘连作用的薄壁组织基本被降解掉,暴露出更难降解的维管束类结构,通过观察复合系对滤纸和稻秆的降解可知,起降解作用的主要是其中的微好氧菌,这对于复合系培养环境的优化提供了重要参考价值。本研究只对稻秆的表观变化进行观察,对于其降解率及发酵过程产物分析还有待于进一步探讨。
4 结论
a.通过以稻秆为碳源并在中温35℃培养的定向驯化,从24组原始土样中成功筛选出一组稻秆降解率较高且相对稳定的复合菌系,命名为LZF-12。该复合菌系6 d内即可将滤纸完全降解,7 d即可软化稻秆。
b.LZF-12复合系由好氧菌株和微好氧菌株构成,好氧菌通过消耗培养基溶解氧为微好氧菌营造适宜环境,而木质纤维物质的降解主要依靠微好氧菌。与静置条件相比,低转速摇床下培养基中物质混合均匀,稻秆降解率也较高。
c.不同初始pH条件下,复合菌系发酵过程的环境pH变化趋势基本一致,表明该菌系对环境pH的变化具有较强的缓冲调节能力。
[1] 孙宝魁,王东伟.高效稳定纤维素分解混合菌群的筛选及分解特性研究[J].环境科学与管理学报,2008,33(9):116-119.
[2] Schubert C.Can biofuels finally take center stage[J].Nat Biotechnol,2006,24(7):777-784.
[3] 许修宏,肖玉珍,陈建平,等.高效纤维素分解菌分离筛选的研究[J].东北农业大学学报,1998,29(4):330-333.
[4] Lu W J,Wang H T,Yang S J,et al.Isolation andcharacterization of mesophilic cellulose-degrading bacteriafrom flower stalks-vegetable waste co-composting system[J].2005,51:353-360.
[5] Masahiro K,Nozomi I,Toshiaki K.Biological.Pretreatment with two bacterial strains or enzymatic hydrolysis of office pape[J].Current Microbiology,2007,54:424-428.
[6] Kondoh M.Foraging adaptation and the relationship between foodweb complexity and stability[J].Science,2003,299:1388-1391.
[7] 王伟东,王小芬,高丽娟,等.高效稳定纤维素分解菌复合系WSC-6的筛选及其功能[J].黑龙江八一农垦大学学报,2005,17(3):14-17.
[8] 牛俊玲,崔宗均,李国学,等.高效纤维素降解菌复合系的筛选构建及其对秸秆的分解特性[J].农业环境科学学报,2005,24(4):795-799.
[9] 崔诗法,廖银章,黎云祥,等.纤维素分解复合菌系St-13的筛选及产酶条件的研究[J].现代农业科学,2009,16(1):8-11.
[10] 刘震东,李文哲,刘爽,等.高效木质纤维素分解菌复合系的发酵特性[J].东北农业大学学报,2009,40(8):105-109.
[11] Odenyo A A,Biahop R,Asefa G.Isolation and characterisa-lion of anaerobic cellulose-degrading bacteria from East African porcupine(Hystrix cristata)[J].Anaerobe,1999(5):93-100.
[12] Schwarz W H.The cellulosome and cellulose degradation by anaerobic bacteria[J].Appl Microbiol Biotechnol,2001,56:634-649.
[13] 张宇,卓依婷,许敬亮,等.高效纤维素降解菌的筛选及其系统发育分析[J].太阳能学报,2009,30(1):103-106.
