UroVysion荧光原位杂交监测膀胱癌复发的研究
2011-04-09李连印姜君仪刘俊江李守宾高双友
李连印,姜君仪,刘俊江,李守宾,高双友
0 引言
膀胱镜和尿细胞学检查是诊断膀胱移行细胞癌应用较广泛的方法。膀胱镜检查是一种侵入性检查,且费用昂贵;而尿细胞学检查对膀胱癌检测灵敏度相对较差[1]。理想的监测膀胱癌复发的手段不仅应具有较高的灵敏性和特异性,且应该具有无创性。近年来,有学者已提出通过检测尿液来诊断膀胱癌,例如膀胱肿瘤抗原测试、细胞核基质蛋白22、膀胱癌特异性核基质蛋白4,尿端粒酶等[2-3]。虽然大部分已被证明比细胞学检测敏感性高,但特异性仍然较低。荧光标记DNA探针的方法一定程度地解决了这个问题[4-5]。文中前瞻性地检测后续治疗的膀胱癌患者荧光原位杂交DNA探针(UroVysion原位杂交法)的敏感性和特异性,并将结果与尿细胞学比较,以评估其在膀胱癌复发检测中的价值。
1 材料与方法
1.1 研究对象2008年4月至2010年10月间,我科共收集接受经尿道膀胱肿瘤电切后膀胱尿路上皮癌患者58例,膀胱镜检查留取尿液样本,部分被送往病理实验室进行常规细胞学检查,另一部分行细胞遗传学荧光原位杂交分析。膀胱镜、细胞学检测和荧光原位杂交分析均独立完成。如发现肿瘤细胞或高度可疑的细胞,细胞学检测定义为阳性发现。膀胱镜检查中发现有疑似病灶或肿瘤的患者将被安排做活检或经尿道膀胱肿瘤切除术,并记录膀胱镜下发现的肿瘤大小、位置和数目,并根据世界卫生组织分级制度,同时依照膀胱癌临床分期惯例进行分期。所有患者均签署知情同意书。
1.2 荧光原位杂交法将20~50ml新鲜尿液以2∶1比例与2%聚乙二醇混合,存放在4℃环境24 h内处理。脱落细胞转速500 r/min离心10 min,离心半径为7 cm,用甲醇冰醋酸复合溶液按体积比3∶1固定后再次离心沉淀,将沉淀的细胞用10 μl固定液悬浮,制成切片。荧光原位杂交采用UroVysion膀胱癌DNA探针检测试剂盒(美国雅培公司),探针包括3个重复序列,以识别3号、7号和17号染色体的着丝粒部位。另外还有一特殊位点序列,可与9p21杂交。这些DNA序列分别由SpectrumRed,SpectrumGreen,SpectrumAqua和SpectrumGold荧光标记[5-6]。根据实验步骤,将切片在柠檬酸钠缓冲液溶液中73℃孵育2 min后,用含0.008%胃蛋白酶的0.01 mol/L的盐酸溶液,37℃消化10 min。在PBS水洗后,用1%甲醛在室温下固定,并脱水。UroVysion的溶剂滴加在载玻片上的特定区域,并将其盖住。Codenaturation 80℃干燥烘箱烘干8 min后,可获得变性探针和染色体DNA,在潮湿的环境下37℃放置20h,可完成杂交。杂交后用柠檬酸钠缓冲液与0.3%乙基苯基聚乙二醇混合液73℃下冲洗2 min,随后滴加柠檬酸钠缓冲液与0.3%乙基苯基聚乙二醇混合液,在室温下放置1 min。空气干燥后,4′,6二月米基-2-苯基吲哚Ⅱ进行反染色染色,并根据试剂盒进行结果分析。杂交面积用×40物镜检视扫描细胞学上的非典型细胞核,例如细胞核增大、不规则轮廓,并呈片状。不正常的细胞核指拥有2套DNA基因拷贝数,或者缺失9p21纯合子的信号。不正常的标本指超过16%细胞有多重染色体,或者48%细胞缺失9p21纯合子的信号(图1)。
1.3 统计学分析采用SPSS13.0统计软件进行各数据统计处理。采用多个样本构成比的比较。特异性计算方法=真阴性/(真阴性+假阳性);敏感性计算方法=真阳性/(真阳性+假阴性)。阳性预测值=真阳性/(真阳性+假阳性);阴性预测值=真阴性/(真阴性+假阴性)。以P≤0.05为差异有显著性统计学意义。
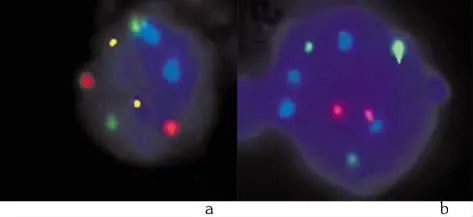
图1 尿路正常上皮细胞和尿路上皮癌细胞的UroVysion荧光原位杂交法检测结果Figure 1 Results of UroVysion FISH for bladder cancer and normal uroepithelium
2 结果
本次研究共纳入研究对象58例,男女比例5.33∶1,平均年龄为68岁(67.5±8.4)岁,所有患者平均随访时间为(20.4±6.3)个月。41例患者确诊为膀胱癌术后复发。17例患者经尿液细胞学检查、UroVysion荧光原位杂交法检查、膀胱镜检查均正常。其中,尿细胞学检测18例为阳性(敏感性为43.9%),荧光原位杂交检测发现36例阳性(敏感性为87.8%),敏感度明显高于脱落细胞学检查结果见表1。所有UroVysion荧光原位杂交法和尿脱落细胞学检查发现膀胱肿瘤患者均经膀胱镜检查和病理诊断,证实膀胱癌复发,故荧光原位杂交和尿脱落细胞学检查的特异性均为100%。特别需要指出的是,1例膀胱憩室内临床分期为Ⅰ期但是病理分级为3级的肿瘤复发,但细胞学检测或荧光原位杂交检测均阴性。在UroVysion荧光原位杂交法检测阳性的病例中,17例为G3级肿瘤,12例为G2级肿瘤,7例为G1级肿瘤;相比之下,尿液细胞学检查结果发现,15例为G3级肿瘤,3例为G2级肿瘤,无G1级肿瘤阳性病例(表2)。实验结果显示,UroVysion荧光原位杂交法法比细胞学检测更加有效。
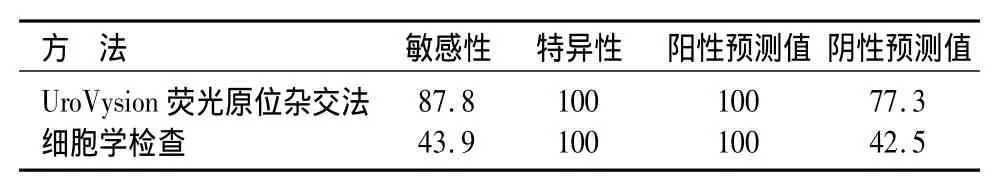
表1 UroVysion荧光原位杂交法检测与尿液脱落细胞学检测膀胱癌复发结果(%)Table 1 Specificity and sensitivity of UroVysion FISH and urine cytology for the diagnosis of bladder cancer(%)
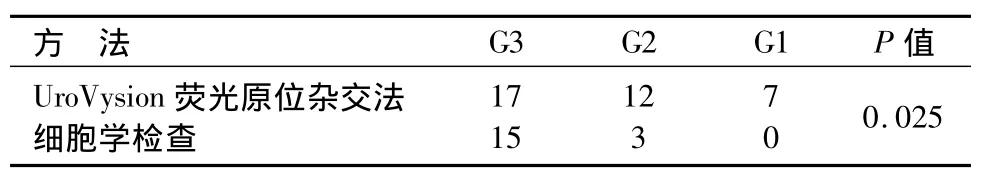
表2 UroVysion荧光原位杂交法检测与细胞学检测膀胱癌复发结果(n)Table 2 UroVysion FISH and urine cytology for the diagnosis of bladder cancer of different grades(n)
3 讨论
膀胱癌好发于中老年男性,具有较高的复发率,对复发的早期发现,能够提高患者治疗效果和延长患者生存期。目前对膀胱癌术后的随访一般为每隔一段时间进行膀胱镜检查及尿液中脱落细胞的细胞学分析。膀胱镜检查是一种有创检查方式,且费用昂贵[2,7]。而尿液脱落细胞学检查特异性约为96%至100%,但对G1、G2、G3肿瘤细胞的敏感性约20%、50%和80%。因此,尿液细胞学检测作为检查方法并不可靠。近年来,微卫星技术已被用来检测基因组杂合性损失的和不稳定病变。测试筛选膀胱癌患者敏感性为100%,特异性为96%[8-10]。然而,这种技术还需要大量的病例试验[11]。荧光原位杂交技术近年来的发明和应用为膀胱癌的早期诊断提供了有效的途径。荧光原位杂交技术基本原理是通过标记的DNA探针与细胞核内的DNA靶序列杂交,获得细胞内多条染色体(或染色体片段)或多种基因状态的信息。与传统的放射性标记原位杂交相比,荧光原位杂交技术具有安全、快速、灵敏度高、检测信号强、杂交特异性高以及能同时显示多种颜色等优点。
肿瘤生物学研究发现,实体肿瘤在其生长的初期大量染色体复制过程中,产生随机的基因获得或缺失,这种现象被称为染色体不稳定现象。膀胱癌细胞中常发生染色体变化,比如常见的染色体拷贝数的变化、抑癌基因的缺失等,都可能在肿瘤发生、进展过程中发挥非常重要的作用。最初,肿瘤细胞的染色体非整倍体研究由流式细胞仪检测,但限制过多,难应用于了临床。近年来,荧光原位杂交法已被证明是有效检测细胞间期的细胞染色体非整倍体的工具[12]。最新发展多色DNA探针大大提高检测单个细胞中异常染色体对的能力。
研究中发现,UroVysion荧光原位杂交法检测膀胱癌的敏感度明显高于细胞学检测的敏感度,这与其他一些国外学者的研究结果一致[13]。一些G1和G2级肿瘤尿脱落细胞学检查为阴性,但UroVysion荧光原位杂交法结果则发现了异常的染色体改变。一些国外学者还报道,UroVysion荧光原位杂交法对pTis检测比细胞学检测更有优势[14]。因此,UroVysion荧光原位杂交法检查更适合肿瘤分级较低的患者。但我们的研究中有1例膀胱憩室内癌复发患者,但细胞学和UroVysion荧光原位杂交法实验结果均为阴性。该患者肿瘤分期G3pT1,因此推测肿瘤负荷低不是导致尿液中的异常细胞缺乏的原因,位于膀胱憩室肿瘤可能阻止肿瘤细胞扩散到尿液。
这项实验的前瞻性研究发现,在特异性相同的情况下,UroVysion荧光原位杂交检测比尿液细胞学检查在检测膀胱癌复发时具有更高的灵敏度。因此,UroVysion荧光原位杂交杂交法可成为筛选膀胱癌复发的工具之一。
[1]Ramakumar S,Bhuiyan J,Besse JA,et al.Comparison of screening methods in the detection of bladder cancer[J].J Urol,1999,161(2):388-394.
[2]Lokeshwar VB,Soloway MS.Current bladder tumor tests:does their projected utility fulfill clinical necessity?[J]J Urol,2001,165(4):1067-1077.
[3]魏武,葛京平,虞伟,等.端粒酶活性测定在膀胱癌诊断中的作用[J].医学研究生学报,2002(15):301-303.
[4]Kimura F,Florl AR,Seifert HH,et al.Destabilization of chromosome 9 in transitional cell carcinoma of the urinary bladder[J].Br J Cancer,2001,85(12):1887-1893.
[5]Kim WJ,Bae SC.Molecular biomarkers in urothelial bladder cancer[J].Cancer Sci,2008,99(4):646-652.
[6]Bubendorf L,Grilli B,Sauter G,et al.Multiprobe FISH for enhanced detection of bladder cancer in voided urine specimens and bladder washings[J].Am J Clin Pathol,2001,116(1):79-86.
[7]Halling KC,Rickman OB,Kipp BR,et al.A comparison of cytology and fluorescence in situ hybridization for the detection of lung cancer in bronchoscopic specimens[J].Chest,2006,130(3):694-701.
[8]吴阶平.膀胱肿瘤[M].2版.济南:山东科学技术出版社,2005:925-932.
[9]Weikert S,Krause H,Wolff I,et al.Quantitative evaluation of telomerase subunits in urine as biomarkers for noninvasive detection of bladder cancer[J].Int J Cancer,2005,117(2):274-280.
[10]曾铮,周晓军.膀胱癌分子标记物[J].医学研究生学报,2009,22(12):1333-1336.
[11]Neves M,Ciofu C,Larousserie F,et al.Prospective evaluation of genetic abnormalities and telomerase expression in exfoliated urinary cells for bladder cancer detection[J].J Urol,2002,167(3):1276-1281.
[12]Varella-Garcia M,Gemmill RM,Rabenhorst SH,et al.Chromosomal duplication accompanies allelic loss in non-small cell lung carcinoma[J].Cancer Res,1998,58(20):4701-4707.
[13]Kozubek M,Kozubek S,Lukasova E,et al.High-resolution cytometry of FISH dots in interphase cell nuclei[J].Cytometry,1999,36(4):279-293.
[14]Halling KC,King W,Sokolova IA,et al.A comparison of cytology and fluorescence in situ hybridization for the detection of urothelial carcinoma[J].J Urol,2000,164(5):1768-1775.
