啤酒废酵母中β-D-葡聚糖非降解提取工艺
2011-04-07朱益波翟丽君
朱益波,翟丽君,朱 明,齐 斌,*
(1.常熟理工学院生物与食品工程学院,江苏 常熟 215500;2.大富豪(常熟)啤酒有限公司,江苏 常熟 215500)
啤酒废酵母中β-D-葡聚糖非降解提取工艺
朱益波1,翟丽君1,朱 明2,齐 斌1,*
(1.常熟理工学院生物与食品工程学院,江苏 常熟 215500;2.大富豪(常熟)啤酒有限公司,江苏 常熟 215500)
采用单因素及正交试验研究新型非降解法提取废啤酒酵母β-D-葡聚糖工艺。该工艺主要包括诱导自溶、热水浸提、破壁、脱脂、蛋白酶处理等过程。结果表明,提取物中总糖质量百分含量为84.9%,得率为13.7%。与已有报道相比具备较高的纯度和得率。诱导自溶及热水浸提处理对于提取物的得率和纯度具有重要影响,蛋白酶处理对于进一步减少蛋白质含量和提高产物纯度也有显著作用。整个提取过程没有采用强酸、碱和氧化剂有助于保护产物的生理活性和环境。
废啤酒酵母;β-D-葡聚糖;非降解提取
近二十年来,国内的啤酒工业发展迅速,已经连续8年蝉联世界产量第一。有数据表明2010年1~11月份全国啤酒总产量已经达到近4240万吨,其中江苏省同期的产量达到250万吨,在全国30个主要啤酒生产省市中位列第5位。按照每吨啤酒产生1.5kg废酵母(干质量)计算[1],全国每年产生约6.36万吨废啤酒酵母。目前,对于废啤酒酵母的综合利用主要集中在酵母细胞的氨基酸、肽、蛋白资源,酵母抽提物调味品,β-葡聚糖、甘露糖以及活性酶类如超氧化物歧化酶等产品的生产与研究[2]。大量研究表明β-D-葡聚糖通过结合巨噬细胞特异性受体使其激活,加强了宿主的抵御能力进而表现出抗肿瘤、抗菌,促进伤口愈合以及免疫调节活性[3-5]。酵母细胞壁中主要成分包括甘露糖肽和β-D-葡聚糖,分别占细胞壁干物质量的40%和60%。因此,大量的废啤酒酵母成为制备β-D-葡聚糖的首选。但是β-D-葡聚糖的分离技术主要是基于早先开发的酸-碱提取法以及次氯酸钠细胞直接氧化法。这些方法会使大量葡聚糖降解,降低葡聚糖的得率并且显著影响生物学功能[5-6]。因此基于温和提取及酶处理的非降解工艺研究正逐步展开[7-8]。本研究旨在废啤酒酵母自溶的基础上研究新型β-D-葡聚糖非降解工艺,为废啤酒酵母的进一步综合利用提供参考。
1 材料与方法
1.1 材料与试剂
废啤酒酵母 大富豪啤酒(常熟)有限公司;中性蛋白酶 南宁庞博生物工程有限公司;其余试剂均为分析纯。
1.2 仪器与设备
UV-2550型紫外-可见光分光光度计 日本岛津公司;IKA-T18高速分散机 德国IKA公司;Alpha1-2真空冷冻干燥机 德国Christ公司。
1.3 方法
1.3.1 工艺流程
废酵母→洗涤→诱导自溶→热水浸提→破壁→脱脂→蛋白酶处理→冷冻干燥→葡聚糖
1.3.2 分析方法
粗蛋白含量测定:采用凯氏定氮法;可溶性蛋白含量测定:采用福林酚法;总脂肪含量测定:采用索式抽提法;总糖的测定:采用苯酚-硫酸法,以总糖的百分含量表示提取物中β-D-葡聚糖的相对纯度;游离α-氨基氮含量测定:采用甲醛滴定法;细胞破壁率及自溶率测定:采用文献[8]方法。

1.3.3 洗涤
废啤酒酵母经5% Na2CO3洗涤3遍,再用蒸馏水洗1遍,然后4000r/min离心5min,取沉淀。
1.3.4 诱导自溶单因素试验及正交优化
分别以pH值、NaCl质量分数、菌体质量浓度以及诱导温度进行单因素试验,并根据单因素试验结果设定各因素水平,设计L9(34)正交试验。自溶结束后80℃保持15min灭酶,离心洗涤自溶细胞并保存于4℃,并分别取样测定自溶液中游离α-氨基氮含量,计算游离α-氨基氮得率。
1.3.5 热水浸提
将自溶酵母细胞悬浮于50mmol/L pH7.5磷酸缓冲液中至终质量浓度100g/L,121℃处理6h,待降至室温后离心洗涤,沉淀保存于4℃。
1.3.6 细胞破壁单因素试验及正交优化
热水浸提处理后的细胞悬浮于磷酸缓冲液,分别以转速、时间和质量分数为单因素,进行高速分散机破壁处理,根据单因素试验结果选择各因素水平进行正交试验优化。
1.3.7 脱脂
取破壁后酵母细胞按1:4(g/mL)与丙酮配成悬液,水浴回流2h,离心收集上清,沉淀再用丙酮按1:1(g/mL)的比例洗涤3次,离心收集沉淀得到脱脂细胞壁。
1.3.8 蛋白酶处理
脱脂细胞壁悬浮于磷酸缓冲液至终浓度质量150g/L,在酵母(湿质量)中以每克酵母添加10000U的比例加入中性蛋白酶,并于55℃酶解5h,然后加热至80℃保温15min,离心洗涤直至上清液不含可溶性蛋白,沉淀即为含酵母细胞壁提取物。
1.3.9 真空冷冻干燥
将1.3.8节所得提取物置于冷阱中预冻6h,抽真空过夜冷冻干燥,4℃保存。
2 结果与分析
2.1 诱导自溶单因素试验及正交优化分析

图1 诱导自溶单因素试验结果Fig.1 Effects of temperature, pH, [NaCl] and cell density on induced yeast autolysis
图1表明温度、NaCl质量分数以及pH值对于诱导自溶影响较大,55℃诱导自溶游离氨基酸得率约是40℃条件下的3倍,3% NaCl的添加明显提高了氨基氮得率,而pH5.5自溶效果则是pH8.0的1.7倍。选择诱导温度50、55、60℃;NaCl质量分数1%、2%、3%;pH4.0、5.0、6.0;菌体质量浓度50、100、150g/L进行正交优化。正交优化结果(表1)表明诱导pH值、NaCl质量分数以及温度对于自溶程度具有较大的影响。虽然NaCl质量分数2%和3%对应的实验结果是一致的,但考虑到诱导自溶时间较长,3% N aCl质量分数更利于抑制杂菌的生长,所以选择3% NaCl自溶更为合适。菌体质量浓度对于实验结果影响很小,故选择150g/L菌悬液为优化结果进行后续试验。综上所述诱导自溶优化后最适条件分别为pH5.0、3% N aCl、温度55℃、菌体质量浓度150g/L。
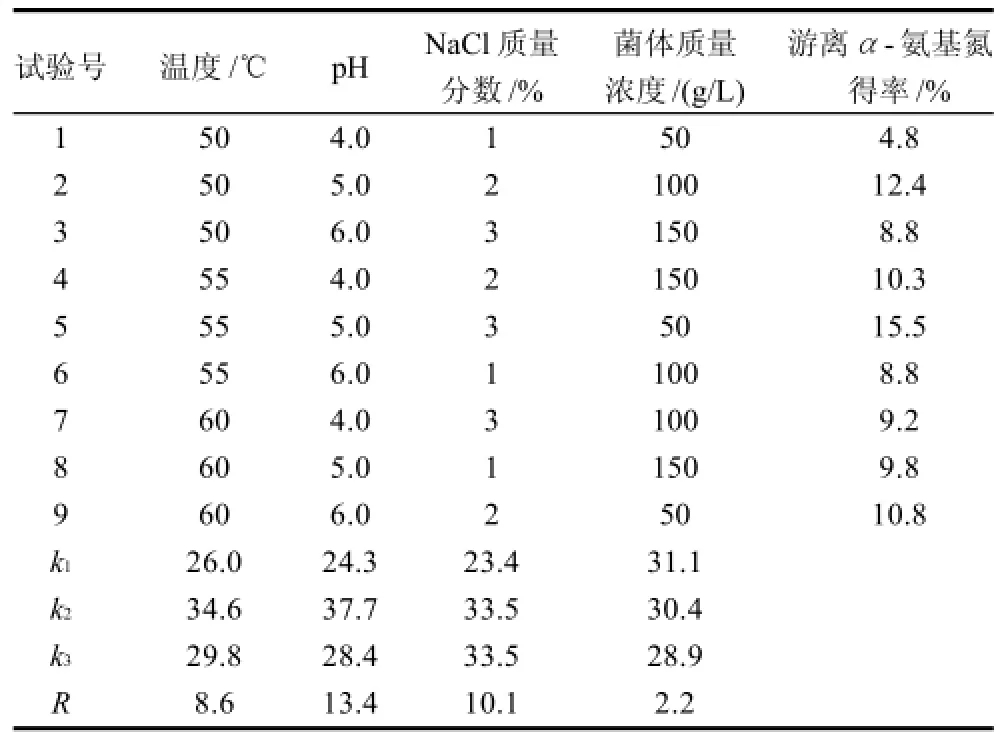
表1 诱导自溶正交试验结果Table 1 Orthogonal array design and corresponding experimental results for optimization of induced yeast autolysis
2.2 废酵母自溶过程中游离α-氨基氮及可溶性蛋白含量变化
酵母诱导自溶过程实质是细胞内多种水解酶作用于胞内物质,最终将其降解成小分子质量产物。该过程主要涉及到如磷酸酯酶、核糖核酸酶以及蛋白酶等水解酶类,这些酶原在特定条件下被激活,进而作用于相应底物,胞内的生物大分子被降解后积累于胞内,当被水解为能通过细胞壁的小分子时,水解产物则释放到胞外。水解酶同时也发生自身消化,水解活性随之降低,自溶作用逐渐停止[9]。本研究在优化了诱导自溶条件后,考查了废酵母细胞诱导自溶过程中游离α-氨基氮及可溶性蛋白的动力学变化规律(图2)。
游离α-氨基氮及可溶性蛋白在诱导自溶过程中表现出一致的动力学过程:在诱导自溶的前20h,游离α-氨基氮及可溶性蛋白的浓度持续上升,其中前12h的增长速度最高,12~20h逐渐减慢,20h以后浓度基本保持稳定状态。结果表明胞内蛋白在多种蛋白酶的作用下迅速被降解成肽及氨基酸等小分子物质,并很快释放至胞外;可溶性蛋白及游离α-氨基氮表现出一致的动力学曲线表明游离氨基酸和可溶性蛋白同时释放到胞外,这一现象可能暗示除了蛋白质发生了迅速的降解外,细胞壁和细胞膜也发生了较大的变化,以利于自溶物的迅速释放;24h诱导自溶后,可溶性蛋白含量达到稳定值,表明在该优化条件下经24h自溶已经达到稳定状态,此时酵母细胞的自溶率为46%,故24h可以作为自溶作用的最适时间。

图2 废酵母自溶过程曲线Fig.2 Time courses of induced spent yeast autolysis in term ofαamino nitrogen and soluble protein contents in supernatant
2.3 细胞破壁
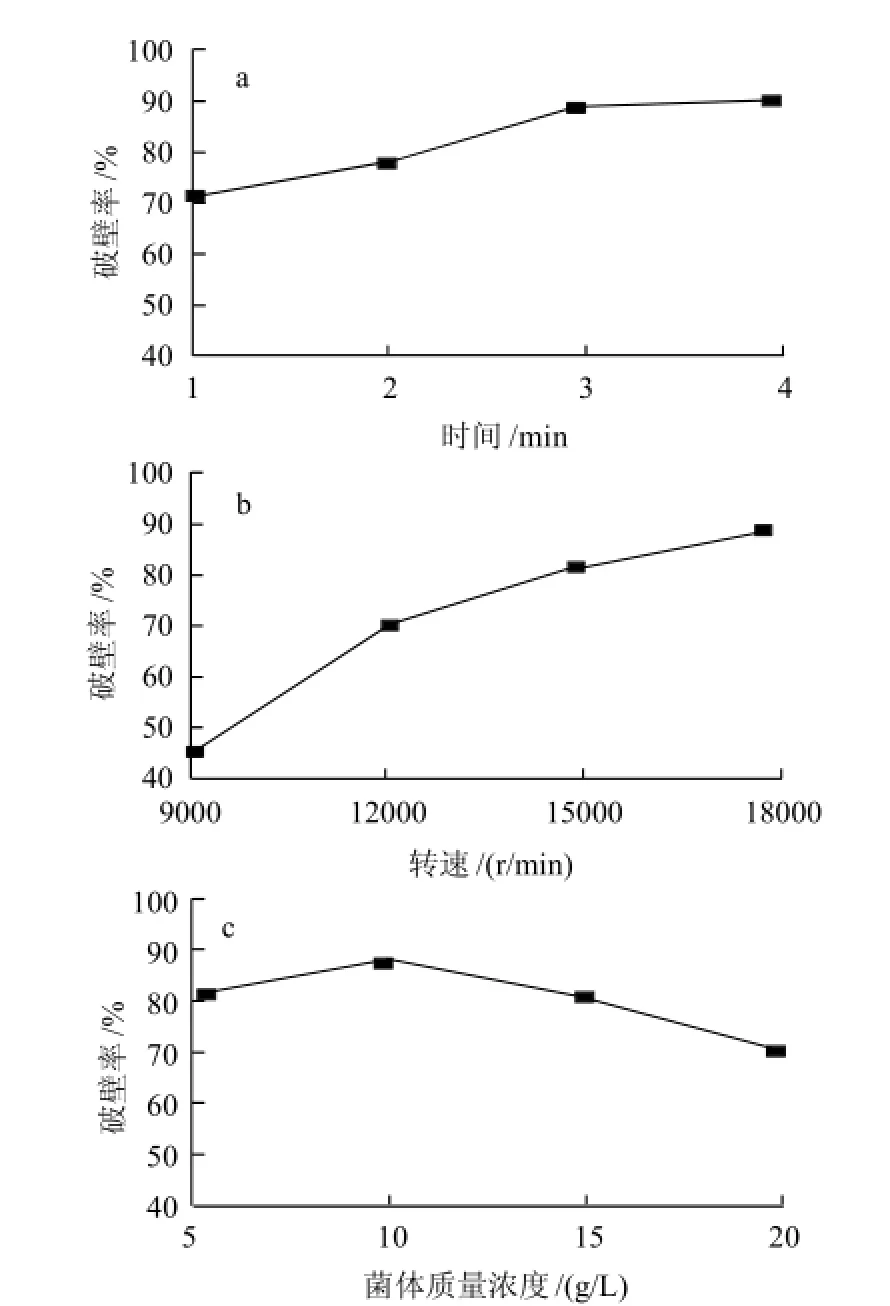
图3 时间(a)、转速(b)和菌体质量浓度(c)对细胞破壁率的影响Fig.3 Effects of duration, speed and cell density on percentage of disrupted cells
细胞破壁单因素试验结果(图3)表明破壁时间、转速以及菌体质量浓度对于破壁效果都有明显影响。综合图中结果选择破壁时间1、2、3min;转速12000、15000、18000r/min;菌体质量浓度50、100、150g/L进行正交优化。研究已经表明热水处理后的酵母细胞壁机械强度要远低于新鲜酵母细胞壁机械强度[8]。这可能是由于酵母细胞经热水处理后,细胞壁中大量的甘露糖蛋白被去除,从而降低了细胞壁的机械强度,提高了细胞壁的渗透性。该研究考查了在热水处理后高速分散机破壁的效果(表2),结果表明采用高速分散机破壁,转速和处理时间对破壁率有主要影响。各因素对破壁率影响的大小为转速>时间>菌体质量浓度。最佳条件为转速15000r/min、100g/L菌体质量浓度处理3min,破壁率达到95.5%。

表2 破壁正交试验结果Table 2 Orthogonal array design and corresponding experimental results for optimization of cell wall disruption
2.4 提取物成分分析

图4 提取物成分变化分析Fig.4 Physic-chemical analysis of extract
废啤酒酵母细胞经上述各项处理后,提取物的成分见图4所示。经自溶处理后,提取物中粗蛋白质量百分含量与酵母细胞相比下降约60%,热水处理后粗蛋白含量又进一步下降约50%,最终经蛋白酶处理后粗蛋白质量百分含量是2.2%,仅有酵母细胞粗蛋白含量的5%。经各项处理后,总糖质量百分含量基本呈现逐步上升的趋势:自溶后与原细胞相比,上升了约70%;热水处理后进一步上升约30%,进一步经脱脂和蛋白酶处理后最终总糖质量百分含量达到84.9%,相比酵母细胞的33.4%提高了154%;脂肪含量的变化表明在脱脂处理之前,总脂肪含量约为3%~5%之间,脱脂后脂肪含量下降到0.68%;各提取过程的固体质量(干质量)表明:自溶过程对于细胞物质量的减少最为显著,经自溶后质量减少了42.5%,这与约46%的自溶率较为一致,热水处理后物质量减少了39.5%,进一步经过脱脂处理和蛋白酶处理后,相对于酵母细胞,产品最终得率约为13.7%。
上述结果可以看出,粗蛋白随着提取过程而逐渐下降,总糖含量逐渐上升。其中酵母自溶和热水处理对粗蛋白的去除和总糖含量的提升最为明显。因此酵母自溶和热水处理对于该提取工艺具有重要影响。通过诱导自溶作用不仅可以释放大量的胞内物质,也可能促进了细胞膜和细胞壁成分向有助于提取β-D-葡聚糖的转变。热水处理后,大量甘露糖蛋白得以去除。有资料表明通过自溶和热水处理可以去除约83%的甘露糖蛋白,而其中89%是通过热水过程处理去除,这使得粗蛋白含量进一步明显下降,总糖百分含量进一步上升[8]。蛋白酶处理结果表明,蛋白酶能够进一步减少提取物中蛋白质含量,这可能是蛋白酶降解了细胞壁中残存的甘露糖蛋白,从而导致粗蛋白含量的降低。
2.5 不同提取方法结果比较
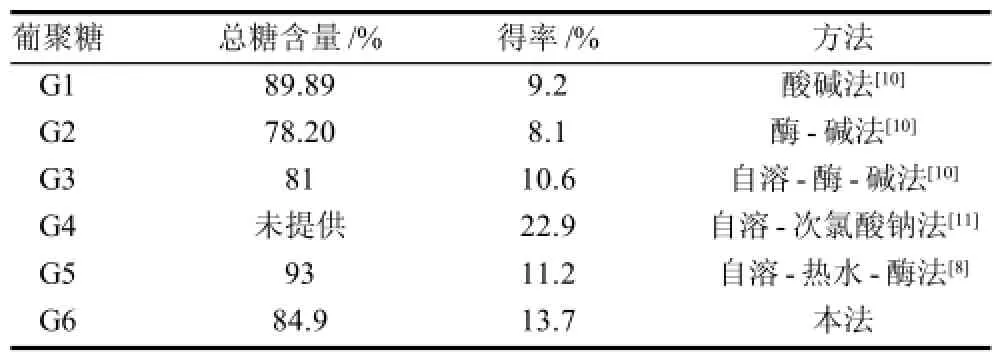
表3 不同提取方法结果比较Table 3 Comparison among different extraction methods on total sugar content and yield of extracts
本方法参考自溶-热水-酶解法提取废啤酒酵母细胞葡聚糖,工艺过程中没有采用酸、碱、氧化等较为强烈的处理方法,从而可有效避免葡聚糖的降解以及其结构的改变。由表3可知,与其他方法相比,本方法得率相对较高,总糖的含量也高于酶碱法和自溶酶碱法。
3 结 论
本研究在已有报道的基础上提出了非降解法提取废啤酒酵母细胞中β-D-葡聚糖的方法。结果表明废啤酒酵母经过洗涤、诱导自溶、热水浸提、破壁、脱脂、蛋白酶处理后总糖含量可以达到84.9%,最终得率为13.7%。该方法摒弃了传统的酸、碱及氧化剂的使用,不仅获得了较高的产品得率和总糖含量,而且有助于保持产品的原有结构、生理活性以及环境保护。为更好地综合利用大量废啤酒酵母提出了一个新的方法和参考。但是该方法与其他方法相比处理过程较为复杂,欲在实际中应用还需要将提取过程进一步整合和优化,比如缩短诱导自溶时间,采用新的方法和设备将细胞热水浸提甘露糖与破壁同时处理,以减少处理程序和成本,进一步提高产品纯度和得率。
[1] 李祥, 罗仓学. 啤酒酵母抽提物工业化生产[J]. 酿酒科技, 2002(2): 72-73.
[2] 孙伟峰, 周素梅, 王强. 废啤酒酵母综合利用研究进展[J]. 化工进展, 2008(7): 990-994.
[3] LIANG J S, MELICAN D, CAFRO L, et al. Enhanced clearance of a multiple antibiotic resistant Staphylococcus aureus in rats treated with PGG-glucan is associated with increased leukocyte counts and increased neutrophil oxidative burst activity[J]. Int J Immunopharmacol, 1998, 20 (11): 595-614.
[4] PATCHEN M L, LIANG J, VAUDRAIN T, et al. Mobilization of peripheral blood progenitor cells by Betafectin PGG-Glucan alone and in combination with granulocyte colony-stimulating factor[J]. Stem Cells, 1998, 16(3): 208-217.
[5] MUELLER A, RAPTIS J, RICE PJ, et al. The influence of glucan polymer structure and solution conformation on binding to (1->3)-beta-D-glucan receptors in a h uman monocyte-like cell line[J]. Glycobiology, 2000, 10(4): 339-346.
[6] MU..LLER A, ENSLEY H, PRETUS H, et al. The application of various protic acids in the extraction of from Saccharomyces cerevisiae[J]. Carbohydrate Research, 1997, 299(3): 203-208.
[7] FREIMUND S, SAUTER M, KAPPELI O, et al. A new non-degrading isolation process for 1,3-β-D-glucan of highpurity from baker's yeast Saccharomyces cerevisiae[J]. Carbohydrate Polymers, 2003, 54(2): 159-171.
[8] LIU Xiaoyong, WANG Qiang, CUI S W, et al. A new isolation method of β-D-glucans from spent yeast Saccharomyces cerevisiae[J]. Food Hydrocolloids, 2008, 22(2): 239-247.
[9] 宁正样. 酵母的自溶作用[J]. 食品科学, 1991, 12(12): 16-20.
[10] 王淮, 唐治玉, 熊善柏. 废啤酒酵母中β-1,3-葡聚糖的提取及成分分析[J]. 华中农业大学学报, 2005(6): 626-629.
[11] WANG Yajun, YAO Shanjing, WU Tianxing. Combination of induced autolysis and sodium hypochlorite oxidation for the production of Saccharomyces cerevisiae (1-3)-β-D-glucan[J]. World Journal of Microbiology and Biotechnology, 2003, 19(9): 947-952.
A Novel Method for Non-degradative Extraction of β-D-Glucans from Spent Yeast Cells
ZHU Yi-bo1,ZHAI Li-jun1,ZHU Ming2,QI Bin1,*
(1. School of Biotechnology and Food Engineering , Changshu Institute of Technology, Changshu 215500, China;2. Dafuhao Brewery (Changshu) Co. Ltd., Changshu 215500, China)
We here present a novel method to extract non-degraded β-D-glucans from spent yeast cells, mainly based on induced yeast autolysis, hot water extraction, cell wall disruption, defatting and protease hydrolysis. One-factor-at-a-time coupled with orthogonal array design method was applied to the process conditions of induced yeast autolysis and cell wall disruption. The extract obtained under optimized conditions had a total sugar content of 84.9% with an extraction yield of 13.7%. Its purity and yield were both higher than previously reported. Induced yeast autolysis and hot water extraction had a significant effect on β-D-glucan purity and yield. Moreover, protease treatment could further remove protein impurities and increase β-D-glucan purity. The absence of strong acid, strong alkali and oxidant throughout the process helped to protect the physiological activity of products and the environment.
spent yeast cell;β-D-glucans;non-degradative extraction
TS261.9
:A
1002-6630(2011)20-0121-05
2011-07-05
江苏省高校自然科学研究计划项目(08KJD180006)
朱益波(1980—),男,讲师,博士研究生,研究方向为基因工程与发酵工程。E-mail:centuryrain@126.com
*通信作者:齐斌(1965—),男,教授,博士后,研究方向为食品生物技术。E-mail:qibin65@126.com
