三维Ag/ZnO中空微球的制备及其抗菌性能
2011-04-07卢伟伟宋应利王键吉
卢伟伟,宋应利,张 军,王键吉
(河南科技大学化工与制药学院,河南洛阳471003)
0 前言
纳米无机抗菌剂与传统的有机抗菌剂和块状无机抗菌剂相比,具有稳定性好、安全性能高、抗菌谱广、效果持久、所需用量少等众多优点。近年来,在众多的无机抗菌剂中,Ag纳米粒子以及Ag+离子的抗菌性能已经被广泛研究和应用[1-7]。但在抗菌方面,单质Ag纳米粒子有别于Ag+离子,单质Ag纳米粒子的抗菌活性受到其粒径的影响极大,即粒径越小,其抗菌活性越高[2,7]。然而,随着粒径的减小,表面能的增加,Ag纳米粒子非常容易团聚,从而使其抗菌性能大大降低。同时,为了更经济的使用贵金属Ag,也需要寻找一种既不损害其功能又高效的方式来分散Ag纳米粒子。基于这种目的,Ag纳米粒子被担载于SiO、分子筛[9]以及碳纤维[10]等载体上来使用,然而这些载体却没有抗菌活性。而制备成本较低的ZnO作为另一种优良的无机抗菌剂,可以作为Ag纳米粒子的良好载体,从而形成Ag/ZnO复合材料应用于纳米抗菌研究。
本文在生物高分子海藻酸钠的辅助下,采用水热合成的方法制备了具有三维分层超结构的Ag/ZnO中空微球,利用场发射扫描电镜、高分辨透射电镜和光电子能谱等手段对其结构进行了表征,最后对其抗菌性能进行了研究。
1 试验部分
1.1 三维Ag/ZnO中空微球的制备
海藻酸钠购买自Acros,其他所有试剂均购自北京化学试剂有限公司。三维Ag/ZnO中空微球的制备过程如下:将1.5 mmol乙酸锌和适量硝酸银溶解于20 mL水和10 mL乙醇的混合溶剂中,在磁力搅拌下,向上述溶液中加入0.55 mL、25.4 mmol/L的海藻酸钠水溶液,然后再逐滴加入1.0 mL质量分数为28%的氨水,搅拌10 min左右转移到50 mL聚四氟乙烯内衬的高压反应釜中,旋紧釜盖,置于烘箱中393 K下恒温反应8 h。反应结束后,取出反应釜,自然冷却至室温,所得产物经离心分离,并用去离子水和乙醇洗涤数次,最后自然晾干,得到粉末状的Ag/ZnO样品。
1.2 样品的表征
样品形貌的FESEM观察在Hitachi S-4800场发射扫描电子扫描显微镜上进行。样品的TEM和 HRTEM表征分别在Hitachi H-800低分辨透射电镜及JEOL 2100高分辨透射电镜上进行。样品的表面性质及氧化态通过X射线光电子能谱在PHIQuantum 2000型XPS探针仪上进行表征。以各个样品中的烃基污染物中C 1s作为内标矫正样品中其他各元素的绝对电子结合能。样品表面的实际Ag含量通过灵敏度因子法进行计算。
1.3 抗菌性能测试
通过两种方法测定样品的抗菌性能:纸片扩散法(改性的Kirby-Bauer技术)和最小抑菌浓度(MIC)法。
1.3.1 定性的纸片扩散法
将蘸有ZnO或Ag/ZnO样品(直径大约5 mm)的圆形纸片置于事先接种的琼脂平板中,于37℃培养24 h后取出观察抑菌圈的大小。
1.3.2 定量MIC分析
称取不同量的Ag/ZnO样品倒入盛有20 mL LB培养液的三角烧瓶中,盖上透气棉塞放入灭菌锅中处理后,冷却。然后,于上述三角瓶中分别接种200μL(浓度为每毫升细菌菌落数为108个)的菌液,在振动摇床上恒温35℃振荡16 h。最后,取等量的溶液经梯度稀释后,分别涂于固体LB培养基上,采用平板计数法计算活菌数(取3个平板的平均值)。能够抑制细菌生长的最小样品浓度定义为此样品的最小抑菌浓度值(MIC值)。每个样品做3次平行,MIC值取其平均值。
2 结果与讨论
2.1 Ag/ZnO中空球的晶体微观结构
所制备的Ag/ZnO样品的FESEM表征如图1所示。从图1a和图1b所示的SEM电镜照片可以看出:样品整体上呈3~5μm的球形。图1c显示了一个破碎微球的一部分,从图1c可以看出:微球为中空,其球壁是由直径约100 nm、长度约1μm的纳米棒定向排列组成。而从图1d可以看出:微球表面并非光滑的,看到的为定向排列的纳米棒的顶端。

图1 Ag/ZnO中空微球的FESEM图
图2所示为对Ag/ZnO样品所做的TEM和HRTEM分析。图2a所示的破碎微球某部分的TEM图确认了在FESEM观察中得到的结论,即Ag/ZnO中空微球的球壁是由定向排列的纳米棒组成的。图2b所示的TEM图为散落于铜网上的某几根Ag/ZnO纳米棒,其中,ZnO和Ag的高分辨的二维晶格透射像分别如图2c和图2d所示。图2c中均匀的二维晶格条纹说明了ZnO的高度结晶性,其<0001>方向的晶格间距约为0.528 nm,近似等于六方晶系ZnO(0001)晶面的面间距,这说明ZnO是沿着<0001>方向择优生长的。结合图2a可知:所有组成微球的ZnO纳米棒都是沿着其生长方向垂直于微球表面而定向排列的。从图2d的HRTEM图还可以观察到多晶态Ag纳米粒子的不均匀晶格条纹,这也说明了所制备的样品是由金属Ag和半导体ZnO所组成的复合材料。

图2 样品的TEM和HRTEM图
为了进一步考察所制备Ag/ZnO中空微球的表面性质,样品进行了XPS分析。样品中元素的电子结合能都采用污染烃的C 1s峰(标准值284.6 eV)进行了矫正。样品的XPS全谱和Ag 3d能级的XPS窄谱如图3所示。图3a显示了纯ZnO和Ag的质量分数为2.13%的Ag/ZnO样品的XPS全谱,通过对比可以发现:Ag的峰仅出现在Ag/ZnO样品中。Ag/ZnO样品的Ag 3d XPS曲线如图3b所示,作为对比,所制得的纯Ag的XPS谱也同样列出。通过比较可以发现:Ag的质量分数为2.13%的Ag/ZnO样品中Ag电子结合能向低位移动,这表明在Ag/ZnO体系中,金属Ag向半导体ZnO转移电子,导致了Ag的电子密度减小而使Ag纳米粒子带部分正电荷。
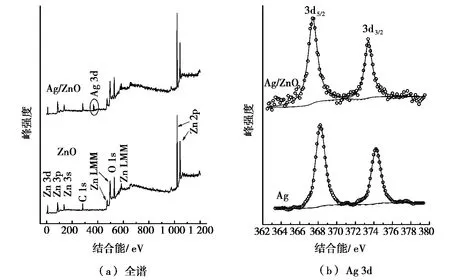
图3 样品的XPS图谱
2.2 样品抗菌性能的研究
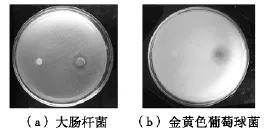
图4 ZnO和Ag/ZnO抑菌作用的定性纸片扩散法实验照片
许多的文献已经报道Ag纳米粒子具有强的抗菌作用[1-2],然而由于纳米Ag易于团聚,这大大降低了其抗菌性能。为了解决这个问题,在研究中,Ag纳米粒子被担载于ZnO上。除此之外,由于纳米Ag和ZnO纳米棒之间存在强的相互作用,在形成Ag/ZnO复合材料后,它们可能协同地发挥抗菌作用。本文考察了所制备的Ag的质量分数为2.13% 的Ag/ZnO样品对大肠杆菌和金黄色葡萄球菌的抗菌性能。样品对大肠杆菌和金黄色葡萄球菌的抗菌作用,分别做了纸片扩散的定性分析和测定MIC值的定量分析。定性的纸片扩散法得到的样品抑菌圈的照片如图4所示,从图4中可以看出:对大肠杆菌和金黄色葡萄球菌,Ag/ZnO样品的纸片周围都有明显的抑菌圈产生。这表明Ag/ZnO不仅对格兰氏阴性细菌而且对格兰氏阳性细菌也具有抗菌活性。
为了更进一步考察样品的抗菌性能,对Ag,ZnO和Ag/ZnO的MIC值进行了测定,其结果列于表1中,实验结果表明:Ag的质量分数为2.13%的Ag/ZnO样品对大肠杆菌和金黄色葡萄球菌的MIC值分别为600μg/mL和400μg/mL。如以Ag的量来计算,则Ag的质量分数为2.13%的Ag/ZnO样品对大肠杆菌抑菌值仅为12.8μg/mL,而对金黄色葡萄球菌则仅为8.5μg/mL。从表1中还可以看出:Ag纳米粒子的MIC值对大肠杆菌和金黄色葡萄球菌分别为15μg/mL和25μg/mL;纯ZnO的MIC值对大肠杆菌和金黄色葡萄球菌分别为3 500μg/mL和1 000μg/mL。因此,从实用性和经济性来说,Ag的质量分数为2.13%的Ag/ZnO微球的抗菌性能要远远高于纯的Ag和ZnO。
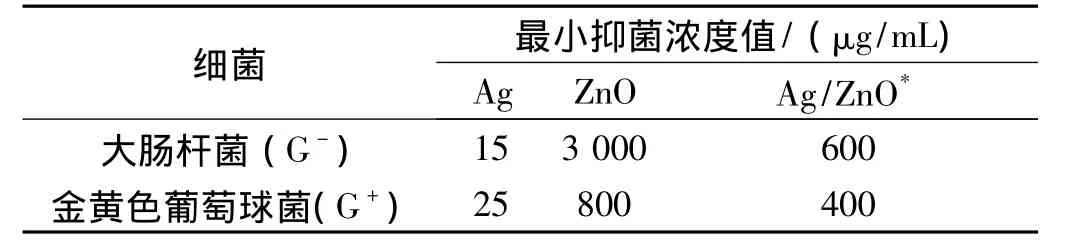
表1 Ag,ZnO和Ag/ZnO样品的最小抑菌浓度(MIC)值
从表1的数据可以看出:尽管Ag和 ZnO都具有抗菌活性,但它们对G-和G+细菌的抗菌效果不同,Ag对G-细菌的抗菌性能要好于对G+的抗菌性能,而ZnO则对G+的抗菌性能较好。这种现象分别在有关Ag[1]和ZnO[11-12]的抗菌文献中有过报道。因此,当Ag和ZnO结合形成Ag/ZnO复合材料时,Ag/ZnO同时对G-和G+细菌表现出了优异的抗菌性能;并且Ag/ZnO的抗菌效果并不是Ag和ZnO抗菌效果的简单相加而是相互协同加强的。
一方面,ZnO纳米棒作为载体减少了Ag纳米颗粒的团聚,从而使Ag纳米粒子有更多的机会接触细菌的细胞壁并和其中含有S和P的化合物反应。已有文献报道显示:Ag纳米粒子和细胞壁的这种相互作用,将影响细胞壁的渗透性和呼吸性能等而最终导致细菌的死亡[2,6]。另一方面,Ag纳米粒子和细菌之间的静电相互作用,在抗菌过程中也起到很大的作用[1-2]。在细菌存活的正常pH值,由于细胞壁上大量含羧基和其他基团化合物的脱落溶解,细菌表面总体上呈电负性[12]。并且由于体系中电子从金属Ag转移至ZnO,因此Ag/ZnO复合材料中的Ag纳米粒子和纯Ag纳米粒子相比具有很强的电正性。所以,正是由于Ag/ZnO中金属Ag和半导体ZnO的这种相互作用,导致了正电性的Ag和负电性的细菌之间静电作用的加强,从而提高了Ag/ZnO的抗菌性能。
3 结论
本文采用水热合成的方法制备了Ag含量不同的三维Ag/ZnO中空微球,对其结构进行了表征和抗菌性能的研究,结构表征结果说明:所制的样品为直径3~5μm的中空微球,其球壁是由直径约100 nm,长度约1μm的Ag/ZnO纳米棒沿着其生长方向并垂直于微球表面的定向排列所组成。这种新颖独特的自组装三维分层超结构的Ag/ZnO复合材料的形成,一方面有效解决了Ag纳米粒子和Ag/ZnO复合纳米棒在溶液中的团聚问题,而使所制备材料的抗菌性能大大提高;另一方面,由于Ag对格兰氏阴性细菌的抑制作用较强,而ZnO对格兰氏阳性细菌的抑制作用较强,而使Ag/ZnO复合材料表现出协同的高效抗菌性能。
[1] Shrivastava S,Bera T,Roy A,et al.Characterization of Enhanced Antibacterial Effects of Novel Silver Nanoparticles[J].Nanotechnology,2007,18(22):5103-5111.
[2] Morones J,Elechiguerra J,Camacho A,et al.The Bactericidal Effect of Silver Nanoparticles[J].Nanotechnology,2005,16 (10):2346-2353.
[3] Aymonier C,Schlotterbeck U,Antonietti L,et al.Hybrids of Silver Nanoparticles with Amphiphilic Hyperbranched Macromolecules Exhibiting Antimicrobial Properties[J].Chemical Communications,2002,24:3018-3019.
[4] Oyanedel C,Smith J.Sustainable Colloidal Silver Impregnated Ceramic Filter for Point of Use Water Treatment[J].Environmental Science&Technology,2008,42(3):927-933.
[5] GogoiS,Gopinath P,Paul A,etal.Green Fluorescent Protein-expressing Escherichia coli as a Model System for Investigating the Antimicrobial Activities of Silver Nanoparticles[J].Langmuir,2006,22(22):9322-9328.
[6] Baker C,Pradhan A,Pakstis L,et al.Synthesis and Antibacterial Properties of Silver Nanoparticles[J].Journal of Nanoscience and Nanotechnology,2005,5(2):244-249.
[7] Siekkinen A R.Synthesis of Silver Nanoplates at High Yields by Slowing Down the Polyol Reduction of Silver Nitrate with Polyacrylamide[J].Journal of Materials Chemistry,2007,17(25):2600-2602.
[8] Yoon K Y,Byeon JH,Park CW,et al.Antimicrobial Effect of Silver Particles on Bacterial Contamination of Activated Carbon Fibers[J].Environmental Science&Technology,2008,42(4):1251-1255.
[9] Yamamoto O,Nakakoshi K,Sasamoto T,etal.Adsorption and Growth Inhibition of Bacteria on Carbon Materials Containing Zinc Oxide[J].Carbon,2001,39(11):1643-1651.
[10] Sawai J.Quantitative Evaluation of Antibacterial Activities of Metallic Oxide Powders(ZnO,MgO and CaO)by Conductimetric Assay[J].Journal of Microbiological Methods,2003,54(2):177-182.
[11] Thiel J,Pakstis L,Buzby S,et al.Antibacterial Properties of Silver-doped Titania[J].Small,2007,3(5):799-803.
[12] Stoimenov PK,Klinger R,Marchin G L,et al.Metal Oxide Nanoparticles as Bactericidal Agents[J].Langmuir,2002,18 (17):6679-6686.
