葡萄籽原花青素对顺铂所致人胚肾细胞毒性的拮抗作用
2011-04-01高丽萍冷洪涛张海莲
李 贞,高丽萍*,冷洪涛,张海莲
(北京联合大学应用文理学院,生物活性物质与功能食品北京市重点实验室,北京 100083)
葡萄籽原花青素对顺铂所致人胚肾细胞毒性的拮抗作用
李 贞,高丽萍*,冷洪涛,张海莲
(北京联合大学应用文理学院,生物活性物质与功能食品北京市重点实验室,北京 100083)
目的:体外研究葡萄籽原花青素提取物(GSPE)对顺铂(CDDP)所致人胚肾细胞毒性的保护作用,并探讨其可能的机理。方法:体外培养人胚肾细胞(HEK293),四甲基偶氮噻唑蓝(MTT)法观察葡萄籽原花青素、CDDP对HEK293细胞生长的影响及葡萄籽原花青素对CDDP所致细胞毒性的保护作用,硫代巴比妥酸法观察葡萄籽原花青素对CDDP引起脂质过氧化的影响,利用二硫代二硝基苯甲酸与巯基化合物反应,比色定量测定吸光度以观察葡萄籽原花青素对CDDP诱导的谷胱甘肽耗竭的影响。结果:低浓度的GSPE可显著增强HEK293的细胞活性,适宜浓度的GSPE可显著抑制CDDP对HEK293细胞的毒性作用,GSPE可减缓CDDP引起的谷胱甘肽的耗竭。结论:GSPE能抑制CDDP诱发HEK293细胞的细胞毒性,其机理可能与GSPE强抗氧化功能和猝灭自由基的功能有关。
顺铂;葡萄籽原花青素提取物;肾毒性;HEK293;氧化应激
顺铂(cis-diamminedichloroplatinum,CDDP)是临床上广泛使用的化疗药物,普遍用于各种实体瘤的治疗,但是CDDP的肾毒性明显,且限制了其临床使用。目前,CDDP所致的肾毒性机制尚不十分清楚。研究表明,CDDP在机体中破坏氧自由基代谢的平衡状态,从而引发氧化应激[1]。原花青素属黄酮类物质,在植物性食品中广泛存在,其具有极强的抗氧化能力,还可以降低血压、调节血脂、保护心脑血管,此外原花青素还有抗心肌缺血再灌注损伤、抗动脉粥样硬化、抗脂质过氧化、抗炎、抗肿瘤、抗衰老、抗突变等功能[2-7]。因此本研究采用人胚肾细胞293(HEK293)细胞体外观察葡萄籽原花青素提取物(grape seed proanthocyanidinextract,GSPE)对CDDP肾毒性的保护作用,并探讨其可能的作用机理。
1 材料与方法
1.1 材料、试剂与仪器
HEK293细胞由北京师范大学提供 。
顺铂(注射用粉剂,批号906015CF,临用前用生理盐水配制) 齐鲁制药厂;葡萄籽原花青素提取物(纯度大于95%,蒸馏水溶解后过滤除菌避光保存,用时用DMEM培养液稀释到所需浓度) 天津尖峰天然产物研究开发有限公司;新生牛血清及DMEM培养液 美国Gibco公司;四甲基偶氮噻唑蓝(MTT) 美国Sigma公司;丙二醛(MDA)、谷胱甘肽(GSH)测定试剂盒 南京建成生物工程研究所;其他试剂均为分析纯。
1.2 细胞培养
HEK293细胞,培养基为含双抗(100U/mL青霉素,100μg/mL链霉素)及10%新生牛血清的DMED(含丙酮酸钠),于37℃、含5%CO2的孵育培养箱中培养。取处于指数生长期的细胞用于实验。
1.3 细胞毒性实验
采用MTT比色法[8]测定CDDP、GSPE对HEK293细胞毒性作用,及GSPE对CDDP所致细胞毒性的影响。
1.3.1 CDDP对HEK293的毒性作用
将100μL(1×105个/mL)HEK293细胞接种到96孔板中,待细胞生长至融合状态时,加入不同浓度的CDDP生理盐水溶液(终浓度分别为0、0.016、0.03125、0.0625、0.125、0.25、0.5、1、2、4mmol/L),每组设6个复孔,在37℃、含5%CO2的孵育培养箱中培养24h。
1.3.2 MTT法
按照1.3.1节对细胞进行药物处理,培养至24h终末,向培养基中加入MTT,使终质量浓度为0.5g/L,于37℃、含5% CO2的孵育培养箱中培养4h,弃上清并加入DMSO(100μL/孔),混匀10min,用酶标仪检测(测定波长570nm,参比波长630nm)吸光度(A),以CDDP添加浓度为0时作为空白对照组,细胞抑制率的计算方法为:
细胞抑制率/%=(1-A实验组/A空白对照组)×100 (1)
1.3.3 GSPE对HEK293细胞生长的影响
细胞培养方法同1.3.1节,待细胞生长至融合状态时,加入不同浓度的GSPE(终质量浓度分别为0、0.001、0.002、0.004、0.008、0.016、0.032、0.064、0.128、0.256、0.512、1.024、4.096、8.192、16.384、32.768g/L),每组设6个复孔,在37℃、含5% CO2的孵育培养箱中培养24h后,使用MTT法测定吸光度,观察GSPE对HEK293细胞生长的影响。

1.3.4 GSPE对CDDP所致细胞毒性的保护作用
细胞消化、终止消化、计数、调整密度为(1×105个/mL)后,每孔100μL进行铺板,37℃、含5% CO2的孵育培养箱中培养至融合状态,进行实验。细胞分组为:空白对照组:CDDP终浓度0mmol/L、GSPE终质量浓度0g/L,使用含10%新生牛血清的DMEM进行培养(加药时同时相应加入与模型组、用药组等体积的DMEM培养液和生理盐水孵育);模型组:以0.094mmol/L CDDP在37℃、含5% CO2的孵育培养箱中培养24h方法造模;CDDP+GSPE组:加CDDP前30min加入不同质量浓度的GSPE(终质量浓度分别为:0.008、0.016、0.032、0.064、0.128、0.256、0.512、1.024g/L)。每组设8个复孔,采用MTT法测定吸光度,计算细胞抑制率变化,并以图表示。
1.4 细胞内MDA、GSH、蛋白含量的测定
按照参考文献[9]将HEK293细胞(1×105个/mL)3mL接种到6孔板中,待细胞生长至融合状态时,加入终质量浓度为0.512g/L的GSPE培养液,30min后加入终浓度为0.094mmol/L的CDDP,37℃、含5% CO2的孵育培养箱中培养24h,终止培养,消化细胞并收集,PBS洗两遍,离心弃上清,每孔细胞加入0.7mL生理盐水,反复冻融3次,3000r/min离心15min,取上清为细胞匀浆,严格按照MDA含量、GSH含量和蛋白含量测定试剂盒所述方法测定。
1.5 统计分析
采用SPSS软件进行统计分析。单因素方差分析判断GSPE 对CDDP毒性的影响。多功能半数致死量软件2.1版(Sun Yat-Sen University of Medical Sciences)Bliss法计算半数抑制浓度(IC50)。
2 结果与分析
2.1 CDDP对HEK293细胞的毒性作用
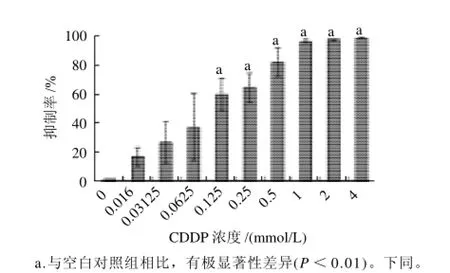
图1 CDDP对HEK293的毒性作用Fig.1 Toxic effect of CDDP on HEK293 cells
如图1所示,MTT法测定CDDP对HEK293细胞的抑制作用。随CDDP浓度升高,细胞抑制率增大,呈明显的剂量依赖关系,24h的IC50值为(0.094±0.02)mmol/L。
2.2 GSPE对HEK293细胞存活率的影响

图2 GSPE对HEK293存活率的影响Fig.2 Effect of GSPE on the viability of HEK293 cells
如图2所示,MTT法测定GSPE对HEK293细胞存活率的影响。随GSPE质量浓度升高,细胞存活率逐渐增高,GSPE终质量浓度为0.064g/L时,细胞存活率达到最高,以后随着质量浓度的增加,细胞存活率反而逐渐降低,GSPE终质量浓度高于0.256g/L时,细胞存活率明显低于空白对照组,即高质量浓度GSPE对细胞具有毒性作用,抑制了细胞的生长。GSPE 24h的IC50值为(1.9165±0.04)g/L。
2.3 GSPE对CDDP所致细胞毒性的影响

图3 GSPE对CDDP所致毒性的抑制作用Fig.3 Protective effect of GSPE against CDDP-induced neurotoxicity in HEK293 cells
如图3所示,用终浓度0.094mmol/L的CDDP孵育HEK293 24h建立毒性模型,用不同终质量浓度的GSPE拮抗细胞毒性,可见细胞存活率随着GSPE质量浓度升高而增高。其中终质量浓度为0.256、0.512、1.024g/L的GSPE可显著降低CDDP对HEK293细胞的抑制作用,提高细胞的存活率,且0.512g/L细胞存活率最高,提示适当剂量的GSPE对CDDP所致细胞毒性具有保护作用。
2.4 GSPE对CDDP所致细胞MDA、GSH含量的影响
如图4、5所示,终浓度为0.094mmol/L的CDDP作用于HEK293细胞24h后,细胞内MDA含量与空白对照组相比显著升高、GSH含量显著降低。终质量浓度为0.512g/L的GSPE预处理30min后,再与0.094mmol/L的CDDP孵育24h,细胞内MDA含量与模型组无显著差异,GSH明显升高,与模型组相比有显著性差异。

图4 GSPE对CDDP作用细胞MDA含量的影响Fig.4 Effect of GSPE on MDA content in CDDP-induced HEK 293 cells

图5 GSPE对CDDP作用细胞GSH含量的影响Fig.5 Effect of GSPE on GSH content in CDDP-induced HEK 293 cells
3 讨 论
CDDP进入机体后主要经肾脏排泄,其毒副作用也以肾脏毒性最为明显,CDDP选择性地作用于肾细胞使其受损。本研究以不同浓度CDDP加入HEK293细胞中培养造模,发现在培养24h后各模型组吸光度与空白对照组相比较均有显著性差异,提示只要持续作用,即使低浓度CDDP仍可引起肾细胞受损,因此应引起临床医生的高度重视。
CDDP肾毒性的细胞毒机理仍不明,有证据显示,CDDP引起肾功能损害的主要原因可能是与氧化应激有关的氧化性损伤[10-11]。CDDP引起肾脏损伤的主要成分是其水解代谢产物,CDDP的亲核基团可与水分子作用产生大量的自由基,自由基与生物膜上不饱和脂肪酸反应,引起膜脂质过氧化,导致膜通透性和膜脂质流动性的改变,同时产生多种有毒的降解产物。脂质过氧化主要产物MDA既是其结果,又是继发损害的毒性产物,其含量变化可反映体内自由基代谢的异常及脂质过氧化速率,因此MDA含量高低既反映机体脂质过氧化的程度,也间接反映受自由基攻击致肾损害的严重程度。GSH是非蛋白巯基的一种,是细胞内主要抗氧化防御系统,肾脏对GSH的利用能力对细胞抵抗各种化学毒物损伤上起重要作用[12]。有资料表明,GSH及其前体物N-乙酰半胱氨酸(NAC)中的巯基可与CDDP结合;GSH可降低细胞内铂(Pt)含量;此外,GSH可显著提高CDDP的细胞存活率,这些可能是GSH在CDDP所致肾毒性中起保护作用的原因[13]。本研究结果显示,加入CDDP后,HEK293细胞MDA的含量明显升高,GSH含量明显降低,表明CDDP诱发 HEK293细胞的损伤与氧化应激密切相关。
花青素属生物黄酮类,可从许多植物中提取得到,花青素化学结构上的酚羟基很容易被氧化成醌类结构,从而能够消耗环境中的氧,对自由基有很强的捕捉和消除能力,在体内抗氧化消除自由基的能力很强,是一种很好的氧自由基清除剂。本研究结果显示:在一定浓度范围内,随着GSPE浓度的增加,HEK293细胞的存活率逐渐增加,并且适当剂量的GSPE可显著降低CDDP对HEK293细胞的抑制作用,抑制CDDP造成GSH含量的下降,提示适当剂量的GSPE对CDDP毒性作用的细胞具有保护作用,其保护作用的机制可能是GSPE抑制了CDDP引起的GSH耗竭,从而抑制了CDDP引起的细胞损伤,提高了细胞的生存率。
[1] SOMANI S M, RAVI R, RYBAK L P. Diethyldithioccarbamate protection against cisplatin nephrotoxicity: antioxidant system[J]. Drug Chem Toxicol, 1995, 18(2/3): 151-170.
[2] PATAKI T, BAK I, KOVACS P, et al. Grape seed proanthocyanidins improved cardiac recovery during reperfusion after ischemia in isolated rat hearts[J]. Am J Clin Nutr, 2002, 75(5): 894-905.
[3] 毕玲, 傅柏平. 葡萄籽原花青素提取物的研究进展[J]. 中国新药杂志, 2008, 17(17): 1478-1481.
[4] 郭金英, 李松彪, 刘开永, 等. 葡萄籽超微粉对高血脂金黄地鼠血浆NO、ET-1和C反应蛋白的影响[J]. 营养卫生, 2008, 29(9): 598-600.
[5] 郭金英, 李华, 袁春龙, 等. 葡萄籽超微粉对金黄地鼠血脂水平的影响[J]. 中国食品学报, 2007, 7(1): 48-53.
[6] 张琳, 买买提祖农·买苏尔, 袁一木, 等. 葡萄籽原花青素对大鼠肝缺血再灌注损伤的抗氧化作用研究[J]. 新疆医科大学学报, 2010, 33(2): 121-123.
[7] 李华, 李佩洪, 李勇, 等. 葡萄籽超微粉体外消化后抗氧化能力的检测[J]. 食品与发酵工业, 2008, 34(10): 149-152.
[8] MOSMANN T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays[J]. J Immunol Methods, 1983, 65(1/2): 55-63.
[9] LEAL L K, NOBRE JUNIOR H V, CUNHA G M, et al. Amburoside A, a glucoside from Amburana cearensis, protects mesencephalic cells against 6-hydroxydopamine-induced neurotoxicity[J]. Neurosci Lett, 2005, 388(2): 86-90.
[10] 方允中. 自由基与酶[M]. 北京: 科学出版社, 1989: 229.
[11] CHIRINO Y I, PEDRAZA-CHAVERRI J. Role of oxidative and nitrosative stress in cisplatin-induced nephrotoxicity[J]. Experimental and Toxicologic Pathology, 2009, 61(3): 223-242.
[12] 杨敬华, 徐兆发, 徐斌, 等. 镉致大鼠肾脏毒性机制研究[J]. 中国公共卫生, 2007, 23(7): 887-888.
[13] 卢永科, 李昱辰, 杜伯雨, 等. 非蛋白巯基对顺铂在HEK293细胞内积累量的影响[J]. 卫生毒理学杂志, 2004, 18(3): 167-168.
Protective Effect of Grape Seed Proanthocyanidin Extract against Cisplatin-induced Nephrotoxicity in HEK293 Cell
LI Zhen,GAO Li-ping*,LENG Hong-tao,ZHANG Hai-lian
(Beijing Municipal Key Laboratory of Biologically Active Substances and Functional Food, College of Arts and Science, Beijing Union University, Beijing 100083, China)
Objective: To investigate the protective effect of grape seed proanthocyanidin extract (GSPE) against cisplatin (CDDP)-induced nephrotoxicity in human embryo kidney (HEK) 293 cells and its possible mechanisms. Methods: The effects of GSPE and CDDP on the in vitro growth of HEK 293 cells and the effect of GSPE on CDDP-induced nephrotoxicity were observed by MTT assay. TBARS assay was used to evaluate the effect of GSPE on GSPE-induced lipid peroxidation. The effect of GSPE on CDDP-induced glutathione depletion was examined by colorimetrically determining absorbance resulting from the reaction between DTNB and hydroxyl compounds. Low concentrations of GSPE could remarkably enhance the activity of HEK 293 cells. CDDP-induced nephrotoxicity in these cells was obviously inhibited by appropriate concentrations of GSPE. Additionally, GSPE could also alleviate CDDP-induced glutathione depletion. Conclusion: GSPE has the potential to inhibit CDDP-induced nephrotoxicity in HEK 293 cells, and the possible mechanism is associated with the strong antioxidant function and free radical quenching activity of GSPE.
cisplatin;GSPE;nephrotoxicity;HEK293;oxidative stress
Q946.8
A
1002-6630(2011)07-0315-04
2010-08-22
北京市教委面上项目(KM200911417004)
李贞(1986—),女,硕士研究生,研究方向为功能性食品生化作用。E-mail:babylizhen@163.com
*通信作者:高丽萍(1962—),女,教授,博士,研究方向为功能性食品生化作用。E-mail:gaolip62@163.com
