人参锈腐病拮抗放线菌的鉴定及发酵条件1)
2011-03-29姜云陈长卿王琳马贵龙
姜云 陈长卿 王琳 马贵龙
(吉林农业大学,长春,130118)
人参锈腐病(Cylindrocarpon destructans)是对人参根部危害最大的1种土传病害,对人参产量和品质影响极大,常年发病率为24.9%~44.1%[1],目前仍没有较好的解决办法,已成为人参连作的主要障碍。凡种过人参的土地,在几十年内不能再植参,否则大部分乃至整个参根都会腐烂[2-3]。近年来,用化学防治措施来防治人参锈腐病的结果远远未达到人们预想的效果,而且过量使用化学农药会破坏土壤的微生物环境,加重环境污染,也使得有毒物质在参根内大量积累,降低人参的商品价值,因此,人们把防治重点逐步转向生物防治措施和农业防治措施上[4-5]。其中农用抗生素由于其具有无污染、不易使有害生物产生抗药性等特点而成为重要的生物防治措施。农用抗生素来源于微生物,特别是放线菌[6]。目前从微生物中发现的大约8 000种生物活性物质中,近70%是由放线菌产生的[7]。本研究对采自吉林省人参主要种植区(集安市、通化市等)的土壤样品进行了拮抗放线菌的筛选[8],对优良菌株1a-3进行了鉴定并对其培养配方和发酵条件进行了研究,以便为抗生物质的分离提纯提供试验依据,为进一步的小试和中试生产奠定基础。
1 材料与方法
1.1 材料
主要试剂和仪器:试剂均为国产分析纯;主要仪器为基恩士国际贸易有限公司的数码显微镜(KEYENCE VHX-600),太仓市实验设备厂的恒温振荡培养箱(HZQX100),德国KONTRON公司的高速冷冻离心机(T-42K),上海精密科学仪器有限公司的酸度计(PHS-3C),Ultra-Violet Products Ltd公司的自动凝胶图像分析仪(GelDoc-It 200)。
菌株及保存:菌株1a-3按常规方法在高氏一号培养基上繁殖保存。
基础发酵培养基(同种子培养基):每升含大豆粉20 g,葡萄糖10 g、NaCl 10 g、CaCO33 g、KH2PO41 g,pH值7.0。
1.2 菌株鉴定
形态学观察:①采用插片法[9]将菌株1a-3划线接种在高氏一号培养基上,同时将灭菌的盖玻片(1 cm×1 cm)斜插入培养基内,28℃培养5 d后,取出盖玻片在生物显微镜下观察菌丝形态。②取在高氏一号平板上培养7 d的菌株1a-3进行扫描电镜样品加工处理。样品用3%戊二醛室温下固定4~6 h,后经系列丙酮脱水、CO2临界点干燥、粘样、镀膜后在扫描电镜下观察菌丝和孢子形态。
培养特征和生理生化特征:参照《链霉菌鉴定手册》[10]中推荐的部分培养基和方法进行,28℃培养12~15 d后观察记录特征。
细胞壁化学成分分析:采用快速薄板层析法[11-12]对菌株1a-3的细胞进行全细胞水解液氨基酸和糖型的分析。
分子鉴定:按照徐平的方法[13]提取菌株1a-3基因组DNA,采用通用引物[14](F:5'-AGAGTTTGATCCTGGCTCA G-3';R:5'-AAGGAGGTGATCCAGCCGCA-3')进行16 S rDNA的PCR扩增,经回收、连接和转化后,在测序仪上进行测序,将所得序列与GenBank数据库中序列进行BLAST分析比对,并选取相似性较高的菌株与菌株1a-3用MEGA4.0软件构建系统进化树。
1.3 菌株发酵培养及抑菌活性的测定
菌株发酵培养及发酵上清液的制备:发酵培养首先在种子培养基上28℃振荡培养24 h(150 r/min)制成种子液;然后加3 mL种子液在基础发酵培养基中(30 mL),于28℃振荡培养(200 r/min)72 h后,10 000 r/min离心10 min,取上清液备用。
混菌法测定发酵上清液的抑菌活性:将1 mL无菌水加入人参锈腐病菌的培养试管中,用接种针将菌丝和孢子刮下制成菌悬液与PDA培养基10 mL混合后到入9 cm的培养皿中制成平板,用直径1 cm的打孔器在固体平板中打孔,然后向孔中加入发酵上清液200μL,25℃培养3d后测定抑菌圈大小。
1.4 发酵条件的研究
不同碳、氮源对发酵液抑菌活性的影响:在氮源质量浓度和其它培养条件不变的情况下[15],分别用蔗糖、麦芽糖、甘油、正丁醇、玉米粉、淀粉等量替换基础发酵培养基中的葡萄糖;在碳源质量浓度和其它培养条件不变的情况下,分别用酵母粉、蛋白胨、牛肉膏、硝酸铵、硝酸钾、硝酸钠等量替换基础发酵培养基中的大豆粉,以基础发酵培养基作对照,采用混菌法测定不同碳、氮源的发酵上清液对C.destructans抑菌活性的影响。
碳、氮源单因子试验和正交试验:在确定主要碳、氮源的基础上,对大豆粉(0~22 g/L,按2 g/L递增)、葡萄糖(0~6 g/L,按1 g/L递增)、酵母粉(0~0.5 g/L,按0.1 g/L递增)、玉米粉(0~18 g/L,以1.5 g/L递增)进行单因子试验,以确定其合适使用的质量浓度梯度。在此基础上选择L9(34)的正交试验进行发酵抑菌试验,因子水平见表1,发酵试验重复3次,用混菌法测定抑菌活性,将3次的平均值作为试验结果[16],进行分析和统计后确定发酵配方。

表1 基于L9(34)的发酵抑菌试验的因子水平
培养条件的摸索:在确定发酵培养基成分后测定不同培养条件下发酵液对C.destructans的抑菌活性,测定方法用混菌法,①种龄试验。取30 mL种子培养基装入250 mL三角瓶中,种子培养基成分同发酵培养基,用直径10 mm的打孔器打取1块1a-3菌碟接入种子培养基中,分别培养12、24、36、48、60、72 h后,以10%的接种量将其分别接种在发酵培养基中。②接种量试验。在其它培养条件一致的条件下,将种子液分别以体积分数2%、4%、6%、8%和10%的水平接种到发酵培养基中,测定各摇瓶中发酵液的抑菌活性。③初始pH试验。在其它培养条件一致的条件下,用酸度计将培养基的起始pH值(灭菌前pH值)分别调至5.0、6.0、7.0、8.0、9.0摇床培养后,测定各摇瓶中发酵液的抑菌活性。④发酵温度试验。在其它培养条件一致的条件下,分别在24、28、32℃恒温摇床培养,测量各摇瓶中发酵液的抑菌活性。⑤发酵时间试验。在其它培养条件一致的条件下,发酵分别培养12~120 h(12 h递增),测定各摇瓶中发酵液的抑菌活性。
2 结果与分析
2.1 菌株鉴定
2.1.1 形态学观察
通过光学显微镜和电子显微镜观察发现,菌株1a-3的孢子丝呈宽大顶端螺旋形,带有长柄,孢子柱形,表面光滑,常在气生菌丝上形成长孢子链(图1)。

图1 菌株1a-3的菌丝和孢子形态
2.1.2 培养特征和生理生化特征
菌株1a-3在不同培养基上的培养结果见表2,其中在高氏一号培养基上气生菌丝呈银鼠灰色,菌落有水珠,长势饱满,基内菌丝黄色,有可溶性色素产生。生理生化测定结果表明,菌株1a-3能使明胶液化,淀粉水解,牛奶凝固,产生H2S,但不能在纤维素上生长;耐盐性结果表明,菌株1a-3只能忍受5 g/L以下的盐胁迫,在7~25 g/L盐胁迫培养基上不生长。
2.1.3 细胞壁化学成分
细胞壁化学成分分析显示,菌株1a-3含LL-二氨基庚二酸和甘氨酸;无特征性糖,糖型C。因此其细胞壁化学组分属于Ⅰ型,符合链霉菌(Streptomyces)的化学分类特性。
2.1.4 分子鉴定
菌株1a-3 16 S rDNA的PCR扩增得到了1条1 500 bp左右大小的条带,将测序所得的1 525 bp DNA序列与NCBI数据库Blast比对,登录号为HM560727。与其同源性较高的菌株均属于链霉菌属,选取8株模式菌株进行系统发育分析,用MEGA4.0构建系统进化树(图2),可以看出菌株1a-3与S.griseochromogenes(AB184387)聚于同一分支中,其相似性达到99%。
2.2 发酵条件
不同碳、氮源对发酵液抑菌活性影响:在供试的6种碳源中(表3),除了淀粉为碳源时不产生抑菌圈外,其它碳源的抑菌活性都低于葡萄糖(对照),在发酵过程中常选用速效碳源和缓慢碳源混合作为碳源,结合应用成本考虑,选用葡萄糖与玉米粉复合使用,作为本试验碳源。在供试的6种氮源中(表4),以硝酸铵、硝酸钾、硝酸钠为氮源时无抗菌物质产生,对无机氮源的利用不好,而有机氮源中以大豆粉为氮源时产素能力最强,当以酵母粉单独作氮源时,抑菌效果虽然一般,但酵母粉有提供氮源又促进发酵的双重作用,所以选择大豆粉和酵母粉作为氮源。

表2 菌株1a-3的培养特征
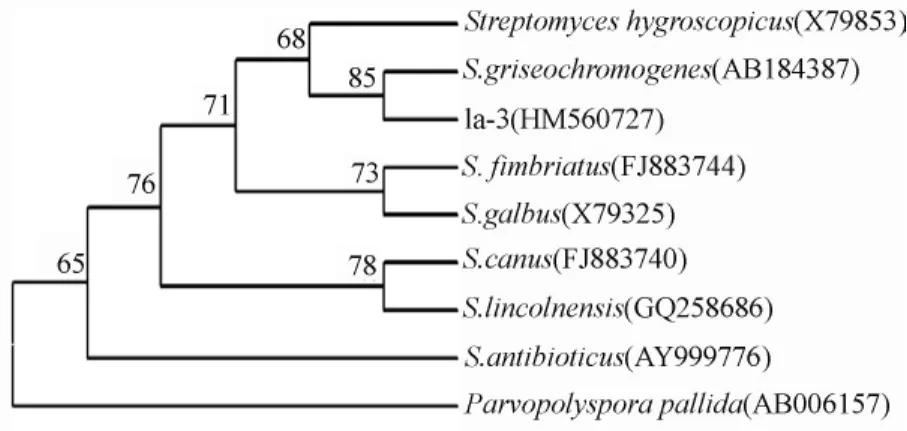
图2 菌株1a-3与相关菌株的系统发育树(分支处的数值为支持强度值)
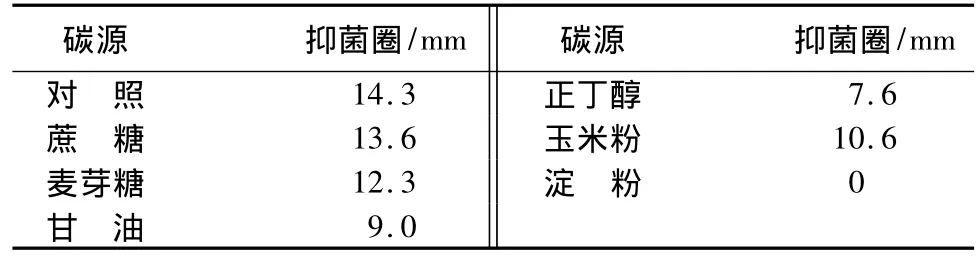
表3 不同碳源对菌株1a-3产素的影响
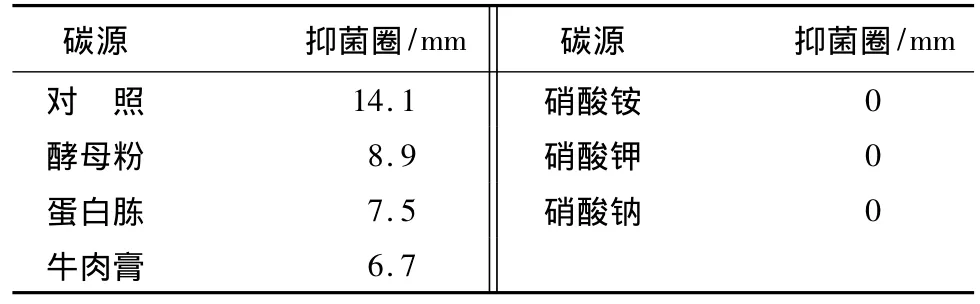
表4 不同氮源对菌株1a-3产素的影响
碳、氮源单因子试验和正交试验结果表明,大豆粉按2 g/L递增(2~6 g/L)、酵母粉按0.1 g/L递增(0.2~0.4 g/L)、葡萄糖按1 g/L递增(0~2 g/L)、玉米粉按1.5 g/L递增(0~3 g/L)比较合适,每个因子3个水平,能反映出趋势的变化。在此基础上进行了正交试验,9次试验的抑菌圈直径依次为20、22、17、21、20、23、19、24、22 mm。极差分析结果(表5)表明:4因子对发酵液抑菌活性的影响大小依次为大豆粉、玉米粉、葡萄糖、酵母粉。最佳碳氮源发酵配方为大豆粉2 g/L、酵母粉0.3 g/L、玉米粉3 g/L、葡萄糖1 g/L。
2.3 培养条件
在确定发酵培养基成分的条件下,对发酵培养条件进行了摸索,首先是将种子培养液培养24 h,以6%的接种量接入发酵培养基中培养;培养条件为:培养基的起始pH为7.0,恒温摇床上28℃培养60 h,摇瓶装量30 mL种子培养基于250 mL三角瓶中,转速为200 r/min,发酵后,其抑菌活性最好,所以选择此培养条件作为发酵培养条件。

表5 正交试验极差分析结果mm
3 结论与讨论
绝大多数抗生素产生菌为链霉菌属,其次是诺卡氏菌属(Nocardia)、游动放线菌属(Actinoplanes)以及马杜拉放线菌属(Actinomadura)等,其中链霉菌已成为放线菌中数量最多、而且产生抗生素种类也最多的一个属。本研究在传统分类原则的基础上,通过分子生物学方法对目的生防菌株进行了分类鉴定。菌株1a-3在形态特征、培养特征、生理生化特征和细胞壁成分上与已知的灰产色链霉菌相似,并且结合分子生物学鉴定结果,最后归为灰产色链霉菌。目前尚不能确定该菌株是否为1新种,还需要与模式种进行生理生化性质比较,并进行DNA杂交,根据同源性作进一步分析。另外,该菌株是否可被看作是农用抗生素的一个新来源,还需要后续试验的进一步验证。
发酵是抗生素产业化的基础,这是因为尽管抗生素产生菌的性能优良,但若缺乏合理的发酵工艺,也不能将其潜力充分发挥。抗生素发酵除受营养因素的限制以外,合适的发酵条件也是不可忽视的重要因素[17]。通过试验确定菌株1a-3的合适摇瓶发酵配方和培养条件为:葡萄糖1 g/L、玉米粉3 g/L、大豆粉2 g/L、酵母粉0.3 g/L、KH2PO40.1 g/L、CaCO30.3 g/L、NaCl 0.1 g/L,起始pH值7.0、28℃摇瓶培养60 h,摇瓶装量30 mL种子培养基于250 mL三角瓶中,转速为200 r/min发酵后,其效果较好。此试验在考虑为放大中试及大规模生产的发酵条件打基础的同时,还要考虑到后续活性物质的分离、提纯,因此,除了考虑成本还要看是否会产生过多的色素和离子。并且,发酵是一个复杂动态的生命过程,试验只对发酵条件中一些主要影响因子进行了分析,为了使其得到充分的产业化,在后续的试验中还将采用生化等方法对其代谢过程进行检测和研究,以明确发酵培养基中各成分的利用情况与菌丝生长和发酵液活性之间的关系[18],从而有目的地选择培养基和发酵条件。参考文献
[1]吴连举,杨依军,武侠,等.利用土壤拮抗性微生物防治人参锈腐病[J].中国生物防治,1999,15(4):166-168.
[2]赵曰丰,刘俊峰.毁灭柱孢菌及其侵染人参根的亚显微结构研究[J].特产研究,1997(2):1-4.
[3]赫荣琳,马贵龙,李玉.人参锈腐病研究进展[J].菌物研究,2005,3(4):47-51.
[4]卢振兰,刘金海,马秀兰,等.栽参土壤中阿特拉津降解菌株筛选及影响生物降解的因素[J].东北林业大学学报,2007,35(1):58-59,62.
[5]李宝年,徐树辉,杨传波,等.樟子松枯梢病拮抗真菌的筛选[J].东北林业大学学报,2004,32(5):97-99.
[6]周启,王道本.农用抗生素和微生物杀虫剂[M].北京:中国农业出版社,1995:5-6.
[7]Omura S.Isolation and structure of new antibiotic viridomycin produced by Streptomyces sp.k9620188[J].Journal of Antibiotics,1999,52(1):61-64.
[8]王琳,姜云,马贵龙.放线菌菌株1a发酵液抗菌谱及抗菌物质稳定性研究[J].吉林农业科学,2010,35(2):27-29.
[9]周德庆.微生物学实验手册[M].上海:上海科学技术出版社,1986:121-123.
[10]中国科学院微生物研究所放线菌分类组.链霉菌鉴定手册[M].北京:科学出版社,1975:13-15.
[11]Hasegawa T,Takizawa M,Tanida S.A rapid analysis for chemical grouping of aerophilic actinomycetes[J].J Gen Appl Microbiol,1983,29:319-322.
[12]刘志恒,姜成林.放线菌现代生物学与生物技术[M].北京:科学出版社,2004:102-321.
[13]徐平,李文均,徐丽华,等.微波法快速提取放线菌基因组DNA[J].微生物学通报,2003,30(4):82-84.
[14]Brunel B,Givaudan A,Lanois A,et al.Fast and accurate identification of Xenorhabdus and Photorhabdus species by restriction analysis of PCR-amplified 16S rRNA gene[J].Appl Environ Microbiol,1997,63(2):574-580.
[15]卢东升,陈玉栋,王金平,等.茶树内生真菌H8菌株的鉴定及其产红色色素培养条件[J].东北林业大学学报,2009,37(9):101-103,119.
[16]唐启义,冯明光.实用统计分析及其计算机处理平台[M].北京:中国农业出版社,1997:58-79.
[17]邬行彦,熊宗贵,胡章助.抗生素生产工艺学[M].北京:化学工业出版社,1982:54-136.
[18]Hu Haifeng,Ochi K.Novel approach for improving the productivity of antibiotic-producing strains by inducing combined resistant mutations[J].Appl Environ Microbiol,2001,67(4):1885-1892.
