人表皮细胞抽提物重编程脂肪干细胞的实验研究
2011-03-27唐新杰谢峰宋楠张群
唐新杰 谢峰 宋楠 张群
人表皮细胞抽提物重编程脂肪干细胞的实验研究
唐新杰 谢峰 宋楠 张群
目的观察人表皮细胞抽提物重编程人脂肪干细胞(hADSCs),使其向表皮细胞转化。方法超声乳化人表皮细胞,离心后获得抽提液冻存备用。培养2~3代hADSCs,链球菌溶血素O(SLO)处理后加入表皮细胞抽提液。7 d时观察hADSCs形态学、角蛋白K1/10及K19基因的变化及细胞膜K1/10及K19蛋白表达的变化。结果SLO处理hADSCs后,可使hADSCs的通透率明显增加,达70%左右。加入表皮细胞抽提液后的hADSCs变为表皮细胞特有的铺路石样形态,并表达表皮细胞特有的K1/10及K19基因及膜蛋白。结论表皮细胞抽提液可以重编程hADSCs,使其向表皮细胞转化。
脂肪干细胞表皮细胞抽提液重编程
细胞抽提物重编程是近年来逐渐发展起来的获取目的细胞的方式,通过提取目的细胞的细胞质和细胞核中的可溶性成分,作用于相应的受体细胞,使其转变为目的细胞的基因表型、形态,并具有相应的功能[1-4]。这一策略为病损组织器官替代修复提供了新思路。在大面积皮肤缺损患者的治疗中,往往面临着自体皮肤供体不足的问题,如果可以通过细胞抽提物重编程方式将体内大量存在的脂肪干细胞(ADSCs)转变为表皮细胞,则能为缺损组织提供充足的皮肤种子细胞,从而促进创伤的修复。本研究将人表皮细胞的抽提物引入到hADSCs中,观察表皮细胞抽提物能否对后者进行重编程,诱导其向表皮细胞分化,并进行相应的鉴定。
1 材料和方法
1.1 材料
Ⅱ型胶原酶(Sigma公司,美国);表皮细胞培养基(Gibco公司,美国);胎牛血清(Gibco公司,美国);链球菌溶血素(Streptolysin O,SLO;Sigma公司,美国);细胞乳化超声破碎仪(上海比朗仪器有限公司,中国);PCR试剂盒(Invitrogen公司,美国)。
1.2 细胞培养
1.2.1 脂肪干细胞的分离和培养
无菌条件下行脂肪抽吸术后,收集腹部脂肪(1例30岁女性患者),用磷酸盐缓冲液(PBS)冲洗3~4次,以除去红细胞和细胞碎片。清洗后加入等体积0.075%的Ⅱ型胶原酶,37℃恒温摇床消化60 min后,1 500 r/min离心5 min,弃去上清液和漂浮的脂肪细胞,获得高密度的细胞沉淀物。用含有10%胎牛血清的DMEM培养液重悬后,以1×106的细胞密度接种于10 cm培养皿内。本实验所用hADSCs为培养的第2~3代细胞。
1.2.2 表皮细胞的分离和培养
临床术后废弃皮肤组织以PBS冲洗,加入0.25% DispaseⅡ于4℃过夜。次日分离表皮和真皮,剪碎表皮后,加入适量0.25%胰酶,37℃消化30 min。消化结束后加入适量含有10%胎牛血清的DMEM培养液以终止胰酶的作用。过滤后离心收集细胞,得到的细胞用表皮细胞培养液培养至90%融合时收集细胞,液氮中冷冻保存备用。待达到所需数量后解冻,重新接种后收集细胞。
1.3 表皮细胞抽提物的制备
收集到的表皮细胞用PBS清洗2次后离心,弃上清后加入预冷的细胞裂解液(Sigma公司,美国)。细胞悬液用脉冲超声匀浆化,直至光镜下观察不到细胞结构及胞核结构。4℃下以15 000 r/min离心15 min,提取上清蛋白质溶液,分装于冻存管中,迅速于液氮中冷冻1 min,放入-80℃冰箱中备用。
1.4 抽提物加入链球菌溶血素O(Streptolysin O, SLO)渗透处理后的hADSCs
收集2~3代的hADSCs,于冰冷的PBS中洗涤2次后,分装于1.5 mL的EP管中,4℃下1 500 r/min离心5 min,弃去上清液,加入终浓度为230 ng/mL的SLO溶液。每100 μL SLO溶液中平均为1×105个细胞。将细胞置于37℃水浴中50 min,每隔15 min重悬1次。50 min后,离心收集细胞。每1×105个细胞加入100 μL抽提液和ATP生成体系(1 mM ATP,10 mM磷酸肌酸,25 μg/mL肌酸激酶及ATP、CTP、GTP、UTP各1 mmol/L;Sigma公司,美国)。此细胞混悬液在37℃水浴箱中孵育1 h,每20 min重悬1次。此过程中,抽提液中成分进入hADSCs内。孵育结束后,加入10%FBS的DMEM(含有2 mM的CaCl2),放置于37℃水浴中2 h,以封闭胞膜孔道。离心后更换成表皮培养液,细胞种植于培养皿。24 h后换液并去除未贴壁细胞,以后每3天换液1次。渗透化处理后的脂肪干细胞设立实验组和对照组进行检测,实验组为渗透化处理的hADSCs加入抽提液,对照组为渗透化处理的hADSCs不加入抽提液。1.5hADSCs的转归
1.5.1 细胞形态的变化
处理后的hADSCs贴壁后,每2天换液1次,观察培养7 d时实验组和对照组细胞的形态变化。
1.5.2RT-PCR检测K1/10及K19基因的表达
收集细胞后,依次行Trizol-氯仿抽提、异丙醇沉淀、乙醇洗涤,获得细胞mRNA的混悬液。测OD值后,定量反转录成cDNA。PCR扩增后凝胶电泳显示目的基因条带,引物序列见表1。

表1K1/10、K19及β-actin基因引物序列Table 1Primer sequences of K1/10,K19 and β-actin genes
1.5.3 免疫荧光检测细胞K1/10及K19的表达
抽提物处理后的hADSCs接种于放置灭菌盖玻片的培养皿中,检测时细胞爬片行免疫荧光检测。一抗为K1/10及K19鼠抗人单克隆抗体(1∶200,Abcam公司,美国),二抗为羊抗鼠异硫氰酸荧光抗体。孵育结束后荧光显微镜观察。
2 结果
2.1SLO处理hADSCs后细胞渗透率的变化
流式细胞仪检测发现,SLO处理hADSCs后引起细胞的PI染色率明显增加,约70%左右(图1),说明SLO可以使细胞的通透率增加。
2.2 表皮细胞抽提物作用的hADSCs形态的变化
表皮细胞抽提物引入渗透化处理的hADSCs培养1 d后,细胞缩短,呈短梭形;诱导第7天,呈明显铺路石样形态,而未加抽提液的细胞仍为梭形(图2)。
2.3 抽提物作用于hADSCs后K1/10及K19基因mRNA表达
以表皮细胞为阳性对照,RT-PCR检测结果显示7 d时加入表皮细胞抽提物的hADSCs的K1/10及K19基因表达阳性,对照组则为阴性(图3)。
2.4 抽提物作用的hADSCs表达表皮细胞标志
hADSCs与表皮细胞抽提物共孵育后培养7 d,免疫荧光检测K1/10、K19的表达。在实验组中,K1/10和K19有较明显表达,而对照组则无表达(图4)。
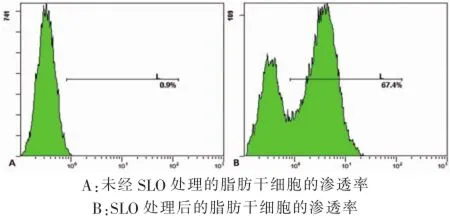
图1SLO处理后脂肪干细胞渗透性的改变A:The permeability rate of ADSCs without SLO dispose B:The permeability rate of ADSCs with SLO disposeFig.1The ADSCs permeability changes after SLO dispose

图2 细胞形态学改变A:Cell morphology of SLO-permeating ADSCs without cell extract at the 7th day;B:Cell morphology of SLO-permeating ADSCs adding cell extract at the 7th day(40×)Fig.2Cell morphological changes

图3 细胞处理后7 d时细胞K1/10及K19基因表达的变化Fig.3Gene expression of K1/10 and K19 seven days after cell operation

图4 细胞处理后7 d时K1/10及K19的表达(40×)Fig.4K1/10 and K19 protein expression in the cell membrane 7 days after cell operation(Immunofluorescent,40×)
3 讨论
经典的重编程是将供体细胞核转入卵细胞内,利用其细胞内微环境对供体细胞基因表达进行重编程,从而使新细胞获得全能分化性[5-6]。另外,将体细胞同胚胎干细胞或生殖干细胞融合后,也可对此体细胞进行重编程,得到全能分化细胞[7-8]。研究已证实,卵细胞、干细胞及终末分化的体细胞内均存在着相似的染色质重编程物质,可以调节其他细胞使其发生形态学、基因学变化[9]。随着研究的深入,含有重编程所需的启动物质的细胞抽提液逐渐成为重编程方面的研究热点。
Hakelien等[1]于2002年首次将T细胞的抽提物导入成纤维细胞,发现成纤维细胞下调其固有基因的表达,而表达T细胞特异的基因、特定的表面分子和功能。Gaustad等[3]报道,将小鼠的心肌细胞抽提物加入ADSCs中,可以使ADSCs表达心肌细胞的特异性标志,甚至有些转化的细胞可以出现自律性搏动。同年,Hakelien等[2]将胰岛β细胞抽提物同成纤维细胞共培养,可使成纤维细胞表达胰岛β细胞的表型。由此可见,细胞抽提物重编程模式是一种有效模式,可发生在干细胞与体细胞之间或体细胞与体细胞之间。此方法中所用细胞来源于同一个体,避免了卵细胞重编程的伦理学争议。
在重编程实验中,供体细胞为有一定分化潜能的间充质干细胞或成纤维细胞。ADSCs是成体间充质干细胞中具有多向分化潜能的一类细胞群[10]。ADSCs具有多向分化潜能,在体外可大量扩增,并且在适当的诱导条件下分化为成脂细胞、成骨细胞、软骨细胞、血管内皮细胞等[10-11],所以极有潜力作为重编程的受体细胞。此外,脂肪抽吸术是常见手术,脂肪组织的来源极为方便,这也是我们选择ADSCs作为受体细胞的原因。
SLO对黏附和非黏附细胞均具有成孔毒性,处理过的细胞允许小于100 KDa的分子进入细胞[12]。在本实验中,SLO处理细胞后允许抽提物、ATP生成系统等进入细胞中发挥作用。脂肪干细胞与表皮细胞抽提物孵育后培养,细胞形态发生改变:1 d时,细胞开始缩短;7 d时,出现典型的表皮细胞的铺路石样形态。此外,ADSCs与表皮细胞抽提物孵育后,RT-PCR检测发现ADSCs表达表皮细胞标志性的角蛋白K1/10及K19的基因,并表达相应的细胞膜蛋白。但是培养至14 d时,相应的检测均无阳性表现,可能是因为重编程不能使所有的ADSCs发生变化,剩余的未被重编程的ADSCs的优势生长抑制了已发生重编程的ADSCs的生长。但从上述结果可初步证实,表皮细胞抽提液在一定的时间内可以特异性的开放或者关闭ADSCs的某些基因,使其向表皮细胞方向分化。
细胞抽提物中的重编程物质的本质迄今未有答案。目前认为,抽提物中的有效成分可能是转录因子或者DNA结合蛋白[13]。无论在T淋巴细胞抽提物对293T细胞的重编程,还是在胰岛β细胞抽提物对成纤维细胞的重编程,均观察到细胞核对相应基因转录因子的摄取[1-2]。另外,在实验中也观察到H4或H3组蛋白乙酰化状态的改变[1-14],但研究表明这种改变是暂时的[4]。目前,细胞重编程的始动物质是什么,重编程的机制是什么,均无明确答案,都需要进一步探索。
细胞抽提物重编程可以给我们提供新的细胞来源,但是步骤有待于进一步简化,现在的较为繁冗的步骤使操作易污染,不易控制。随着实验技术的不断革新,我们相信利用表皮细胞抽提物重编程ADSCs后可以得到大量的表皮细胞,并能够被广泛地应用于实验研究中,从而加速其临床应用的步伐。
[1]Hakelien AM,Landsverk HB,Robl JM,et al.Reprogramming fibroblasts to express T-cell functions using cell extracts[J].Nature Biotechnology,2002,20(5):445-446.
[2]Hakelien AM,Gaustad KG,Collas P.Transient alteration of cell fate using a nuclear and cytoplasmic extract of an insulinoma cell line[J].Biochem Biophys Res Commun,2004,316(3):834-841.
[3]Gaustad KG,Boquest AC,Anderson BE,et al.Differentiation of human adipose tissue stem cells using extracts of rat cardiomyocytes [J].Biochem Biophys Res Commun,2004,314(2):420-427.
[4]Bru T,Clarke C,McGrew MJ,et al.Rapid induction of pluripotency genes after exposure of human somatic cells to mouse ES cell extracts [J].Exp Cell Res,2008,314(14):2634-2642.
[5]Wilmut I,Schnieke AE,McWhir J,et al.Viable offspring derived from fetal and adult mammalian cells[J].Nature,1997,385(6619): 810-813.
[6]Wakayama T,Perry AC,Zuccotti M,et al.Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei [J].Nature,1998,394(6691):369-374.
[7]Do JT,Han DW,Scholer HR.Reprogramming somatic gene activity by fusion with pluripotent cells[J].Stem Cell Rev,2006,2(4): 257-264.
[8]Tada M,Takahama Y,Abe K,et al.Nuclear reprogramming of somatic cells by in vitro hybridization with ES cells[J].Curr Biol, 2001,11(19):1553-1558.
[9]Collas P,Taranger CK.Epigenetic reprogramming of nuclei using cell extracts[J].Stem Cell Rev,2006;2(4):309-317.
[10]Zuk PA,Zhu M,Mizuno H,et al.Miltilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng, 2001,7(5):211-218.
[11]Mizuno H.Adipose-derived stem cells for tissue repair and regeneration:ten years of research and a literature review[J].J Nippon Med Sch,2009,76(2):56-66.
[12]Walev I,Bhakdi SC,Hofmann F,et al.Delivery of proteins into living cells by reversible membrane permeabilization with streptolysin-O[J].PNAS,2001,98(6):3185-3190.
[13]Chakrabarti SK,Francis J,Ziesmann SM,et al.Covalent histone modifications underlie the developmental regulation of insulin gene transcription in pancreatic beta cells[J].J Biol Chem,2003, 278(2):23617-23623.
[14]Rajasingh J,Lambers E,Hamada H,et al.Cell-free embryonic stem cell extract-mediated derivation of multi-potent stem cells from NIH3T3 fibroblasts for functional and anatomical ischemic tissue repair[J].Circ Res,2008,102(11):107-117.
Reprogramming of Adipose Tissue Derived Stem Cells Using Nuclear and Cytoplasmic Extract of Epidermal Cells
ObjectiveTo explore if cell extract of epithelial cells could reprogram adipose tissue derived stem cells (ADSCs)and make them turn to epithelial cells.MethodsCell extract of epithelial cells was obtained by ultrasonic emulsification and high speed centrifugation,and then was frozen for further use.P2/3 ADSCs were treated with SLO,and then the cell extract was added into the cells.Seven days later,morphological changes of ADSCs,mRNA and membrane protein expression changes of keratin K1/10 and K19 in ADSCs were observed through RT-PCR and immunofluorescent. ResultsSLO-treated ADSCs got high permeability,up to 70%.7 days later,the ADSCs adding cells extract became typical madstones-like shape of epithelial cells,mRNA and protein expression of keratin K1/10 and K19 were positive in these cells.Conclusion Cell extract of epithelial cells could reprogram ADSCs into epithelial cells.
Adipose tissue derived stem cells;Epidermal cells;Cell extract;Reprogramming
Q813.1+1
A
1673-0364(2011)03-0129-04
TANG Xinjie,XIE Feng,SONG Nan,ZHANG Qun.
Department of Plastic and Reconstructive Surgery,Shanghai Ninth People′s Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding author:ZHANG Qun(E-mail:qunzhang737@sina.com).
2011年3月21日;
2011年4月16日)
10.3969/j.issn.1673-0364.2011.03.002
国家自然科学基金(30772263,81071580),2010年中华医学会-欧莱雅中国人健康皮肤/毛发研究项目、上海高校创新团队发展计划。
200011上海市上海交通大学医学院附属第九人民医院整复外科。
张群(E-mail:qunzhang737@sina.com)。
