脂肪基质血管成分移植促进随意皮瓣成活的实验研究
2011-03-27盛玲玲杜子婧李华李慧婕周达李青峰
盛玲玲 杜子婧 李华 李慧婕 周达 李青峰
脂肪基质血管成分移植促进随意皮瓣成活的实验研究
盛玲玲 杜子婧 李华 李慧婕 周达 李青峰
目的探讨脂肪基质血管成分(Stromal vascular fraction,SVF)移植是否可以促进随意皮瓣成活,及其作用的相关机制。方法分离4周龄Wistar大鼠脂肪中的SVF及骨髓中的单个核细胞(BM-MNCs),RT-PCR检测VEGF和bFGF在两种细胞中的表达。根据移植细胞的不同,将24只Wistar大鼠分成3组,分别为对照组、BM-MNCs组和SVF组。在大鼠背部设计一个10 cm×3 cm大小的矩形皮瓣,分别将含有5×107个SVF及BM-MNCs的混悬液各1 mL均匀注射至皮下组织层,对照组单纯注射1 mL PBS。2 d后,皮瓣掀开原位缝合,术后7 d统计皮瓣的成活率。取各组皮瓣相同部位的组织,实时定量PCR检测组织中VEGF和bFGF基因的表达。结果SVF和BM-MNCs细胞中VEGF和bFGF的表达无明显差别(P>0.05)。皮瓣原位缝合后7 d,SVF组和BM-MNCs组皮瓣的成活率分别为(72.2±2.0)%和(76.4±3.1)%,均明显高于对照组的(56.8±4.6)%(P<0.05)。实时定量PCR检测发现SVF组和BM-MNCs组皮瓣组织中VEGF和bFGF基因的表达明显升高。结论SVF移植入皮瓣后可以通过旁分泌生长因子如VEGF和bFGF等增加皮瓣的成活面积。
脂肪基质血管成分随意皮瓣血管化
骨髓单个核细胞(Bone marrow-derived mononuclear cells,BM-MNCs)已被证实可以通过促进随意皮瓣的毛细血管新生而提高皮瓣的成活率[1]。BMMNCs是骨髓中的异质性细胞群体,分离后无需培养即可直接应用。但是,骨髓抽吸是有创的,给病人带来极大的痛苦,使得BM-MNCs的临床应用受限。脂肪基质血管成分(Stromal vascular fraction,SVF)是胶原酶消化脂肪后获得的含有脂肪干细胞的细胞群体,如同BM-MNCs,SVF分离后也无需培养即可应用。脂肪在人体中的存储量大,脂肪抽吸对组织损伤小,可反复抽取。因此,获取大量的SVF是非常容易的。SVF成为细胞治疗的新选择,极有可能被应用于临床。目前,SVF已成功应用于缺血组织的血管化治疗,如缺血心肌[2]、缺血下肢[3-4],取得了满意的效果,但是尚无SVF应用于随意皮瓣缺血治疗的研究。本实验旨在观察SVF是否可以促进随意皮瓣成活,并探讨其相关机制。
1 材料和方法
1.1 材料
Wistar大鼠(上海斯莱克实验动物有限公司);Ⅱ型胶原酶(Sigma公司,美国);培养基(Gibco公司,美国);PCR试剂盒(Invitrogen公司,美国);MX3000P荧光定量PCR仪(Stratagene公司,美国)。1.2细胞的分离
1.2.1SVF的分离
4周龄Wistar大鼠麻醉处死后,在无菌条件下分离获得腹股沟脂肪垫。剪碎后,加入适量0.2%Ⅱ型胶原酶,于37℃摇床振荡1 h。胶原酶消化结束后,加入相同量的含10%胎牛血清的培养基终止胶原酶的作用。离心收集沉淀后,加入红细胞裂解液(Sigma公司,美国),于37℃温箱中裂解5 min。过滤后离心收集所得沉淀,即为SVF。
1.2.2BM-MNCs的分离
大鼠处理同上。分离出股骨和胫骨后,用注射器吸取其中的骨髓,用Percoll液(Sigma公司,美国)密度梯度离心收集骨髓中的单个核细胞,即为BMMNCs。
1.3RT-PCR检测VEGF和bFGF基因在SVF和BM-MNCs细胞中的表达
分别收集3×106个SVF和BM-MNCs,Trizol-氯仿抽提,异丙醇沉淀,乙醇洗涤,获得细胞RNA的混悬液。测OD值后定量反转录成cDNA。PCR扩增后凝胶电泳显示目的基因的条带。所用血管内皮生长因子(Vascular endothelial growth factor,VEGF)、碱性成纤维细胞生长因子(Basic fibroblast growth factor,bFGF)及内参β-actin的基因引物序列见表1。
1.4 细胞移植及动物实验
细胞计数后,分别将5×107个SVF及BMMNCs重悬于1 mL PBS中备用。
实验动物禁食8 h后,3%戊巴比妥钠腹腔注射麻醉,俯卧位固定,在大鼠背部设计10 cm×3 cm的随意型皮瓣,皮瓣蒂部平于髂后上棘连线。根据移植细胞的不同,将24只(体重约200 g)的Wistar大鼠随机分成3组,每组8只,分别为对照组、BMMNCs组和SVF组。分别将含有SVF及BM-MNCs的混悬液1 mL均匀注射至皮下组织层,对照组单纯注射1 mL PBS。2 d后,掀起皮瓣,保留皮瓣下的肉膜层。结扎创面活跃出血点,皮瓣原位缝合。
1.3 皮瓣成活率测定
皮瓣术后7 d,肉眼观察皮瓣成活情况并测定皮瓣成活率。皮瓣坏死的标准为:皮肤颜色变黑、组织回缩、弹性差、切割不出血。拍照后图像输入计算机,应用IPP 6.0图像分析系统,计算出皮瓣成活率。

1.4SYBR GreenⅠ实时定量PCR检测皮瓣组织中VEGF和bFGF的表达
无菌条件下取各组皮瓣(n=3)坏死界线旁开1 cm处的组织,匀浆后提取RNA,反转录为cDNA。按照定量PCR试剂盒分别加样后,PCR反应在MX3000P Real Time PCR仪上进行,采用β-actin作为内参(各引物序列见表1)。根据反应产物的溶解曲线,数据经MX3000P Corparative Quantitative软件进行自动定量分析。

表1VEGF、bFGF及内参β-actin的基因引物Table 1Primers sequences of VEGF,bFGF and β-actin genes
1.5 统计学分析
数据均采用均数±标准差表示,用SPSS 13.0软件对数据进行方差分析,两两之间的比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1VEGF和bFGF基因在SVF和BM-MNCs的表达
RT-PCR检测脂肪基质血管成分及骨髓单个核细胞的VEGF和bFGF的表达,发现在内参β-actin表达相近的情况下,SVF和BM-MNCs两者之间的VEGF、bFGF的表达无明显差别(图1)。

图1 术后7 d各组皮瓣成活情况及成活率统计(箭头指示坏死界限;*:P<0.05)Fig.1Flap survival of the three groups and statistic analysis 7 days after surgery(Arrows show the necrosis boundaries;*:P<0.05)
2.2 皮瓣成活率统计
皮瓣坏死区域与成活区域的界线明显,SVF组的皮瓣成活率为(72.2±2.0)%,BM-MNCs组的皮瓣成活率为(76.4±3.1)%,均高于对照组(56.8±4.6)%,差异有统计学意义(P<0.05);SVF组和BM-MNCs组之间无明显差别(P>0.05)(图2)。
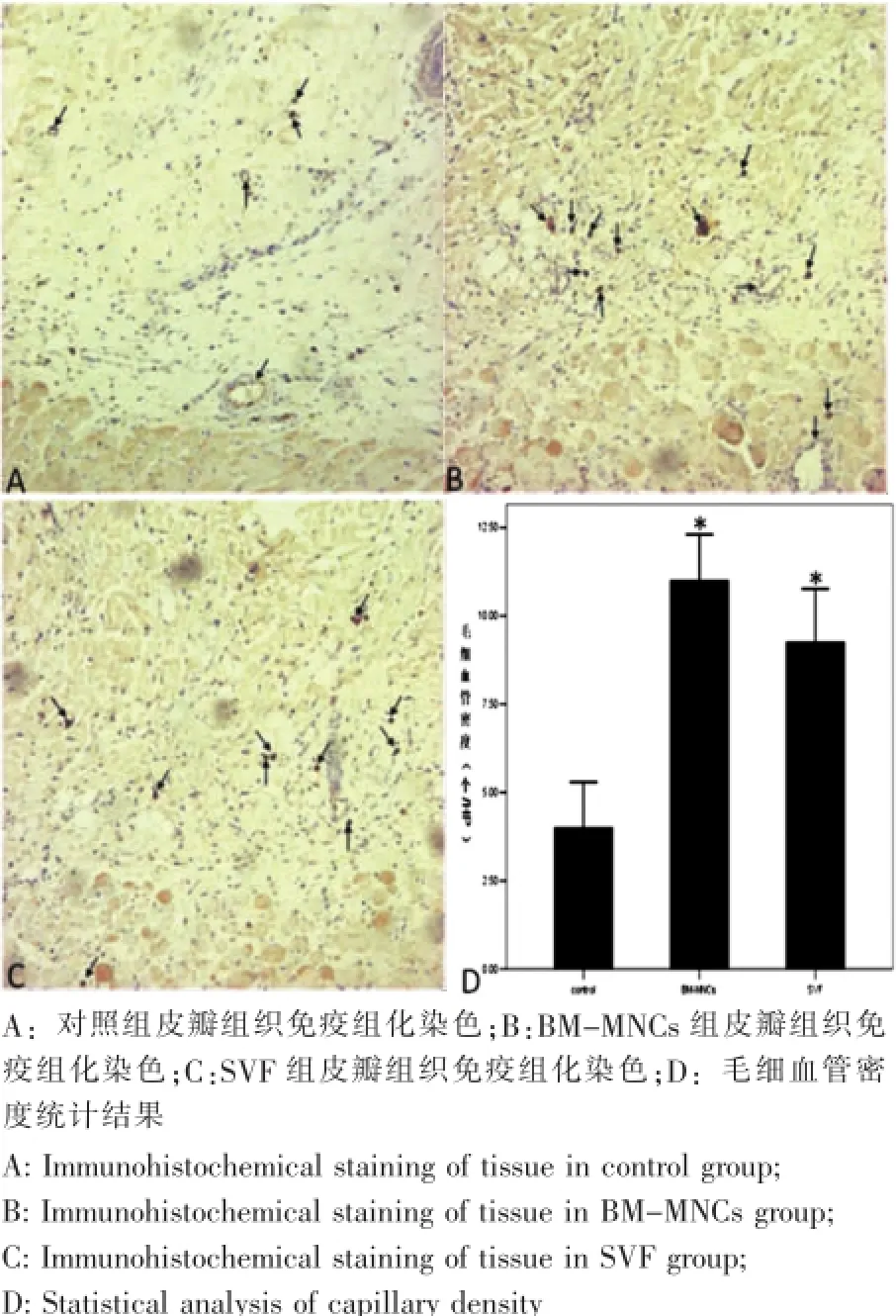
图2 各组皮瓣组织vWF免疫组化染色(箭头所指为毛细血管;*:P<0.05;100×)Fig.2Anti-vWF staining of the flap tissues (Arrows show capillaries;*:P<0.05;100×)
2.3VEGF和bFGF基因在各组皮瓣组织中的表达
收集各组皮瓣组织后,实时定量PCR检测获取各组基因的Ct值,采用2-△△Ct的方法,将对照组的基因表达校正为1倍量。结果发现VEGF和bFGF在SVF移植组和BM-MNCs移植组皮瓣组织中的表达明显上调,与对照组的差异显著(图3)。

图3 各组皮瓣组织VEGF和bFGF表达情况(*:P<0.05)。Fig.3Gene expression levels of VEGF and bFGF in flap tissues of different groups(*:P<0.05)
3 讨论
皮瓣转移修复是整形外科的常用技术,常用来修复因创伤、肿瘤切除等引起的组织缺损。皮瓣自身的低氧环境虽然可以促进其血管化,但是不足以平衡缺血、缺氧带来的组织损伤,导致皮瓣远端发生缺血性坏死。如果能在术前实现皮瓣的血管化,则有望大大降低坏死面积。
血管化主要包括血管新生和血管形成[5-6]。血管新生是在原来存在的血管结构上长出新血管的生物学过程。血管形成是指内皮祖细胞迁移至某部位,分化发育为新血管。血管化过程主要是受多种生长因子的调节。单独应用VEGF、bFGF已被证明可以促进随意皮瓣血管化,提高成活率[7-8]。但是生长因子的应用受限于其单一性及在体内较短的半衰期。干细胞移植治疗可望解决了这一问题,植入体内的干细胞可持续分泌多种促血管化生长因子,从而发挥比单纯生长因子更持久、更有效的作用。
骨髓单个核细胞促进皮瓣成活的作用可能与移植入体内的细胞持续分泌生长因子,如VEGF和bFGF有关[1]。本实验检测了这两种基因在SVF和BM-MNCs的表达,发现VEGF和bFGF在这两种细胞群中的表达差异不大。由于VEGF和bFGF是目前公认的与促血管化作用关系最密切的两种生长因子[9],此结果在一定程度上表明在皮瓣的缺血治疗中,SVF有可能发挥同BM-MNCs一样的效果。其中,bFGF主要是在血管再生的早期起作用,bFGF能诱导内皮祖细胞和内皮细胞的活化,可能起启动血管再生的作用[10]。而VEGF则是在血管化后期调节内皮细胞的增殖和分化[10],VEGF还可以抑制低氧环境中内皮细胞的凋亡[11],趋化周围组织和骨髓中的干细胞至缺血部位[12]。
本实验中,SVF和BM-MNCs移植入皮瓣后都能明显提高皮瓣的成活率,两组之间的效果无明显差别,但与对照组之间都存在显著性差异,与Sumi等[3]的实验结果相符。Sumi等将小鼠的SVF和BMMNCs移植入缺血下肢中,使得缺血下肢的血流强度、血管的数量显著增强,下肢组织成活率明显高于对照组,SVF组和BM-MNCs组之间无差别。
目前关于细胞移植的治疗性血管化作用的机理集中于植入细胞的直接分化和持续分泌多种生长因子。但是,细胞移植入体内后成活率极低[12-13],其分化的细胞不足以促进血管化的发生。因此,其持续的旁分泌能力被认为是发挥促血管化作用的主要机理。在本实验中,VEGF、bFGF在植入SVF和BMMNCs的皮瓣组织中表达明显上调,这可能是SVF和BM-MNCs直接分泌VEGF、bFGF的结果,也是促进皮瓣成活的主要原因。
有学者认为,BM-MNCs和SVF作为异质性细胞群体,在血管化过程中,细胞群体中的各种细胞可以发挥协调作用,从而发挥着比同质性干细胞群更大的作用[14]。另外,SVF和BM-MNCs的应用还可以减少获取同质性干细胞所需的体外培养时间(一般为2~3周),避免了长时间体外培养引发的干细胞分化和突变[15]。
通过本实验研究发现SVF移植可以通过旁分泌VEGF、bFGF等发挥促进皮瓣血管化的作用,从而减少皮瓣的坏死面积,效果与BM-MNCs移植无明显差异。随着对SVF认识的逐步加深,SVF将有望被广泛应用于皮瓣缺血的治疗。
[1]Yang M,Sheng L,Li H,et al.Improvement of the skin flap survival with the bone marrow-derived mononuclear cells transplantation in a rat model[J].Microsurgery,2010,30(4):275-281.
[2]Leobon B,Roncalli J,Joffre C,et al.Adipose-derived cardiomyogenic cells:in vitro expansion and functional improvement in a mouse model of myocardial infarction[J].Cardiovasc Res,2009,83(4): 757-767.
[3]Sumi M,Sata M,Toya N,et al.Transplantation of adipose stromal cells,but not mature adipocytes,augments ischemia-induced angiogenesis[J].Life Sci,2007,80(6):559-565.
[4]Miranville A,Heeschen C,Sengenes C,et al.Improvement of postnatal neovascularization by human adipose tissue-derived stem cells[J].Circulation,2004,110(3):349-355.
[5]Tepper OM,Galiano RD,Kalka C,et al.Endothelial progenitor cells:the promise of vascular stem cells for plastic surgery[J]. Plast Reconstr Surg,2003,111(2):846-854.
[6]Asahara T,Murohara T,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275 (5302):964-967.
[7]Zhang F,Oswald T,Lin S,et al.Vascular endothelial growth factor (VEGF)expression and the effect of exogenous VEGF on survival of a random flap in the rat[J].Br J Plast Surg,2003,56(7):653-659.
[8]Fujihara Y,Koyama H,Ohba M,et al.Controlled delivery of bFGF to recipient bed enhances the vascularization and viability of an ischemic skin flap[J].Wound Repair Regen,2008,16(1):125-131.
[9]Ferrara N,Alitalo K.Clinical applications of angiogenic growth factors and their inhibitors[J].Nat Med,1999,5(12):1359-1364.
[10]张富贵,李权.带蒂皮瓣新生血管化机制中相关生长因子的作用[J].国际口腔医学杂志,2009,36(2):231-234.
[11]Weng R,Li Q,Li H,et al.Mimic hypoxia improves angiogenesis in ischaemic random flaps[J].J Plast Reconstr Aesthet Surg,2010, 63(12):2152-2159.
[12]Wu Y,Chen L,Scott PG,et al.Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis[J].Stem Cells,2007,25(10):2648-2659.
[13]Noiseux N,Gnecchi M,Lopez-Ilasaca M,et al.Mesenchymal stem cells overexpressing Akt dramatically repair infarcted myocardium and improve cardiac function despite infrequent cellular fusion or differentiation[J].Mol Ther,2006,14(6):840-850.
[14]Taylor DA,Zenovich AG.Cardiovascular cell therapy and endogenous repair[J].Diabetes Obes Metab,2008,10(4):5-15.
[15]Qin Y,Ji H,Wu Y,et al.Chromosomal instability of murine adipose tissue-derived mesenchymal stem cells in long-term culture and development of cloned embryos[J].Cloning Stem Cells,2009,11 (3):445-452.
Effect of Stromal Vascular Fraction Transplantation on Improvement of Random Skin Flap Survival
ObjectiveTo investigate effect of SVF transplantation on survival of random skin flap and explore the relative mechanism.MethodsSVF and bone marrow-derived mononuclear cells(BM-MNCs)were isolated from 4-week-old Wistar rats.The gene expressions of VEGF and bFGF in SVF and BM-MNCs were detected by RT-PCR.Twenty-four Wistar rats were selected to make 10 cm×3 cm skin flap at back,and were randomly divided into 3 groups according to different suspension fluid which were injected subcutaneously to treat flaps(n=8):control group,BM-MNCs group and SVF group. Two days later,the flap was raised and sutured.Seven days after the operation,the survival of skin flap in 3 groups was observed.A piece of flap at same place was taken and quantitative expression of VEGF and bFGF was detected by quantitative PCR.ResultsThe expressions of VEGF and bFGF were same in SVF and BM-MNCs.The survival ratio of skin flap in BM-MNCs group(76.4±3.1)%and SVF group(72.2±2.0)%were both obviously higher than the control group(56.8±4.6)%, P<0.05.The expression of VEGF and bFGF in BM-MNCs and SVF groups was distinctly higher than the control group. ConclusionSVF can improve the viability of skin flap by the para-secreting of VEGF and bFGF.
Stromal vascular fraction;Random skin flap;Neovascularization
R622
A
1673-0364(2011)03-0143-04
SHENG Lingling,DU Zijing,LI Hua,LI Huijie,ZHOU Da,LI Qingfeng.
Department of Plastic and Reconstructive Surgery,Shanghai Ninth People′s Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding author:LI Qingfeng(E-mail:liqfliqf@yahoo.com.cn).
2011年3月29日,
2011年4月18日)
10.3969/j.issn.1673-0364.2011.03.006
国家自然科学基金项目(30730092,30925034)、国家杰出青年科学基金(30925034)、上海市曙光计划基金(09CG14)。
200011上海市上海交通大学医学院附属第九人民医院整复外科。
李青峰(E-mail:liqfliqf@yahoo.com.cn)。
