甘蔗赤腐病防治技术研究进展
2011-03-23林善海黄诚华王伯辉
林善海,黄诚华,王伯辉
(广西壮族自治区甘蔗研究所,南宁530007)
综述
甘蔗赤腐病防治技术研究进展
林善海,黄诚华,王伯辉
(广西壮族自治区甘蔗研究所,南宁530007)
综述了甘蔗赤腐病的抗病育种、生物防治、农业防治和化学防治,并对甘蔗赤腐病防治存在的问题进行分析。
甘蔗赤腐病;抗病育种;生物防治;农业防治;化学防治
赤腐病是人们最早知道的甘蔗病害之一,在世界各个甘蔗产区普遍发生,最早于1893年报道在印度尼西亚爪哇发生,随后迅速在多个甘蔗生产国相继有报道[1]。赤腐病是印度、巴基斯坦、美国、孟加拉和澳大利亚等多个国家最为严重的甘蔗病害之一,对甘蔗造成的产量损失可达25%~50%[2]。该病在我国也普遍发生,发病严重时导致减产可达30.5%[3-8]。该病的病原为半知菌亚门炭疽菌属镰形炭疽菌(Colletotrichum falcatum Went),有性态为Glomerella tucumanensis Speg。病原主要通过土壤和种茎切口进行传播侵染,感染赤腐病后的蔗种萌芽率、根系长、蔗茎长度、胸径、蔗茎重、糖分含量和纯度等都不同程度降低[9]。此外,甘蔗螟虫的危害有利于甘蔗赤腐病的侵入和危害,由甘蔗螟虫和赤腐病菌联合造成的损失最高可达33.0%[10]。
近年来,科学工作者对甘蔗赤腐病的防治做了大量的工作,主要表现为以下几个方面。
1 抗病育种
使用病害抗耐性品种是防治植物病害的有效措施。目前未发现对甘蔗赤腐病有完全免疫的甘蔗品种,大多数栽培品种都是感病品种,但感病水平差异很大[11]。用于评价赤腐病抗病基因型的方法主要有3种,分别为堵漏法(plug method)、节法(nodal method)和对照法(controlled condition testing method,CCT),其中以堵漏法最有效[12]。抗病育种一直以来被认为是有效、安全防治甘蔗赤腐病的手段。甘蔗赤腐病抗病育种主要途径有以下3种。
1.1 杂交育种
利用抗性品种材料作为杂交亲本比利用感病品种材料更容易获得抗性的杂交后代,双亲本为感病品种杂交所得抗病品种后代的几率为28%~30%[13]。不同的基因型甘蔗品种中均存在多形态和单形态作用位点,甘蔗品种抗病或感病程度由多个不同形态的作用位点共同控制应用,但杂交亲本基因型缺乏多样性,使得目前栽培品种基因型的遗传同源性高度相同(74.37%)[14]。蔗茅[Erianthus rufipilus(Steud.)Griseb]是甘蔗属的近缘植物,具有硬度、抗病等特点,利用蔗茅与甘蔗品种材料进行杂交育种能较易筛选出抗赤腐病的品种[15]。
1.2 诱变育种
通过物理、化学的处理技术,使有机体内的基因发生突变,但外观形态无变化,从而筛选出具有抗病性的突变体,并且这种突变没有可逆性。经钴-60γ射线照射的感病品种Co.449及其后代对赤腐病产生抗性,突变后的甘蔗形态与原始无差别,还具有其他优良的农艺特性[16-18]。Khairwal等[19]同时用物理诱变剂(γ射线)和化学诱变剂甲基硫酸乙酯和叠氮化钠对印度当时的当家品种Co 1148诱变筛选赤腐病抗病品种,结果显示,3种方式的诱变均可使蔗糖含量、纯度、蔗茎纤维等指标有不同程度的提高。Kiran和Yadahalli[20]分别使用叠氮化钠和γ射线对中抗品种CP77400的心叶、芽尖分裂组织和木髓部薄壁细胞外植体进行诱变,辅以赤腐病菌粗毒素进行筛选,经过2年大田筛选,从164个植株中获得8个抗性植株[21]。
1.3 组织培养产生抗病突变体
传统方法通过杂交并用病原接种测试可获得高产优质的抗性后代,但这是一个漫长的过程,消耗大量的人力、物力。因此,利用生物技术获得赤腐病的抗性基因型品种受到人们的关注。组织培养和体细胞克隆变异的利用对甘蔗品种的改良已为人们熟知。利用病原次生代谢物质诱导定向变异产生抗病体细胞克隆的方法被利用到甘蔗赤腐病的抗病育种上。甘蔗赤腐病菌产生的毒素可明显减少甘蔗组培苗愈伤组织的形成、种苗的差异和芽的生长,通过毒素梯度锻炼可筛选出抗性基因型甘蔗品种[22]。
2 生物防治
2.1 微生物生防菌
2.1.1 拮抗菌的活体应用目前,已报道甘蔗赤腐病生防菌至少有29种(表1)。主要的生防菌有:假单胞菌(Pseudomonas spp.)、木霉(Trichoderma spp.)、芽孢杆菌(Bacillus spp.)和放线菌(Streptomyces spp.)等。利用荧光假单胞菌(P.fluorescens)单菌株悬浮液浸种、定期喷施和土壤淋灌,可使品种Coc 92601的产量达到110.65 t/hm2,赤腐病的发生率降低到最低[23]。利用T.harzianum复合菌株培养物、培养滤液和分生孢子悬浮液对提高蔗种萌发率、分蘖率、产量、甘蔗体内的吲哚乙酸和降低赤腐病发病指数有显著效果[24]。喷施球毛壳菌(Chaetomium globosum)对Co 7717品种的新植苗和宿根苗的蔗芽萌发率提高10%和5.9%[25]。用3个P. fluorescens菌株和1个P.putida菌株对种茎或种茎和土壤同时处理,可有效提高种茎的萌发率,显著减少赤腐病的发生,使用生防菌的田块赤腐病发生率为5.88%~16.67%,而对照的发病率37.50%[26]。为了弥补生防菌的不足,使生防菌与化学药剂较好结合防治赤腐病,必须要考虑到化学杀菌剂对生防菌的影响,尤其是生防真菌与杀菌剂的兼容性。多菌灵和甲基托布津的浓度在0.05%以下时,对生防菌细菌的生长无影响,虽然赤腐病化学杀菌剂对生防真菌的生长有抑制作用,但在较低浓度时可提高生防真菌对赤腐病菌的防效,且生防菌与化学药剂复合处理的防效显著高于生防菌或化学药剂的单独处理[27]。
2.1.2 生防作用机理生防菌控制赤腐病主要通过两种途径,即诱导植株产生抗性和本身产生抗生素抑制病原菌。生防菌的诱导抗性作用主要通过在甘蔗体内产生次生代谢物吲哚乙酸和水杨酸诱导植株产生主动防御[39]。 Kumar等[29]认为在赤腐病菌侵染前的24h接种生防菌,对甘蔗具有最好的抗性诱导作用,而在赤腐病菌侵染24h后接种无效。内生菌Pseudomonas spp.可在甘蔗的根际定植并诱导植株产生系统抗性,经过假单胞浸种和土壤处理的3个品种,只有感病品种CoC671在3节以下的蔗茎中有少量的赤腐病菌,而中感品种Co8021和中抗品种BO91蔗茎内无病原菌,经过滑石粉处理可进一步减少病原菌在蔗茎中的数量[40]。而通过种茎和土壤浇灌的假单胞菌(P.fluorescens和P.putida)可显著降低蔗茎赤腐病的发病程度,改善种茎的发芽和生长,提高蔗糖含量和产量,感病品种由假单胞菌引起的系统诱导抗性明显比中抗和中感品种高,蔗茎内的蔗糖转化酶活性下降,蔗糖含量增加[41]。利用植物促生根围细菌(PGPR)进行前处理,可显著减少高节位(≥7)赤腐病的发病程度,诱导的抗性在甘蔗体内可持续时间达到90d,并提高相关防御酶(几丁质酶和过氧化物酶)活性水平,经过诱导的植株体内的酸性和中性的转化酶水平比对照明显下降,诱导抗性作用在感病品种的效果尤其显著[42]。
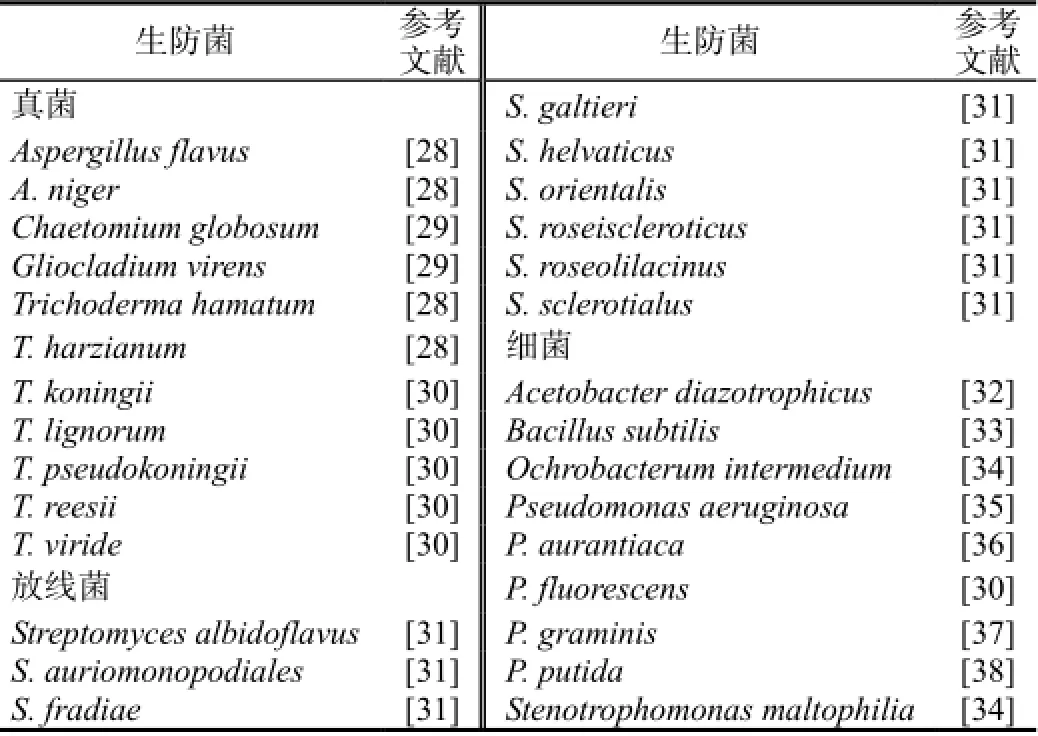
表1 已报道的甘蔗赤腐病生防菌
真菌细胞壁的主要成分为β-1,3葡聚糖和几丁质,而生防菌可产生多种抗生素破坏或抑制赤腐病菌生长和分生孢子萌发,例如H.harzianum可产生β-1,3葡聚糖酶、几丁质酶、蛋白酶、乙酰氨基葡萄糖酶(N-acetyglucosaminidase)、多种抗生素和细胞壁降解酶抑制赤腐病菌分生孢子萌发和菌丝生长,致使菌丝电解质渗漏[43-44];假单胞菌(Pseudomonas spp.)可产生酚嗪(phenazine)、绿脓菌素(pyocyanine)、藤黄绿菌素(pyoluteorin)和2,4-二乙酰基间苯三酚(2,4-diacetyphloroglucinol)等[38-39,45-46]。Senthil等[30]用10个生防菌进行室内筛选,以P.fluorescens的抑制效果最好,荧光假单胞不但可对赤腐病菌产生直接作用,培养滤液也可抑制病原菌菌丝生长和分生孢子的萌芽,说明除了菌体本身外,其次生代谢物质也起到了重要作用。此外,假单胞菌可产生铁载体(siderophores),在缺铁元素的培养基上,拮抗菌对赤腐病菌的抑制效果比含有铁元素的效果要好[39,47]。
2.2 植物提取物
植物是生物活性化合物的天然宝库,其产生的次生代谢产物超过40万种,其中很多物质具有杀虫或抗菌活性。因此,植物被认为是化学合成杀菌剂替代品最好的开发资源。目前,已明确对甘蔗赤腐病菌具有抗菌活性的来源植物至少有47种[48-49]。例如,姜黄、白曼陀罗叶和桃花心木皮提取物对分生孢子萌发和菌丝生长有抑制作用[48]。秋水仙碱(colchicine)可使赤腐病菌分生孢子畸形,降低毒力[50]。相思子在室内对赤腐病菌具有较好的拮抗效果(80%),盆栽防治可将赤腐病发病率控制在24.2%,但在田间应用无效果,当与生防菌(P.fluorescens)结合使用,可获得较好的效果,赤腐病的发生率只有3.1%~3.4%,效果与化学药剂多菌灵(浓度为0.25%)的防效相当,说明植物提取物与生防菌相结合使用是一种有效防治赤腐病的途径[49]。
3 化学防治
防治甘蔗赤腐病常用的化学药剂有苯菌灵、富力库、雷多米尔等。代森锌M-45,多菌灵,雷多米尔对分生孢子的萌发抑制效果最好[48]。Subhani等[51]测试了12种杀菌剂对甘蔗赤腐病菌的毒力作用,以苯菌灵、富力库、雷多米尔和Tilet对甘蔗赤腐病菌的抑制作用最好。吴怀伟等[52]通过室内毒力测定认为多菌灵、正品甲津托、福美双和丙环唑4种化学药剂对海南赤腐病菌的毒力较强,而百菌清和代森锰锌效果较差。甲基托布津是一种广谱的系统杀菌剂,对多种作物病害具有预防和治疗性的作用。多菌灵是甲基托布津的代谢产物,在室内抑制效果明显优于甲基托布津(最低抑制浓度MIC分别为1mg/L和100mg/L),但盆栽防治效果比甲基托布津差,其中以0.25%甲基托布津悬浮液浸种24h后种植对甘蔗的存活率最好[53]。
4 农业防治
甘蔗赤腐病的发生除与品种的抗性有关外,管理措施、土壤以及气候环境也很重要。例如,在甘蔗种植时添加适量(15和25 kg/hm2)的硫酸锌可促进赤腐病的发生,施用蔗渣和滤泥可显著抑制赤腐病的发生[54]。N、P、K的配比施用对作物的茁壮生长和病害的防治起到一定的效果。赤腐病病情指数随着N比例的增加而上升,随着P比例的增加而减少[55],在生长中后期,适当增施K肥可促进甘蔗生长,减少赤腐病的发生[56]。而生长前期,干燥的条件持续时间越长,越有利于赤腐病的发生[57]。糖厂酿造废水浓度室内在40%以上可有效抑制赤腐病菌的生长和产孢,盆栽条件下,浓度在20%以下时可有效提高健康和带菌种苗的萌发率[58]。微量元素在健康和发病植物的新陈代谢中具有重要的作用,甘蔗摄取的微量元素主要分布在表层30cm的土壤中,土壤中微量元素的含量对赤腐病的发生有很大的影响。研究表明,Ca、Na、K、Fe、Mg、Zn、Cu、Mn、Cr、B和Co在赤腐病的感病地块和抗病地块的差别较大,在抗病地块土壤中Ca、Na、Fe和B的含量较低,而Mg、Zn、Mn和Cu较高,说明土壤中微量元素的含量对甘蔗赤腐病的发生影响较大[59]。
除此之外,利用橄榄木和烟叶的熏烟对分生孢子的萌发有较好的抑制作用[48]。
5 存在问题和展望
甘蔗赤腐病是世界甘蔗产区普遍发生的真菌性病害。在印度、巴基斯坦和孟加拉等国家发生较严重,是影响这些国家甘蔗生产的主要病害。与印度等国主要发生在蔗茎上的赤腐病不同,中国的赤腐病主要发生在叶片中脉和蔗茎的伤口。需要引起高度重视的是,目前赤腐病对中国甘蔗生长影响主要出现在甘蔗砍收后,对不能及时压榨的原料蔗产生严重影响。因此,对引进印度等赤腐病发生严重国家的甘蔗品种应严格检疫,防止强致病力赤腐病小种进入国内;糖厂对原料蔗砍收做好计划,尽量减少砍收后原料蔗的滞留时间。
前人在甘蔗赤腐病的抗病育种上开展了大量的工作,通过杂交、物理、化学因子诱变筛选出不少抗性效果较好的品种,并对抗性遗传规律进行了探索。但目前仍未能从分子生物学的角度明确抗性机制,如果能够清楚其机制,增强抗病育种的目的性,可大大缩短育种的周期,并能有效地育出理想品种。但赤腐病菌存在多种致病型,且容易发生变异[60],使用不同致病型的病原评价栽培品种或基因型的抗性没有统一的标准。例如,Mishra和Behera[33]用生防菌单菌株或混合菌株进行喷施处理均无法控制感病品种Co 6304赤腐病的发病率。可能是该地区的病原菌致病力较强、易产生变异。而对化学药剂产生的抗药性如何,也未见该方面的报道。
利用生防菌控制植物病害是一种环境友好型防治措施,前人已摸索出多种可用于防治甘蔗赤腐病的微生物,并探讨了这些生防菌较佳防效单菌株、组合的施用方式以及与化学药剂的兼容性。但利用微生物活体或培养滤液防治赤腐病仍需进一步的研究。例如,生防菌在土壤、植株表面或体内的存活和消长动态,次生代谢物的分解周期,复合菌株及生防菌与化学物质(或杀菌剂)混合使用增效的原因。植物源杀菌剂具有高安全性、低残留、高选择性等诸多优点,是生物农药研究的热点之一。但利用植物源杀菌剂防治甘蔗赤腐病尚处于起步阶段。目前已有多种已经产品化生产并已登记[61]。选择现已商品化的植物源杀菌剂进行筛选,可大大节省摸索时间和成本,并能便捷、有效地了解对甘蔗赤腐病菌起杀菌防病作用的物质。
选用抗病品种,合理应用农业、化学、生物、物理和其他有效技术相结合是综合防治甘蔗赤腐病的措施。例如,湿热空气处理后用多菌灵浸种、土壤施用生防菌T.viride培养物等相结合的综合措施可使中感品种的发芽率、分蘖率和产量等多项指标在不同程度上增加[62]。生防菌或生防菌次生代谢物与水杨酸或其他化学物质(FeSO4、CuSO4和ZnSO4)混合使用,可有效地提高甘蔗的产量和对赤腐病的防治效果[63]。甘蔗赤腐病是一种土传病害,土壤中微生物种群结构、表层土壤肥力以及微量元素的含量等均与病害的发生发展有紧密的联系。通过套种其他作物,改善生态小气候以及土壤微生物种群结构,是防治甘蔗赤腐病发生的一条可行途径[64]。
[1]Duttamajumder SK.Red rot of sugarcane[M].Lucknow,India:Indian Institute of Sugarcane Research(IISR),2008.
[2]McMartin A.Red rot in sugarcane in Natal[J].In:Proceedings ofthe South African Sugar Technologists'Association,1943:51-52.
[3]沈万宽.广东蔗区甘蔗病害现状与综合防治措施[J].甘蔗糖业,2004(1):1-5.
[4]万惠恩.甘蔗赤腐病发生危害简报[J].湖北植保,1994(3):1
[5]陈庭俊.福建省甘蔗病害的发生及主要病害的防治[J].甘蔗,1999,6(4):18-22.
[6]周国辉,许东林,沈万宽.甘蔗重要病害研究及防治策略[J].甘蔗糖业,2005(1):11-16.
[7]熊国如,李增平,赵婷婷,等.海南蔗区甘蔗病害种类及发生情况[J].热带作物学报,2010,31(9):1588-1595.
[8]徐志德,刘建军,黄河清,等.湖南省甘蔗主要病虫草害发生规律及防治[J].甘蔗,2000,7(2):16-18.
[9]Minnatullah M,Thakur MB,Kumar S.Effect of Colletotrichum falcatum pathotypes on yield attributes and juice quality of sugarcane[J].Indian Sugar,2007,57(9):55-60.
[10]Ogunwolu EO,Reagan TE,Flynn JL,et al.Effects of Diatraea saccharalis(F.)(Lepidoptera:Pyralidae)damage and stalk rot fungi on sugarcane yield in Louisiana[J].Crop Protection,1991,10:57-61.
[11]Yin Z,Hoy JW,Milligan SB.Evaluation and heritability ofresistance to sugarcane red rot[J].Phytopathology,1996,86(6):662-667.
[12]Kalaimani T.Biological control of red rot of sugar cane caused by Colletotrichum falcatum Went[J].Indian Sugar,2000,50(8): 489-492.
[13]Babu C,Natarajan US,Shanthi RM,et al.Inheritance of red rot resistance in sugarcane(Saccharum sp.hybrids)[J].Sugar Tech,2010,12(2):167-171.
[14]Alvi AK,Iqbal J,Shan AH,et al.DNA based genetic variation for red rot resistance in sugarcane[J].Pakistan Journal of Botany,2008,40(4):1419-1425.
[15]Ram B,Sreenivasan TV,Sahi BK,et al.Introgression of low temperature tolerance and red rot resistance from Erianthus in sugarcane[J].Euphytica,2001,122(1):145-153.
[16]Rao JT,Srinivasan KV,Alexander KC.A red-rot resistant mutant of sugarcane induced by gamma irradiation[J].Proceeding of Indian Academy Sciences,1966,64(4):224-230.
[17]Singh S.Chronic gamma irradiation induced resistance to red rot disease in sugarcane variety Co.997[J].Sugarcane Pathologists' Newsletter,1970,5:24.
[18]Shamsuzzaman KM,Majid MA,Islam MM,et al.Induced mutations in sugarcane for tolerance to red rot disease under waterlogged condition[J].Thai Journal of Agricultural Science,2002,35(2):195-200.
[19]Khairwal IS,Singh S,Paroda RS,et al.Induced mutations in sugarcane-effects of physical and chemical mutagens on commercial cane sugar and other quality traits[J].Proceedings of the Indian National Science Academy,1984,5:505-511.
[20]Kiran VB,Yadahalli KB.Effect of culture filtrate of Colletotrichum falcatum on callus growth of different sugarcane varieties[J]. International Journal of Plant Science(Muzaffarnagar),2009,4(1):98-101.
[21]Ali A,Naz S,Alam S,et al.In vitro induced mutation for screening of red rot(Colletotrichum falcatum)resistance in sugarcane(Saccharum officinarum)[J].Pakistan Journal of Botany,2007,39(6):1979-1994.
[22]Mohanraj D,Padmanaban P,Karunakaran M.Effect ofphytotoxin of Colletotrichum falcatum Went.(Physalospora tucumanensis)on sugarcane in tissue culture[J].Acta Phytopathologica et Entomologica Hungarica,2003,38(1-2):21-28.
[23]KalaimaniT.Biologicalcontrolofred rotofsugarcane caused by Colletotrichum falcatum Went[J].Indian Sugar,2000,50(8):489-492.
[24]Singh V,Joshi BB,Awasthi SK,et al.Eco-friendly management of red rot disease of sugarcane with Trichoderma strains[J]. Sugar Tech,2008,10(2):158-161.
[25]Singh N,Kumar S,Gupta ML.Effect ofsome antagonistic fungi and chemicals on red rot disease development in plant and ratoon crops of sugarcane[J].Indian Sugar,2008a,58(3):45-52.
[26]Viswanathan R,Samiyappan R.Efficacy of Pseudomonas spp.strains against soil borne and sett borne inoculum of Colletotrichum falcatum causing red rot disease in sugarcane[J].Sugar Tech,2000,2(3):26-29.
[27]Malathi P,Viswanathan R,Padmanaban P,et al.Compatibility of biocontrol agent with fungicides against red rot disease of sugarcane[J].Sugar Tech,2002,4(3-4):131-136.
[28]Begum F,Talukder MI,Hoque MZ.Comparative in vitro antagonistic potential ofsome bio-agents against Colletotrichum falcatum Went.,the cause of red rot of sugarcane[J].Planter,2007,83(978):607-616.
[29]Kumar A,Satyavir,Raj K.Effect of bio-agents on Colletotrichum falcatum incident of red rot in sugarcane[J].Cooperative Sugar,2001,32(5):355-357.
[30]Senthil N,Jayaraj J,Shanmugham V.Evaluation of fungal and bacterial antagonists against Colletotrichum falcatum Went,causing red rot of sugarcane[J].Indian Sugar,2000,50(7):423-432.
[31]Kathiresan K,Balagurunathan R,Selvam MM.Fungicidal activity of marine actinomycetes against phytopathogenic fungi[J]. Indian Journal of Biotechnology,2005,4:271-276.
[32]Muthukumarasamy R,Revathi G,Vadivelu M.Antagonistic potential of N2-fixing Acetobacter diazotrophicus against Colletotrichum falcatum Went.,a causal organism of red-rot of sugarcane[J].Current Science,2000,78(9-10):1063-1066.
[33]Mishra MK,Behera B.Field evaluation of chemicals and bioagents against Colletotrichum falcatum Went.causing red rot in sugarcane[J].Journal of Plant Protection and Environment,2009,6(2):83-87
[34]Hassan MN,Afghan S,Hafeez FY.Suppression of red rot caused by Colletotrichum falcatum on sugarcane plants using plant growth-promoting rhizobacteria[J].BioControl,2010,55(4):531-542.
[35]Viswanathan R,Rajitha R,Sundar AR.Isolation and identification of endophytic bacterial strains from sugarcane stalks and their in vitro antagonism against the red rot pathogen[J].Sugar Tech,2003,5(1-2):25-29.
[36]Samina M,Baig DN,Lazarovits G.Genetic and phenotypic diversity of plant growth promoting rhizobacteria isolated from sugarcane plants growing in Pakistan[J].Journal of Microbiology Biotechnology,2010,20(12):1614-1623.
[37]Mehnaz S,Weselowski,B,Aftab F,et al.Isolation,characterization,and effect of fluorescent pseudomonads on micropropagated sugarcane[J].Canadian Journal of Microbiology,2009,55(8):1007-1011.
[38]Hassan MN,Afghan S,Hafeez FY.Biologicalcontrolofred rotin sugarcane by native pyoluteorin-producing Pseudomonas putida strain NH-50 under field conditions and its potentialmodes ofaction[J].Pest Management Science,2011,DOI:10.1002/ps.2165.
[39]Viswanathan R,Samiyappan R.Production ofsecondary metabolites by strains of Pseudomonas spp.antagonistic to Colletotrichum falcatum causing red rotdisease in sugarcane[J].Acta Phytopathologica et Entomologica Hungarica,2004,39(1-3):29-38.
[40]Viswanathan R,Samiyappan R.Pseudomonas spp.colonization in sugarcane rhizosphere reduces titre of Colletotrichum falcatum Went causing red rot disease of sugarcane[J].Archives of Phytopathology and Plant Protection,2006,39(1):39-44.
[41]Viswanathan R,Samiyappan R.Induced systemic resistance by fluorescent pseudomonads against red rot disease of sugarcane caused by Colletotrichum falcatum[J].Crop Protection,2002,21:1-10.
[42]Viswanathan R,Samiyappan R.Induction of systemic resistance by plant growth promoting rhizobacteria against red rot disease in sugarcane[J].Sugar Tech,1999,1(3):67-76.
[43]De la Cruz J,Pintor-Toro JA,Benetiz T,et al.A novel endo-beta-1,3-glucanase,BGN13.1,involved in the mycoparasitism of Trichoerma harzianum[J].Journal of Bacteriology,1995,177(23):6937-6945.
[44]Viswanathan R,Sundar R,Premkumari SM.Mycolytic effect of extracellular enzymes of antagonistic microbes to Colletotrichum falcatum,red rot pathogen of sugarcane[J].World Journal of Microbiology and Biotechnology,2003,19(9):953-959.
[45]Hassan MN,Hafeez FY.Screening of 2,4-DAPG producing rhizobacteria from sugarcane rhizosphere[M].In:Hafeez FY,Malik KA,Zafar Y(eds).Microbial Technologies for Sustainable Agriculture.Crystal Printer:Islamabad,Pakistan,2007:77-81.
[46]Viswanathan R,Samiyappan R.Antifungal activity of chitinases produced by some fluorescent pseudomonads against Colletotrichum falcatum Went causing red rot disease in sugarcane[J].Microbiological Research,2001,155(4):309-314.
[47]Viswanathan R,Samiyappan R.Siderophores and iron nutrition on the Pseudomonas mediated antagonism against Colletotrichum falcatum in sugarcane[J].Sugar Tech,2007,9(1):57-60.
[48]Imtiaj A,Alam MS,Islam AKMR,et al.In vitro studies on Colletotrichum falcatum the causal of red rot disease of sugarcane[J]. American-Eurasian Journal of Agricultural and Environmental Science,2007,2(5):511-517.
[49]Jayakumar V,Bhaskaran R,Tsushima S.Potential of plant extracts in combination with bacterial antagonist treatment as biocontrol agent of red rot of sugarcane[J].Canadian Journal of Microbiology,2007,53(2):196-206.
[50]Singh P.Effect of colchicines on Colletotrichum falcatum Went[J].Mycopathology Mycology Application,1966,28(1-2):65-67.
[51]Subhani MN,Chaudhry MA,Khaliq A,et al.Efficacy of various fungicides against sugarcane red rot(Colletotrichum falcatum)[J].International Journal of Agriculture and Biology,2008,10(6):725-727.
[52]吴伟怀,胡冬,贺春萍,等.甘蔗赤腐病菌对碳、氮源的利用及其室内毒力测定[J].中国糖料,2008(1):14-17.
[53]Malathi P,Padmanaban P,Viswanathan R,et al.Efficacy of thiophanate methyl against red rot of sugarcane[J].Acta Phytopathologica et Entomologica Hungarica,2004,39(1-3):39-47.
[54]Saharan HS,Satyavir KA,Kumar A.Effect of different amendments on sugarcane red rot development[J].Cooperative Sugar,1994,25(7-8):303.
[55]Singh N,Kumar A,Raj K,et al.Effect of different levels of nitrogen and phosphorus on red rot development in sugarcane[J]. Cooperative Sugar,2006,37(9):23-27.
[56]农中扬.钾肥防治作物病害的效果[J].土壤通报,1989,4:175-176.
[57]Yin Z and Hoy JW.Effect of stalk desiccation on sugarcane red rot[J].Plant Disease,1997,81(11):1247-1250.
[58]Senthil N,Jayaraj J,Shanmugam V.Evaluation of distillery effluents in the management of red rot sugarcane[J].Cooperative Sugar,2001,32(7):539-541.
[59]Velmurugan S,Narayanaswamy R,Ravi S.Elemental status on different sugarcane field soils with and without red rot disease incidence by ICP-AES study[J].Romanian Journal of Biophysics,2009,19(2):97-103.
[60]Mishra MK,Behera B.Pathogenic and molecular variability of Colletotrichum falcatum Went.isolates from sugarcane with red rot disease symptoms[J].Journal of Crop Science and Biotechnology,2009,12(1):31-35.
[61]袁高庆,黎起秦,王静,等.植物源杀菌剂研究进展II:活性测定、活性物质及其应用[J].广西农业科学,2010,41(2):136-140.
[62]Singh AP,Lal RJ,Awasthi SK.Integrated management strategies for red rot disease of sugarcane[J].Sugar Tech.,2009,11(3): 300-302.
[63]Singh V,Lal RJ,Awasthi SK.Improving efficacy of metabolites of Trichoderma harzianum combined with salicylic acid and agrochemicals against red rot[J].Indian Sugar,2009,59(6):31-34.
[64]李志贤,冯远娇,杨文亭,等.甘蔗间作种植研究进展[J].中国生态农业学报,2010,18(4):884-888.
Research Progress on Controlling on Red Rot Disease of Sugarcane
LIN Shan-hai,HUANG Cheng-hua,WANG Bo-hui
(Guangxi Sugarcane Research Institute,Nanning 530007,China)
Controlling means including breeding for disease resistance,biocontrol,agricultural control and chemical controlwere summarized,and the strategy of red rotcontrolwas discussed.
red rot of sugarcane;breeding for disease resistance;biocontrol;agriculturalcontrol;chemicalcontrol
S566.1
A
1007-2624(2011)04-0069-05
2011-05-19
现代农业产业技术体系建设专项(CARS-20-2-3);公益性行业(农业)科研专项(200903004-41)。
林善海(1979-),男,博士,广西北海市人,主要从事甘蔗病害研究。
黄诚华(1974-),男,博士,副研究员,主要从事甘蔗有害生物综合防治。E-mail:chenghuahuang@sina.com
