塔里木裂腹鱼性腺形态学与组织学的研究
2011-03-17魏杰聂竹兰李杰刘宇艾则孜魏新明
魏杰,聂竹兰,李杰,刘宇,艾则孜,魏新明
(1.塔里木大学新疆生产建设兵团塔里木畜牧科技重点实验室,新疆阿拉尔843300;2.阿克苏地区水利局渔政站,新疆阿克苏843000;3.乌什县水利局渔政站,新疆乌什县843400)
塔里木裂腹鱼性腺形态学与组织学的研究
魏杰1,聂竹兰1,李杰1,刘宇2,艾则孜2,魏新明3
(1.塔里木大学新疆生产建设兵团塔里木畜牧科技重点实验室,新疆阿拉尔843300;2.阿克苏地区水利局渔政站,新疆阿克苏843000;3.乌什县水利局渔政站,新疆乌什县843400)
用解剖学、组织学方法,对塔里木裂腹鱼Schizothorax biddulphi性腺的形态、组织结构及产卵类型进行了研究。结果表明:塔里木裂腹鱼性腺发育可分为6个时期,其繁殖期为4—6月份;已达性成熟年龄的个体不是每年都参与繁殖活动,但参与繁殖活动的个体性腺发育同步,属于一次性产卵类型。
塔里木裂腹鱼;性腺发育;形态学;组织学
塔里木裂腹鱼Schizothorax biddulphi又名“塔里木弓鱼”,属鲤形目、鲤科、裂腹鱼亚科、裂腹鱼属,是中国乃至世界上唯一分布在新疆的特有种[1-2]。塔里木裂腹鱼分布于塔里木河水系,适应高原地区生活,栖息在高原地区的河流中,也进入湖泊。其肉味鲜美,深受当地群众所喜爱。1960年之前,塔里木裂腹鱼是新疆的主要经济鱼类之一。1970年之后,由于过度捕捞、外来种的引进、大量开垦荒地、引水灌田、兴修水利设施等外界条件的影响,以及塔里木裂腹鱼生长缓慢、性成熟年龄较迟等自身原因,其资源量逐年下降,目前已临近濒危[1]。塔里木裂腹鱼于1998年被列入《中国濒危动物红皮书——鱼类卷》,2004年被列为新疆维吾尔自治区二级保护动物。
为了渔业发展的需要,多年来国内外学者报道了较多鱼类性腺发育的规律[3-14],但目前尚未见塔里木裂腹鱼性腺发育方面的报道。为此,作者对塔里木裂腹鱼的性腺发育状况进行了研究,旨在丰富塔里木裂腹鱼的繁殖生物学内容,为塔里木裂腹鱼的人工繁殖、苗种培育、增殖放流以及资源保护提供参考资料。
1 材料与方法
于2008年7月—2009年6月在新疆托什干河亚曼苏闸下按月捕捞塔里木裂腹鱼,共采样12次,捕获样本356尾,其中雌鱼112尾,雄鱼244尾,样本的具体采样时间和数量见表1。对所有新鲜样本进行常规生物学测定,采用脊椎骨鉴定年龄。将性腺固定于Bouin氏液中,用常规石蜡连续切片,切片厚度为5 μm,用苏木精-伊红(HE)染色,中性树胶封片,在Olympus显微镜下观察并拍照。性腺分期主要参照施瑔芳等[4]的方法。
2 结果
244尾塔里木裂腹鱼雄鱼中有75尾性成熟,其体长为(148.5±17.9)mm,体质量为(53.66± 20.66)g,最小性成熟年龄为3+龄。112尾雌鱼中有80尾性成熟,其体长为(176.1±36.5)mm,体质量为(84.78±59.68)g,最小性成熟年龄为4+龄。塔里木裂腹鱼性腺成对,外被黑色腹膜,位于鳔的腹面两侧并紧贴体腔背面,彼此分开,末端合而为一,共同开口于泄殖孔。
2.1 卵巢发育的外部形态和组织结构
卵巢表面的被膜由两层构成,外层为腹膜,内层是结缔组织的白膜。白膜向卵巢内部伸进,与生殖上皮组成板层状结构。根据卵巢中生殖细胞的发育程度将卵巢分为6期。
第Ⅰ期卵巢:未采集到样本。
第Ⅲ期卵巢:卵巢呈透明的灰白色、扁平带状,肉眼不能分辨卵粒。在第一次性周期内由Ⅰ期卵巢发育而来的Ⅲ期卵巢致密;以后性成熟的雌鱼
Ⅲ期卵巢,或是由Ⅴ期卵巢产卵后形成,或是由Ⅵ期卵巢自然退化而成,产卵后或退化进入Ⅲ期的卵巢较松软,卵巢内具有少数大的卵粒,卵巢膜上具明显血管。显微镜下可见卵巢中多角形或圆形的Ⅲ时相卵母细胞占绝大多数。细胞核中的核仁数增加,靠近核膜内侧分布,较大的核仁通常位于核膜内缘,小核仁位于核质中,胞质中有染色不均匀的颗粒分布。大部分卵母细胞外面有一层滤泡细胞。细胞质中出现卵黄核(图1-a)。
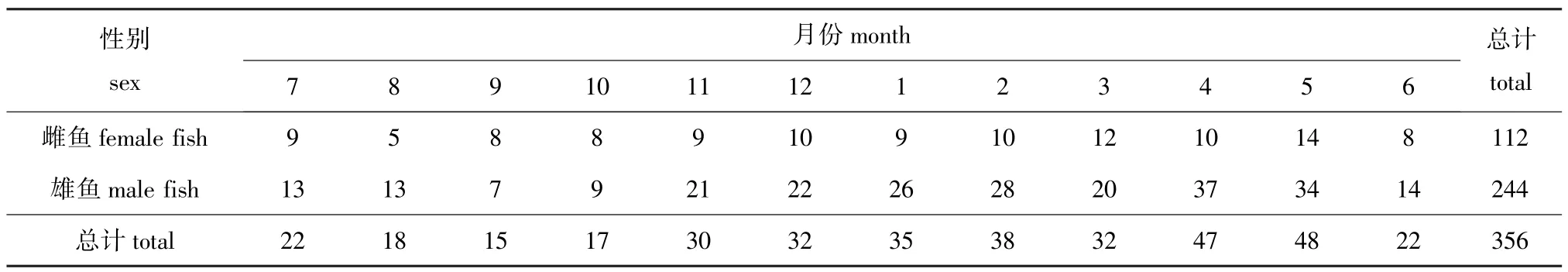
表1 样本的采集时间和数量Tab.1 The number of Schizothorax biddulphi samples and when they were collected尾
第Ⅲ期卵巢:卵巢呈淡黄色、棒状,卵巢明显增大并且增厚,卵巢膜上出现黑色素,血管密布,肉眼能分辨卵粒,但卵粒不容易被分离。显微镜下可见大量Ⅲ时相卵母细胞,靠近卵膜周围的皮质层中出现大小不一、嗜酸性的液泡(图1-b),随后液泡从皮层向中心移动,层数也略有增加,最后充满整个皮质层。核仁向细胞核中心移动,数目急剧增加,分散在核内。核周细胞质内出现染色较深的卵黄颗粒,并逐渐向细胞质外周扩散;卵母细胞核大,外周出现辐射带(图1-c)。
第Ⅳ期卵巢:体积增大呈长囊状,充满整个腹腔的一半以上。卵巢内充满橙黄色的卵粒,粒粒饱满,不易同卵巢分离,此时挤压鱼体腹部,尚不能从泄殖孔流出,卵细胞由于挤压呈不规则的多角形。切片显示,整齐的第Ⅳ时相卵母细胞占据整个卵巢空间,仅少数第Ⅲ时相卵母细胞穿插其中(图1-d)。第Ⅳ时相卵母细胞体积增大,辐射带增厚。卵黄颗粒几乎充满核外空间(图1-e),只有在核周围及靠近卵膜的边缘有较多的细胞质。细胞核及周围细胞质开始由中央移向动物极,核仁向核中央移动,逐渐溶解在核浆中,细胞核由胚泡状态过渡到成熟状态。
第Ⅴ期卵巢:卵巢松软。卵粒为圆形、橙黄色,透明,游离在卵巢中,粒粒分离。轻压鱼体腹部,卵粒便从生殖孔中流出。卵粒具有微黏性。5月份绝大多数成熟塔里木裂腹鱼的卵巢均处于此期。低倍显微镜下可见大量的第Ⅴ时相卵母细胞,但其中仍有少数的第Ⅲ时相卵母细胞和少数的第Ⅲ时相卵母细胞(图1-f)。第Ⅴ时相卵母细胞质中充满粗大的卵黄颗粒,在成熟过程中逐渐融合成块状。在卵质边缘仍有液泡。细胞核失去原形(图1 -g),最后核膜消失。
第Ⅵ期卵巢:卵巢松弛,体积缩小,呈囊状。7月份以后所采样本中达性成熟的所有个体卵巢都处于该期。切片显示,卵巢中有大量已排出卵的空滤泡和Ⅲ、Ⅲ时相的卵母细胞(图1-h),第Ⅲ时相的卵母细胞膜和细胞核都变的不规则(图1-i)。
2.2 精巢发育的外部形态与组织结构
在显微镜下可见,精巢由间介组织、精小叶和输出管组成,其中间介组织是精小叶之间的一种结缔组织。精小叶在横切面上呈圆形,像小管的断面。在每个小叶的边缘内侧分布有由生殖细胞聚集而成的精小囊。在精小囊的外面覆盖着一层薄的滤泡细胞。在小叶中,不同精小囊的生殖细胞发育先后不一致,但是同一个精小囊的生殖细胞的发育同步,它们处在形同的发育阶段。精小叶的中央是空腔,是精子排出的通路。依据精巢不同生殖细胞形态将精巢分为6期。
第Ⅰ期精巢:精巢呈细线状,外被黑色腹膜,肉眼难辨雌、雄,见于未成熟个体。切片显示,精巢中分散有大的精原细胞。精原细胞为圆形,体积较大,胞质呈弱嗜碱性。细胞核比较大,为嗜碱性,位于细胞的中央(图1-j)。
第Ⅲ期精巢:精巢呈细带状,白色半透明,血管不发达。繁殖期后再成熟的个体或初次进入生殖周期的个体都处于该期。切片中仍见精巢中有大的精原细胞分布,只是数量比第Ⅰ期精巢中的精原细胞多,体积比第Ⅰ期精巢中的精原细胞大(图1-k)。
第Ⅲ期精巢:精巢呈白色棒状,前端钝圆,其后逐渐变细,血管较Ⅲ期时丰富,表面富有弹性。此期的生殖细胞有精原细胞、初级精母细胞、次级精母细胞和少量精子细胞。初级精母细胞呈圆形或椭圆形,直径比精原细胞小,胞核染色比精原细胞
深,没有明显的核仁。次级精母细胞呈圆形,较小,细胞质很少,核嗜碱性比初级精母细胞强。精子细胞小,无明显的细胞质,只含有强嗜碱性的细胞核(图1-l)。
第Ⅳ期精巢:精巢为乳白色,前端肥大饱满,随后逐渐变细,表面有皱纹并有明显的血管分布。约占整个体腔的一半。提起鱼头,轻压腹部有少量精液流出。切片显示,精小叶腔内充满大量染色很深的精子(图1-m)。
第Ⅴ期精巢:精巢为乳白色,膨胀,充分成熟。提起鱼头轻压腹部有大量精液流出。切片显示,精小叶腔内充满大量精子,被染成紫色(图1 -n)。
第Ⅵ期精巢:排精后精巢呈松弛的细带状,精巢膜宽松坚韧。切片显示,精巢壁增厚,精小叶边缘的精小囊萎缩,精小叶腔中只有少量精子。

图1 塔里木裂腹鱼性腺发育的分期Fig.1 The gonadal development of Schizothorax biddulphi
2.3 塔里木裂腹鱼性腺发育的分期
2.3.1 未达性成熟年龄的塔里木裂腹鱼性腺发育的分期 整个采样过程中,塔里木裂腹鱼雄性最小性成熟年龄为3+龄,雌性最小性成熟年龄为4+龄, 4+龄以下的雌性个体有32尾,3+龄以下雄性个体有169尾。未达性成熟年龄的塔里木裂腹鱼数量及性腺发育分期见表2。性腺的分期特征与“2.1”和“2.2”相同。
2.3.2 达性成熟年龄的塔里木裂腹鱼性腺发育的分期 4+龄及其以上的雌性个体80尾,3+龄及其以上雄性个体有75尾。达到性成熟年龄个体不同月份性腺发育分期见表3。性腺的分期特征与“2.1”和“2.2”相同。

表2 未达性成熟的样本中性腺发育的分期Tab.2 The developmental stages of gonads in immature Schizothorax biddulphi

表3 不同月份达性成熟年龄样本中雌性卵巢和雄性精巢的发育分期Tab.3 The ovary and testis development of the mature fish samples at various months
3 讨论
3.1 卵黄核和核仁
塔里木裂腹鱼的卵巢中,从第Ⅲ时相晚期卵母细胞开始,在细胞核的旁边或在细胞质中有一个能被碱性染料染色的卵黄核,该卵黄核的存在持续到第Ⅲ时相液泡出现为止。研究表明,卵黄核内含有氧化酶,是脂肪形成中心[15]。林鼎等[16]也认为,卵黄核与脂肪卵黄-脂肪泡的出现关系密切。卵黄核内有大量的线粒体和高尔基复合体,这用Alimann氏液和Da Fano氏固定切片染色都可证实,这些线粒体可能是卵黄的前身物质。塔里木裂腹鱼的卵黄核与卵黄颗粒出现的位置一致,这与对香鱼性腺发育的研究结果相同[17]。
塔里木裂腹鱼的卵巢中,从第Ⅲ时相卵母细胞开始,在核膜内侧边缘有几个至几十个粗大、圆形的核仁,能被碱性染料染成深色。这些核仁物质逐渐脱离卵母细胞的核进入核周围的细胞质中。龚启祥等[17]在研究香鱼性腺发育时证明:卵母细胞的核仁排出物是核周的第二套卵黄的前身物质,或者与第二套卵黄形成有关。塔里木裂腹鱼卵母细胞核仁物质进入细胞质的时间和位置与核周的颗粒卵黄形成的时间一致,因此推测核仁物质与核周颗粒卵黄形成有关,具体情况还需进一步探讨。
3.2 性腺发育的分期
塔里木裂腹鱼精卵巢均分6个时期,在繁殖期后,卵巢中少数Ⅲ时相卵母细胞退化被吸收后进入Ⅲ期,开始新的发育周期。Ⅲ期卵巢维持时间为7月份至翌年2月份。而精巢发育与卵巢发育有所不同,Ⅵ期精巢在7月份恢复到Ⅲ期,11月份至翌年2月份以Ⅳ期精巢越冬,翌年3月份便有部分个体的精巢发育到Ⅴ期,4—6月份为其繁殖期。本研究结果表明,塔里木裂腹鱼雄鱼多、雌鱼少,尤其在初次性成熟前的个体中这种现象尤为突出,这与水体中饵料的丰歉有关。6—10月份天山雪融化,塔里木水系开始进入洪水期,该水系中的托什干河亦涨水;另一方面,托什干河的水温低、流速大、含沙量大,且为砂石底质,河水中饵料生物较少,所以塔里木裂腹鱼摄食困难,此期捕获的塔里木裂腹鱼基本为空肠。11月份至翌2月份不仅是塔里木水系枯水期还是其冰封期,水温下降,鱼类活动亦减弱。3月份虽然仍为枯水期,但水温开始上升,鱼类摄食强度增大,其性腺迅速达Ⅲ期。4月份后卵巢急速发育进入Ⅳ期,对于第一次产卵个体来说已能进行繁殖活动。7月份至翌年2月份,塔里木裂腹鱼性腺中营养物质不能及时补充,导致卵巢一直维持在重新发育的Ⅲ期。当鱼类生活条件发生变化时,特别是食物保障改变时,种群中雄鱼
的数量增加[18]。这也是塔里木裂腹鱼雄鱼精巢7月份迅速修复开始新的发育周期,11月份至翌年2月份以Ⅳ期精巢越冬的原因所在。
3.3 产卵类型
对塔里木裂腹鱼性腺的组织学观察和野外解剖的结果表明,部分塔里木裂腹鱼卵巢处于Ⅳ期时已能顺利产卵,产卵后Ⅵ期卵巢中有大量的空滤泡和Ⅲ、Ⅲ时相的卵母细胞,少数没有产出的Ⅳ、Ⅴ时相卵母细胞被吸收。这说明塔里木裂腹鱼一次会产完所有的卵。鱼类生殖的产卵类型有3种[19]:完全同步型、分批同步型和分批非同步型。塔里木裂腹鱼的产卵类型属于完全同步型,这与青海湖裸鲤[14]、纳木错裸鲤[11]、色林错裸鲤等均不同[10];另一部分塔里木裂腹鱼虽然其性腺在4月份已达Ⅳ期,但经催产始终不能产卵,说明已达性成熟的塔里木裂腹鱼个体并不是每年都参与产卵。这种现象与青海湖裸鲤[14]和色林错裸鲤一致[11],但具体产卵间隔时间还有待进一步研究。
[1] 乐佩琦,陈宜瑜.中国濒危动物红皮书(鱼类)[M].北京:科学出版社,1998:147-148.
[2] 王德忠.新疆的裂腹鱼亚科鱼类研究[J].干旱区研究,1998, 15(4):26-32.
[3] Chopra H C.Cytological and cytochemical study of the growing oocyte of the fish,Boleophthalmus dussumerii[J].La Cellum,1958, 60:303-318.
[4] 施瑔芳,尹伊伟,胡传林,等.鲢鱼性腺周年变化的研究[J].水生生物学集刊,1964,5(1):77-94.
[5] Iwamatsu T,Ohta T.Fine structure of loach oocytes during maturation in vitro[J].Growth Differ,1977,19:219-226.
[6] 孙朝徽,刘海金,司飞,等.养殖牙鲆性腺分化的组织学观察[J].大连水产学院学报,2008,23(6):451-454.
[7] 张凤萍,柳敏海,彭志兰,等.条石鲷卵巢发育的组织学研究[J].大连水产学院学报,2010,25(2):102-106.
[8] 龚启祥,倪海儿,李伦平,等.东海银鲳卵巢周年变化的组织学观察[J].水产学报,1989,13(4):316-325.
[9] 张克俭,何玉明,张金龙,等.兴淮鲫(白鲫♀×散鳞镜鲤♂)性腺发育的研究[J].水产学报,1995,19(1):58-64.
[10] 何德奎,陈毅峰,陈自明,等.色林错裸鲤性腺发育的组织学研究[J].水产学报,2001,25(2):97-103.
[11] 何德奎,陈毅峰,蔡斌.纳木错裸鲤性腺发育的组织学研究[J].水生生物学报,2001,25(1):1-13.
[12] 陈文银,张克俭.乌鳢卵巢发育的组织学[J].水产学报, 2003,27(2):183-187.
[13] 陈文银,李家乐,练青平.长江刀鲚性腺发育的组织学研究[J].水产学报,2006,30(6):773-777.
[14] 唐洪玉,陈大庆,史建全.青海湖裸鲤性腺发育的组织学研究[J].水生生物学报,2006,30(2):166-172.
[15] Brachet J.The biochemisitry of development[M].London:Pergamon,1960:1-44.
[16] 林鼎,林浩然.鳗鲡繁殖生物学研究:Ⅲ.鳗鲡性腺发育组织学和细胞学研究[J].水生生物学集刊,1984,8(2):157-164.
[17] 龚启祥,曹克驹,曾嶒.香鱼卵巢发育的组织学研究[J].水产学报,1982,6(3):221-234.
[18] 史为良.内陆水域鱼类增殖与养殖学[M].北京:中国农业出版社,1996:44.
[19] 施瑔芳.鱼类生理学[M].北京:农业出版社,1991:303-318.
Morphological and histological observation of gonadal development of Tarim schizothoracin Schizothorax biddulphi
WEI Jie1,NIE Zhu-lan1,LI Jie1,LIU Yu2,AI Ze-zi2,WEI Xin-ming3
(1.Key Laboratory of Tarim Animal Husbandry Science&Technology,Xinjiang Production and Construction Group,Alaer 843300,China; 2.Fishery Administration,Water Bureau of Akesu area,Akesu 843000,China;3.Fishery Administration,Water Bureau of Wushi Country, Wushi 843400,China)
The morphological and histological development of gonads and reproductive pattern were observed in Tarim schizothoracin Schizothorax biddulphi.The development of the ovary and testis was divided into six stages,and the fish spawn from April to June.In a spawning season,not all mature fish spawn,and the spawners had synchronous developmental gonads.
Schizothorax biddulphi;gonadal development;morphology;histology
2095-1388(2011)03-0227-05
S965.199
A
2010-08-27
国家自然科学基金资助项目(30960299);塔里木大学校长基金资助项目(TDZKSS07007)
魏杰(1981-),男,硕士,讲师。E-mail:weijiedky@126.com
聂竹兰(1979-),女,硕士,讲师。E-mail:niezhl2004@163.com
