脱水对条斑紫菜叶状体psbA和psbD基因表达量的影响
2011-03-14王广策张宝玉陈张帆潘光华
杨 芳,王广策,张宝玉,陈张帆,潘光华
(1.天津科技大学,天津 300457;2.中国科学院 海洋研究所,山东 青岛 266071)
潮间带是指大潮高潮线与大潮低潮线之间的海岸带,是由海洋向陆地过渡的中间地带。该地区在高潮时被海水淹没,具有一定的海洋环境特性;低潮时露出,又具有一定的陆地环境特性,因此潮间带是研究生物由海洋进化到陆地的关键区域。除了潮水涨落的变化外,潮间带地区的盐度、光照、温度等其他环境因子水平的变化幅度也很大。在这种海陆交替的特殊地区生存着许多具有特殊生活习性的物种,构成了独特的生态系统。这些生物不仅适应了潮涨潮落,对周期性的脱水和复水具有很好的耐受力,对环境因子水平的大尺度周期性变化也具有很强的适应性。
紫菜是重要的潮间带大型红藻。因含有较高含量的蛋白质、矿物质、碳水化合物和膳食纤维,紫菜早已成为人类的食物[1];紫菜养殖业在中国、日本、韩国等国家也已经成为大规模的大型海藻产业之一。条斑紫菜(Porphyra yezoensisUeda)是紫菜属中的重要物种,主要生长在太平洋西北部包括中国东部沿岸在内的大部分地区,日本和韩国沿岸[2]。研究表明条斑紫菜具有耐干出的特点,暴露在空气中几天仍然能够在海水中完全恢复[3]。利用条斑紫菜的耐干出特点,将其在空气中人工干出已经成为条斑紫菜养殖和保种的重要应用技术之一。条斑紫菜的半浮筏式养殖法就是让附着在养殖网上的紫菜随潮汐涨落经历脱水(干出)复水过程。这种养殖方法很适合在潮汐落差较大的潮间带[2]。海水养殖业的经验证明,在空气中适当干出藻体可以增强藻体对病害的抵御能力,去除竞争性杂藻,如硅藻,从而提高紫菜的质量和产量[2]。此外,传统的保存条斑紫菜叶状体的方法是将紫菜放在阴凉处迅速晾干置于-20℃保存,这种保存方法在发展中国家仍然很常用。如果将藻体脱水至含水量 20%左右,藻体可以保存将近 12个月[2]。由此可见,条斑紫菜的养殖和保种都得益于其耐干出特性,这使得研究脱水对条斑紫菜的影响意义重大。
光合作用受到多种环境因子的影响,其中影响最大的因素就是水分[4]。因此,很多人研究了潮间带大型海藻在脱水过程中的光合活性的变化。研究发现一些潮间带大型海藻在适度脱水时光合速率会显著增强[3,5-8];而腹枝藻[9],坛紫菜[10]和半叶紫菜[4]在适度脱水过程中则没有光合速率增大的现象。但是,这些研究多是停留在生理水平上,很少有报道涉及大型海藻在脱水过程中的分子水平的变化机制。条斑紫菜作为光能自养型生物,其光合作用对水分变化十分敏感,但是其又具有脱水数小时后遇水能快速恢复的特性,并且这种特性被广泛应用于条斑紫菜的养殖和保种业中。因此,在分子水平上研究条斑紫菜光合作用的相关蛋白对脱水复水的响应机制具有十分重要的意义。
叶绿体是进行光合作用非常重要的细胞器。条斑紫菜的叶绿体为星状,很不规则,从进化的角度上说属于很低等的[11]。在条斑紫菜叶绿体内的类囊体膜上镶嵌有光系统 I ( PSⅠ) 和光系统Ⅱ( PSⅡ)蛋白复合体。PSⅡ的反应中心是反应中心蛋白结合P680、去镁叶绿素等电子传递体的复合物,该复合物将电子由PSⅡ传递给PSⅠ,从而完成光合作用重要步骤[12]。PSⅡ的D1 和D2两个反应中心蛋白分别由叶绿体基因psbA 和psbD编码。因此,研究藻类的psbA 和psbD基因对研究其光合作用具有重要意义。对于条斑紫菜,陈张帆等人研究了其不同生长阶段——壳孢子、孢子体和叶状体,psbA 和psbD基因转录水平的不同,结果表明不同阶段的条斑紫菜psbA 和psbD转录水平上的相对表达量不同,认为壳孢子发育成叶状体的过程需要光合作用提供能量[13]。而有关条斑紫菜的psbA 和psbD在脱水复水过程中表达量的变化尚未见报道。
本实验选取处于不同脱水和复水阶段的条斑紫菜叶状体为材料,对其psbA和psbD转录水平上的相对表达量进行研究,以探讨组装 PSⅡ的中心蛋白(D1,D2蛋白)的基因在条斑紫菜处于不同脱水复水阶段时的变化。
1 材料与方法
1.1 样品的采集及制备
条斑紫菜叶状体于 4月份采于青岛第一海水浴场,用灭菌海水冲洗干净。吸干藻体表面可见水珠,称取适量藻体于密闭塑料袋中,-80℃冰箱保存,作为相对含水量为100%的实验材料。将剩余藻体进行阴干处理,让其于实验室条件下自然脱水 15 min、60 min和105 min,分别于密闭塑料袋中-80℃冰箱保存。剩余藻体进行复水30 min处理后于密闭塑料袋中-80℃冰箱保存。
1.2 样品相对含水量的测定及定量PCR分析
1.2.1 条斑紫菜体叶状体相对含水量测定
相对含水量测定方法:吸干藻体表面可见水珠,用分析天平称初始质量。与1.1.2同种处理方法对藻体进行脱水处理,每15 min测定1次藻体质量。最后 1次称质量后,将藻体置于 60℃烘箱中,烘干至恒质量(约48 h),作为藻体干质量,并计算相对含水量(3个平行样)。
相对含水率(RWC)计算公式:
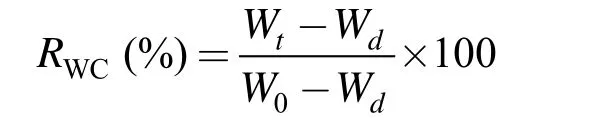
其中,W0为初始质量(g),Wt为特定时间藻体质量(g),Wd为藻体干质量(60℃,48 h)。
1.2.2 总RNA提取
将100 mg条斑紫菜叶状体样品分别于液氮中充分研磨至粉末状,转移到 1.5 mL离心管中。加入1 mL Trizol(Invitrogen)试剂混匀,室温放置5 min。13 000g,4℃,离心1 0 min。取上清移至新离心管中。加入200 μL预冷的氯仿,振荡15 s,室温下静置2~3 min。13000g,4℃,离心15 min。取上清移至新离心管中。加入500 μL预冷的异丙醇,于-20℃冰箱中静置 20~30 min。13 000g,4℃,离心 10 min。弃上清,沉淀中加入1 mL 预冷的75%乙醇洗涤沉淀。10 000g,4℃,离心5 min。弃上清,于超净工作台中风干 5 min。加入适量的 DEPC水溶解 RNA,于-80℃保存。琼脂糖凝胶电泳检测总RNA的质量。
1.2.3 总RNA中微量DNA的去除
提取的总 RNA中加入 RQ1 Rnase-Free Dnase(Promega),37℃,30 min消化DNA。加入4 μL Stop Solution,65℃反应10 min,终止消化反应。
1.2.4 cDNA合成
根据 M-MLV 逆转录酶(Promega)的说明书,在新的离心管中加入随机引物(100μmol/L)2.7 μL,消化好的RNA模板10.65 μL。70℃,变性5 min。转移到冰上冷却 2 min。在离心管中加入:M-MLV 5☓Reaction Buffer 5μL,dNTP mix(10 mmol/L)5 μL,RNase Inhibitor 0.65 μL,M-MLV RT 1μL。36℃,反转录60 min。稀释1 000倍作为荧光定量PCR的模板,于-20℃保存待用。
1.2.5 荧光定量PCR
荧光定量PCR所用引物及反应条件引用陈张帆的实验方法[13],引物由上海生工合成。每个样品均重复3管,设空白对照。
1.2.6 数据分析
根据△△CT法[14]分析数据。计算psbA和psbD的相对表达量的差异,采用t检验方法进行两两比较以判断有无显著差异。
2 结果
2.1 条斑紫菜叶状体相对含水量测定结果
在条斑紫菜干出过程中每隔15 min测定一次材料的质量,计算出实验所用条斑紫菜叶状体的相对含水量,并拟合出相对含水量与材料脱水时间的关系曲线。根据所得数据可以确定条斑紫菜在未脱水,脱水15 min、60 min和105 min时藻体的相对含水量分别约为100%、71%、34%和21%。
2.2 样品总RNA的检测
获得的样品的总 RNA在电泳图谱(图1)中出现28S,18S rRNA清晰的电泳带,1,2,3,4,5所对应的条带从下到上分别为5S,18S,28S rRNA。本研究使用的总RNA含量较高,纯度好且无降解。

图1 条斑紫菜总RNA琼脂糖凝胶电泳图谱Fig.1 Agarose gel electrophoresis of RNA extracted from Porphyra yezoensis with various relative water content (RWC) of rehydration
2.3 psbA、psbD相对表达量的变化
如图2所示,psbA、psbD基因在脱水过程中相对表达量呈先增大后减小的趋势,并且psbA基因的相对表达量的变化幅度比psbD基因要大。在含水量约为 71%时两基因的相对表达量均达到最大,此时,psbA基因的相对表达量是正常状态(相对含水量100%)下该基因的相对表达量的 7.18倍(P <0.01);psbD基因的相对表达量是正常状态下该基因的相对表达量的3.13倍(P <0.01);psbA基因的相对表达量是psbD基因的相对表达量的2.29倍(P <0.05)。进一步脱水的过程中,两个基因的相对表达量都降低,当含水量达到21%时两基因的相对表达量基本持平,且都比正常状态下的相对表达量低(P <0.01)。复水后,psbA基因的相对表达量是正常状态下的0.68倍(P <0.01);psbD基因的相对表达量是正常状态下的0.30倍(P <0.01);此时,psbA基因的相对表达量是psbD基因的相对表达量的2.25倍(P <0.01)。
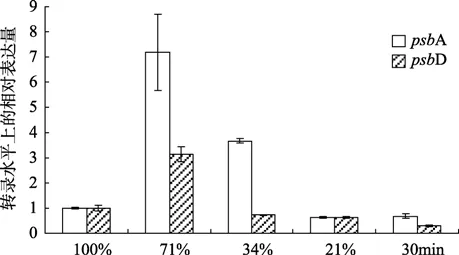
图2 Real-time PCR检测不同脱水复水阶段的条斑紫菜细胞中psbA, psbD基因的转录水平上相对表达量的变化Fig.2 Variations in psbA and psbD transcript levels using real-time PCR.Total RNA was isolated from samples with various relative water content (RWC) of rehydration
3 讨论
条斑紫菜叶状体中具有很高的多糖和蛋白含量,这给提取纯度较高质量较好的RNA带来了困难。本研究通过Trizol法得到了条斑紫菜叶状体的总RNA中18S和28S rRNA,其电泳条带都较清晰且没有拖尾降解现象,表明通过这种方法提取的RNA质量较好。荧光定量PCR技术是一种可以检测低丰度基因表达的技术。本实验中使用能非特异性地渗入DNA双链中发生荧光信号的SYBR Green染料,因此在实验中要避免产生非特异性扩增与引物二聚体。所采用的三对特异性引物(psbA、psbD和18S rRNA的引物)均使用陈张帆[13]已被证实的引物。实验数据处理上采用了相对定量法,有效降低了各种误差。
有关缺水对高等植物光合作用影响的研究已经比较深入。早期有研究表明,PSⅡ对脱水甚至是轻微脱水都很敏感,严重时会发生损伤[15]。但也有研究指出,PSⅡ甚至整个光合作用复合体可以积极抵御缺水胁迫[16-17]。对于高等植物在水分胁迫下的psbA、psbD表达量的变化已有人研究。刘文娟等人对两种小麦品种绵农4号和5号的研究表明水分胁迫下,两种小麦的 PSⅡ主要基因(psbA、psbD)的转录水平下降[18];Yuan Shu等[19]对大麦的研究结果也表明水分胁迫下,大麦的 PSⅡ主要基因(psbA、psbD)的转录水平会下降;He等[20]的研究结果表明,小麦(Triticum aestivumL.cv.Longchun No.10)的psbA、psbD在缺水情况下表达量降低是由于转录水平降低或者mRNA 的稳定性降低;Collett等[21]发现Xerophyta humilis的psbR,ChlP,psbA和psbP基因在该植物脱水过程中分别呈现不同程度的转录水平上的表达量下降趋势;Zhang等[22]的研究结果则表明沙漠植物Ammopiptanthus mongolicus在缺水的情况下的cab基因会下调,但是psbA基因则没有很大变化。对于高等植物缺水状态下的光合作用的分子变化机制的研究不仅局限于此,但是有关潮间带大型海藻对脱水的研究却多在生理水平上,几乎没有深入到分子水平的相关研究。
本实验用荧光定量PCR技术检测了条斑紫菜叶状体不同脱水复水阶段中的psbA 基因(编码 D1)和psbD基因(编码D2)在转录水平上的相对表达量的变化。选用脱水15 min,60 min,105 min(即对应相对含水量为71%,34%,21%)分别代表轻微脱水、中度脱水和严重脱水 3个阶段。结果表明在轻微脱水状态下,psbA、psbD相对于18S rRNA (管家基因)的表达量呈现先增大后降低的趋势(图2)。这个研究结果与高等植物在脱水过程中的相应研究结果相差甚远,但是恰恰与之前本组实验人员通过调制叶绿素荧光仪研究的条斑紫菜在脱水过程中PSⅡ活性的变化趋势相一致:即 PSⅡ活性在藻体轻度脱水状态下反而比正常状态下的略有升高,并且随着脱水程度的加剧,其活性逐渐降低至接近于零(未发表资料)。根据这些实验结果推测:由于条斑紫菜在轻度脱水时仅是藻体细胞表层水分蒸发,使藻体细胞能够更好的接触到空气中较多的 CO2,导致藻体本身需要更多的化学能来固定碳,因此形成反馈调节。为促使光反应增强,编码PSⅡ的中心蛋白的psbA、psbD基因会表现出较高的转录水平以满足其需求,从而导致了PSⅡ的活性出现暂时增强的现象。由此,作者推断在轻度脱水状态下psbA和psbD基因转录水平上的相对表达量的快速增大可能是藻体暴露在空气中时适应陆地环境的初始响应。而随着脱水程度的加剧,细胞本身水分挥发,没有足够的水进行正常的生命活动,光合作用的光化学反应也没有足够的水以备裂解。表现为 PSⅡ的活性迅速降低,藻体本身不再需要大量的PSⅡ中心蛋白。因此,psbA、psbD基因会有较低的转录水平以减少物质消耗而处于光合作用减弱甚至是休眠状态。
然而,在测定PSⅡ的中心蛋白D1、D2的mRNA分子表达水平的变化时发现,虽然psbA、psbD的相对表达量都呈现相同的变化趋势,但增大的幅度却相差很大(图2)。Kapoor等[23]在水稻的生长发育过程中也发现,虽然psbA和psbD基因的表达均增大,但是它们的增大倍数不同。这与本研究的结果一致,表明虽然D1蛋白和D2蛋白在PSⅡ反应中心复合物中以同比例装配,但是psbA和psbD基因的mRNA水平上的表达量变化幅度并不同步。此外,有关D1蛋白的研究表明,D1蛋白暴露于强光下或处于强光与环境胁迫相偶联的环境时,其降解速率就会超过合成速率[24-25]。类囊体膜发生损伤时,D1蛋白开始周转,同时 PSⅡ伴随着新合成的 D1蛋白的合成重新组装。对蓝藻Synechocystissp.PCC6803的研究表明,对蛋白合成过程中的表达步骤的控制是在高光强下PSⅡ光抑制的主要原因[26],而psbA基因的 mRNA的翻译是D1蛋白合成的关键调控步骤[27-28],这使得研究psbA基因 mRNA的表达量具有更重要意义。条斑紫菜脱水过程中psbA基因转录水平上的相对表达量高于psbD基因,可能是由于脱水过程导致 D1蛋白快速周转,因此需要大量的psbA基因的mRNA来支持D1蛋白的快速周转。同时说明,对于不同的psbA和psbD基因的mRNA水平的相对表达量而言,二者的有效翻译率或组装率必定不同。
另外,有研究表明 Dl蛋白的合成还受 PSⅡ中其他蛋白质协同表达的影响。在缺失psbD的Chlamydomonas reinhardtii中,尽管 D1蛋白的mRNA含量正常,但由于D2蛋白不能被合成,因此Dl蛋白也不存在[29];反之,在psbA失活的Syneehocystis6803的突变体中,Dl蛋白不能形成,D2蛋白也不积累[30]。即真正组装的PSⅡ的中心蛋白的量是由相对含量较少的蛋白决定的。本实验中,虽然在轻度(RWC 71%)和中度(RWC 34%)脱水状态下psbA基因的相对表达量是psbD基因的相对表达量的2.29倍(P <0.05)和5倍(P <0.01),但psbD基因的相对表达量较低,因此认为真正组装的 PSⅡ的中心蛋白的量不是由psbA基因的mRNA决定,而是由psbD基因的 mRNA决定。有关引起psbA和psbD基因的表达量变化趋势不一致的原因还有待进一步研究。
[1]Noda H.Health benefits and nutritional properties of nori [J].J Appl Phycol,1993,5:255-258.
[2]马家海,蔡守清.条斑紫菜的栽培与加工 [M].北京:科学出版社,1996:1-120.
[3]Lipkin Y,Beer S,Eshel A.The ability ofPorphyra linearis(Rhodophyta) to tolerate prolonged periods of desiccation [J].Bot mar,1993,36:517-523.
[4]Lin A P,Wang G C,Yang F,et al.Photosynthetic parameters of sexually different parts ofPorphyra katadaivar.hemiphylla(Bangiales,Rhodophyta) during dehydration and re-hydration [J].Planta,2009, 229:803-810.
[5]Quadir A,Harrison P J,Dewreede R E.The effects of emergence and submergence on the photosynthesis and respiration of marine macrophytes [J].Phycologia,1979,18:83-88.
[6]Johnston A M,Raven J A.The analysis of photosynthesis in air and water ofAscophyllum nodosum(L.) Le Jol.[J].Oecologia,1986,69:288-295.
[7]Madsen T V,Maberly S C.A comparison of air and water as environments for photosynthesis by the intertidal algaFucus spiralis(Phaeophyta) [J].J Phycol,1990,26(1):24-30.
[8]Sampath-Wiley P,Neefus C D,Jahnke L S.Seasonal effects of sun exposure and emersion on intertidal macroalgae physiology:Fluctuations in antioxidant contents,photosynthetic pigments and photosynthetic efficiency in the red algaPorphyra umbilicalisKützing(Rhodophyta,Bangiales) [J].J Exp Mar Biol Ecol,2008,361(2):83-91.
[9]Hodgson L M.Photosynthesis of the red algaGastroclonium coulteri(Rhodophyta) in response to changes in temperature,light intensity,and desiccation[J].J Phycol,1981,17(1):37-42.
[10]Zou D H,Gao K S.Effects of desiccation and CO2concentrations on emersed photosynthesis inPorphyra haitanensis(Bangiales,Rhodophyta),a species farmed in China[J].Eur J Phycol,2002,37:587-592.
[11]李映霞.三种红藻光合作用色素系统的比较研究[D].青岛:中国科学院海洋研究所博士论文,2007:1-110.
[12]Buchanan B B.Biochemistry and Molecular Biology of Plants [M].Beijing:Science Press,2000:586-601.
[13]陈张帆,王广策.条斑紫菜光系统Ⅱ反应中心蛋白编码psbA和psbD 的表达分析 [J].海洋科学,2008,32(7):52-56.
[14]Livak K J,Schmittgen T D.Analysis of relative gene expression data using Real-time quantitative PCR and the 2-ΔΔCTmethod [J].Methods,2001,25:402-408.
[15]Havaux M,Canani O,Malkin S.Photosynthetic responses to water stress in leaves expressed by photoacoustics and related methods.II.The effect of rapid drought on the electron transport and relative activities of the two photosystems [J].Plant Physiol,1986,82:834-839.
[16]Cornic G.Drought stress inhibits photosynthesis by decreasing stomatal aperture — not by affecting ATP synthesis [J].Trends Plant Sci,2000,5:187-188.
[17]Havaux M.Stress tolerance of photosystem II in vivo:antagonistic effects of water,heat,and photoinhibition stresses [J].Plant Physiol,1992,100:424-432.
[18]刘文娟,袁 澍,张年辉,等.水分胁迫对不同小麦品种光系统Ⅱ功能基因psbA,psbD及cab表达的影响 [J].西北植物学报,2005,25(4):714-718.
[19]Yuan S,Liu W J,Zhang N H,et al.Effects of water stress on major photosystem II gene expression and protein metabolism in barley leaves [J].Physiol Plantarum,2005,125(4):464-473.
[20]He J X,Wen J Q,Chong K,et al.Changes in transcript levels of chloroplastpsbA andpsbD genes during water stress in wheat leaves [J].Physiol Plantarum,2002,102(1):49-54.
[21]Collett H,Butowt R,Smith J,et al.Photosynthetic genes are differentially transcribed during the dehydration-rehydration cycle in the resurrection plant,Xerophyta humilis[J].J Exp Bot,2003,54(392):2593-2595.
[22]Zhang L X,Li W R,Bi Y R,et al.Water availability affects photosynthetic gene expression in the desert plantAmmopiptanthus mongolicus[J].Israel J Plant Sci,2002,50:243-250.
[23]Kapoor S,Maheshwari S C,Tyagi A K.Developmental and light-dependent cues interact to establish steady-state levels of transcripts for photosynthesis-related genes(psbA,psbD,psaA andrbcL) in rice(Oryza sativaL.) [J].Curr Genet,1994,25:362-366.
[24]Anderson J M,Park Y I,Chow W S.Photoinhibition and photoprotection of photosystem Ⅱ in nature[J].Physiol Plant,1997,100:2l4-223.
[25]Niyogi K.Photoprotection revisited:genetic and molecular approaches [J].Annu Rev Plant Physiol Plant Mol Biol,1999,50:333-359.
[26]Yokota A,Takahara K,Akashi K.Water stress.Madhava Rao K V,Raghavendra A S,Janardhan Reddy K (eds.).Physiology and Molecular Biology of Stress Tolerance in Plants[M],Springer Netherlands,2006:15-39.
[27]Staub J M,Maliga P.Translation ofpsbA mRNA is regulated by light via the 5’-untranslated region in tobacco plastids [J].Plant J,1994,6(4):547-553.
[28]Hirose T,Sugiura M.Cis-acting elements and trans-acting factors for accurate translation of chloroplastpsbA mRNAs:development of an in vitro translation system from tobacco chloroplasts [J].EMBO J,1996,15(7):1687-1695.
[29]Erickson J M,Rahire M,Malnoë P,et al.Lack of the D2 protein in aChlamydomonas reinhardtii psbD mutant affects photosystem II stability and D1 expression[J].EMBO J,1986,5(8):1 745-1 754.
[30]Nilsson F,Andersson B,Jansson C.Photosystem II characteristics of a constructedSynechocysfis6803 mutant lacking synthesis of the D1 polypeptide [J].Plant Mol Biol,1990,14:1 051-1 054.
