人源Fab段噬菌体抗体库的构建及抗IL-4抗体的初步筛选*
2011-03-13胡占东朱铁虹畅继武
胡占东 公 倩 朱铁虹 畅继武
白细胞介素(IL)-4是具有多种生物学功能的细胞因子。在细胞免疫和体液免疫中发挥重要作用。新近研究表明,IL-4与哮喘、肾脏疾病和肿瘤等疾病的发病机制密切相关[1-2]。但由于传统检测技术较复杂,研究IL-4与上述疾病的内在相关性存在困难。因此寻找一种快速而具有高度特异性的方法是研究IL-4的关键。噬菌体抗体库是在噬菌体展示技术的基础上建立起来的。该技术不经免疫,避免了杂交瘤技术繁琐过程,直接通过噬菌体展示人源抗体。本研究运用这一技术构建了大容量的人源噬菌体抗体元件库,并从中筛选得到IL-4-Fab抗体,为进一步解决IL-4抗体的表达与纯化,制备新型的检测试剂盒奠定基础。
1 材料与方法
1.1 材料 (1)试剂。RNA提取纯化试剂TRIzol购自Invit-rogen公司;逆转录试剂盒(Quantscript RT KIT),DNA聚合酶(2XTaq PCR Master Mix),质粒提取试剂盒,DNA凝胶回收试剂盒购自北京TIANGEN公司;T4 DNA连接酶和限制性内切酶SpeⅠ、XhoⅠ、SacⅠ和XbaⅠ购自TaKaRa公司;胰化蛋白胨和酵母提取物购自英国Oxoid公司,氨苄青霉素(Amp)、四环素(Tet)、卡那霉素(Kan)、Tween20、PEG8000,Tris碱、牛血清白蛋白(BSA)和IL-4均购自Sigma公司。(2)载体、宿主菌与辅助噬菌体。具有抗氨苄青霉素特性的噬菌粒载体pComb3XSS由美国Scripps研究所CarlosF.Barbas博士赠送。大肠杆菌XL1-Blue由本室保存。辅助噬菌体VCSM13含卡那霉素抗性基因,购自美国Stratagene公司。(3)PCR引物。参考美国Scripps研究所设计的一组引物[3],由Invitrogen公司合成。
1.2 方法
1.2.1 重链Fd和轻链基因的获得 抽取来自天津市泌尿外科研究所18例健康成人外周血,分离淋巴细胞。每1×107细胞加入1 mL TRIzol充分裂解细胞,提取总RNA,琼脂糖凝胶电泳鉴定总RNA。以Oligo(dT)15为引物,用Quantscript RT试剂盒逆转录为cDNA,分别以重链和轻链5端和3端引物[3]的不同组合聚合酶链反应(PCR)扩增重链Fd段和轻链基因片段。扩增条件为:94℃预变性3 min。94℃变性1 min,退火温度因引物的不同组合在52℃~58℃之间变动时间为45 s,72℃延伸1 min。30~32循环后72℃延长10 min。琼脂糖凝胶回收试剂盒回收纯化扩增的DNA,-20℃保存备用。重链5端引物含XhoⅠ酶切位点CTCGAG,3端引物含SpeⅠ位点ACTAGT。轻链5端引物含SacⅠ位点GAGCTC,3端引物含XbaⅠ位点TCTAGA。
1.2.2 人源Fab抗体库的构建及鉴定 将轻链PCR产物混合和载体pComb3XSS分别用SacⅠ和XbaⅠ双酶切,电泳后回收纯化DNA。取载体pComb3XSS的酶切片段与轻链PCR酶切片段,在连接酶作用下16℃过夜。将连接产物加入感受态细胞XL1-blue,进行电转化,摇菌培养构建轻链库[4]。提取轻链库的质粒,经SacⅠ和XbaⅠ酶切鉴定。后将轻链库噬粒DNA和重链Fd段PCR产物分别用XhoⅠ和SpeⅠ双酶切,电泳回收目的条带基因,连接,电转化感受态细胞,加入3 mL预热SOC培养基,37℃振荡培养1 h后取部分稀释后铺板,其余加入10 mL预热的SB+A+T培养基,37℃振荡培养1 h后加Amp至100 mg/L,振荡1 h,加入辅助噬菌体VCSM13约1012pfu/mL混匀后并入100 mL SB+A+T培养基,振荡培养2 h后加入Kan至70 mg/L后振荡培养过夜。次晨离心收集上清后加入PEG沉淀液,冰浴后离心弃上清,1%BSA-PBS溶解沉淀后离心收集上清即为构建的人源Fab段抗体库。取噬菌体Fab段抗体库上清感染对数生长期的XL1-blue菌液,铺板过夜培养,测定库容。抗体库酶切鉴定:从平板上随机抽取10个菌株,提取质粒,经XhoⅠ和SpeⅠ、SacⅠ和XbaⅠ、SacⅠ和SpeⅠ,双酶切,XhoⅠ单酶切鉴定。
1.2.3 抗IL-4-Fab抗体的筛选 参考文献[5]方法,以IL-4为抗原包被于96孔板中,次日3%BSA-PBS封闭后加入新鲜制备的抗体库上清,湿盒中37℃孵育2 h;弃抗体库液,用含0.05%Tween-20的PBS洗去未结合的噬菌体抗体。用pH为2.2的Gly-HCl缓冲液洗脱后以2 mol/L Tris中和至中性,感染2 mL对数生长期的大肠杆菌XL1-blue后37℃孵育1 h。取100 μL梯度稀释后铺板测定滴度,计算每轮筛选的产出率;余菌进行下一轮的富集,共5轮。
1.2.4 噬菌体-酶联免疫吸附法(Phage-ELISA)检测和阳性克隆基因测序 从第5轮筛选的平板上随机抽取30个单克隆分别制备噬菌体抗体上清。包被IL-4抗原于酶标板上,同时设空载体pComb3XSS噬菌体、无关抗原BSA作为阴性对照。3%BSA-PBS封闭后加入噬菌体抗体上清[6],37℃孵育2 h。PBST冲洗,加入HA-Tag小鼠单抗,37℃孵育1 h后冲洗,加入HRP-山羊抗小鼠IgG,37℃孵育1 h,洗板后加TMB显色,酶标仪测A450值,取A450值最高的阳性菌株测序。
2 结果
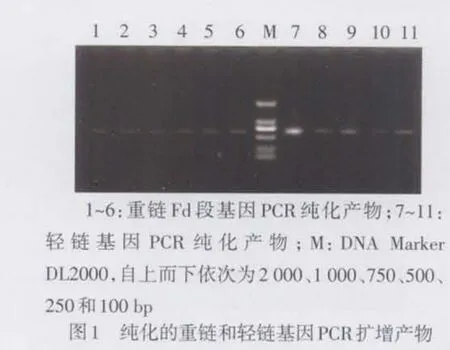
2.1 重链Fd和轻链基因片段的获得 PCR扩增重链Fd和轻链基因片段,纯化产物经琼脂糖凝胶电泳,于680 bp处可见特异性的目的基因片段,见图1。
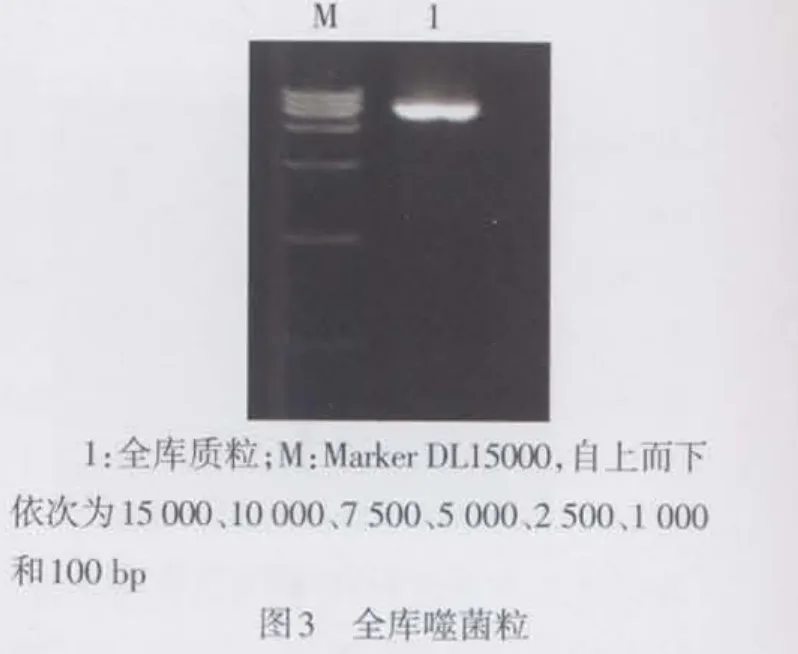
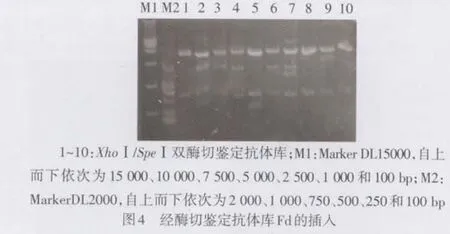
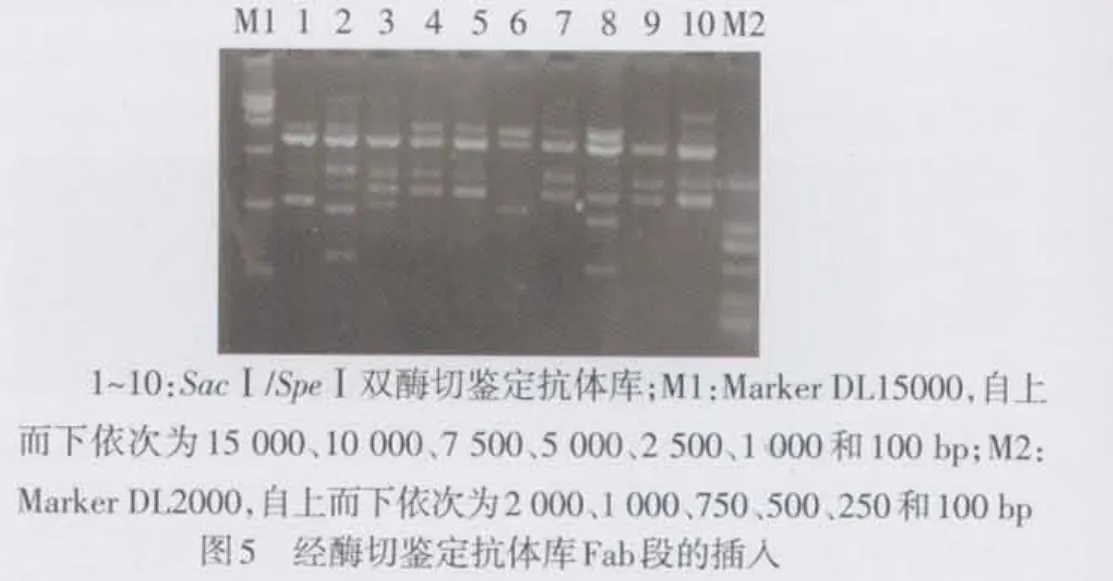
2.2 人源Fab抗体库的构建及鉴定 轻链库质粒双酶切,10个克隆均显示出680 bp左右的片段,见图2。构建的Fab段抗体库,计算菌落测定库容为2.4×108。构建的全库单克隆经提取质粒电泳,见图3。酶切鉴定:(1)SpeⅠ和XhoⅠ酶切重组质粒pComb3XSS,鉴定重链Fd的插入,经电泳可见10个质粒中9个显示出680 bp大小片段,见图4。(2)SacⅠ/ SpeⅠ酶切重组质粒pComb3XSS鉴定Fab的插入,见图5。电泳显示10个质粒中有8个含有约1 500 bp左右的基因片段,重组率为80%。

2.3 IL-4噬菌体抗体的初步制备与鉴定 以IL-4为抗原对抗体库进行5轮筛淘,筛选下来的噬菌体抗体滴度分别为4.7×104、1.04×105、2.4×105、5.1×106、1.6×107。第5轮比第1轮噬菌体抗体滴度增加340倍,ELISA检测筛选抗体的抗原结合活性,其中有5个呈阳性,阳性率为16.7%。A450值最高的单克隆质粒测序结果显示轻链核苷酸序列与λ链序列同源性为94%,重链核苷酸序列与人免疫球蛋白γ链同源性为91%。
3 讨论
利用杂交瘤技术制备的单克隆抗体在疾病的诊断、治疗等方面发挥了重要的作用[7]。但由杂交瘤技术制备的动物源性抗体容易引起排异反应,且制备过程复杂,因此限制了其应用。制备人源化抗体能解决上述不足。将人抗体基因片段组装到载体内,然后展示到噬菌体表面得到多样性噬菌体抗体的集合即为人源噬菌体抗体库,可从中筛选到人源化的抗体。噬菌体抗体库技术因而成为制备人源抗体的一项重要技术。用此方法对选定的抗原筛选特异性抗体,时间短,价格低廉,并能大量制备人源化抗体。此法克服了人单克隆抗体杂交瘤细胞中抗体不稳定、容易丢失的不足及人源抗体来源的困难。
抗体库的构建是获得特异性人源抗体的先决条件,其制约因素有抗体片段的形式、基因来源、抗体库的容量和多样性等。目前人源抗体库主要有2种形式:ScFv和Fab,ScFv是通过化学键把抗体重轻链的可变区连接起来,其特点是表达产量高,但易形成多聚体[8],在人体内易被代谢,而Fab是表达的重链的Fd段和完整的轻链通过二硫键形成异二聚体,其产量较ScFv低,但在人体内较稳定。研究表明,Fab段抗体含有完整的轻链和重链的第一恒定区,具有与抗原结合的独立功能,经储存1年后,活性无明显变化[9],Fab段抗体易转化成结合抗原的功能分子。基于上述因素,本实验利用噬菌体抗体展示技术构建了人源Fab段噬菌体抗体库,为今后筛选更优质抗体的工作奠定了基础。抗体基因的来源,库容与多样性同样影响抗体库的质量。本研究从18例健康成人的外周血淋巴细胞中提取总RNA,经40多对引物扩增出Fab抗体基因片段,采用电转化法进行多次转化,构建出库容约2.4×108的人源Fab段抗体库,阳性克隆提取质粒,经酶切鉴定重组率为80%,表明库构建良好。
大肠杆菌中能否成功表达Fab段基因,载体的选择与设计是关键[10]。本实验选择噬菌粒pComb3XSS作为载体构建抗体元件库。在pComb3的基础上进行了改进,其优点在于增加了载体的稳定性;带有6×His及HA-Tag,为以后的抗体纯化与检测搭起桥梁;引入琥珀酸终止密码子,可终止pⅢ融合蛋白的表达,为抗体表达做准备。
实验中,笔者采用固相化抗原吸附法,将IL-4以递减的稀释浓度包被于96孔板上,选择适当强度,在保证克隆稳定的前提下,对构建的抗体库进行5轮筛选,可以看到特异性Fab段抗体的得到约340倍的富集。Phage-ELISA检测显示筛选到的噬菌体抗体具有一定的IL-4结合活性和特异性,阳性克隆在提取质粒后进行DNA测序,用NCBI中的Nu⁃cleotide Blast软件对其序列进行分析,结果显示抗体重链属IgG亚类,轻链为λ链,序列同源性均在90%以上。这表明该方法筛选成功率高,且操作简便易行,为体外大规模生产人源抗体和检测血中IL-4水平,提供简便价廉有效的方法。利用该技术有望筛选出优质的人源性IL-4-Fab抗体,运用于临床诊治中。
[1]Chiba Y,Goto K,Momata M,et al.Induction of RhoA gene expres⁃sion by interleukin-4 in cultured human bronchial smooth muscle cells[J].J Smooth Muscle Res,2010,46(4):217-224.
[2]范兴忠,李宏.肾病综合征患者血清IL-4和IL-10水平的变化及意义[J].免疫学杂志,2010,26(1):56-62.
[3]Shui X,Huang J,Li YH,et al.Construction and selection of human Fab antibody phage display library of liver cancer[J].Hybridoma, 2009,28(5):341-347.
[4]Dantas-Barbosa C,Brígido MM,Maranhão AQ.Construction of a human Fab phage display library from antibody repertoires of osteo⁃sarcoma patients[J].Genet Mol Res,2005,4(2):126-140.
[5]万佳艺,孙慧,焦永军,等.人源天然Fab噬茵体抗体库的构建及抗c.Met抗体的筛选、鉴定[J].南京医科大学学报(自然科学版), 2008,28(6):697-701.
[6]Shen Y,Yang X,Dong N,et al.Generation and selection of immu⁃nized Fab phage display library against human B cell lymphoma[J]. Cell Res,2007,17(7):650-660.
[7]潘博,童贻刚.噬菌体抗体库技术及其应用研究进展[J].生物技术通讯,2010,21(4):581-589.
[8]Rondot S,Koch J,Breitling F,et al.A helper phage to improve sin⁃gle-chain antibody presentation in phage display[J].Nat Biotech⁃nol,2001,19(1):75-78.
[9]Wind T,Stausbøl-Grøn B,Kjaer S,et al.Retrieval of phage dis⁃played scFv fragments using direct bacterial elution[J].J Immunol Methods,1997,209(1):75-83.
[10]Corisdeo S,Wang B.Functional expression and display of an anti⁃body Fab fragment in Escherichia coli:study of vector designs and culture conditions[J].Protein Expr Purif,2004,34(2):270-279.
