磷酸西格列汀治疗2型糖尿病40例临床观察
2011-03-09付鸿玉唐海燕金雪花
付鸿玉 唐海燕 金雪花
糖尿病目前已成为一种全球性疾病,并有进一步上升的趋势,其中2型糖尿病占90%~95%。大部分2型糖尿病患者日常主要的治疗方式是控制血糖,然而,即使通过现有多种口服药物治疗和控制,目前中国仍有超过70%的患者无法达到理想的血糖控制。传统治疗方案的不足之处包括增加体重、低血糖风险、胃肠不良反应及水肿、无法充分控制餐后高血糖等,临床应用中具有一定的局限性,而西格列汀通过抑制二肽基肽酶IV大幅提高活性肠促胰岛激素水平,促进胰腺β细胞合成,释放胰岛素,并减少胰腺α细胞分泌的胰高血糖素。西格列汀(DPP-IV抑制剂)有改善血糖控制、不增加患者体重,也不会使患者发生低血糖和水肿等优点。
1 资料与方法
1.1 资料 随机选择门诊和住院的2型糖尿病患者40例,糖尿病符合1999年WHO诊断标准。随机分为2组,治疗组20例,其中男13例,女7例,年龄(60±11)岁,糖尿病病程3~20年;对照组20例,其中男11例,女9例,年龄(62±9)岁,糖尿病病程2~25年。2组在年龄、性别、病情程度上差异无统计学意义(P>0.05),具有可比性。
1.2 方法 2组患者均进行糖尿病健康教育,糖尿病饮食和适量锻炼,均继续使用口服西药降糖;治疗组再加用磷酸西格列汀100mg,每日1次,观察期间根据餐后2小时、空腹血糖水平调整降糖药剂量,观察期3个月。
1.3 检测指标 检测2组在观察期间每2周的空腹血糖(FBG)、餐后2小时血糖(2-hPPG)、HbA1c、低血糖发生率、体重变化情况。
1.4 统计学处理 计量资料用均数±标准差表示,组间比较采用t检验,使用SPSS12.0统计学软件,P<0.05为统计有显著性差异。
2 结果
治疗组在血糖控制上优于对照组(P<0.05);在降低HbA1c方面优于对照组(P<0.05);治疗组在减少低血糖和体重增加的风险方面优于对照组(P<0.05)。见表1。
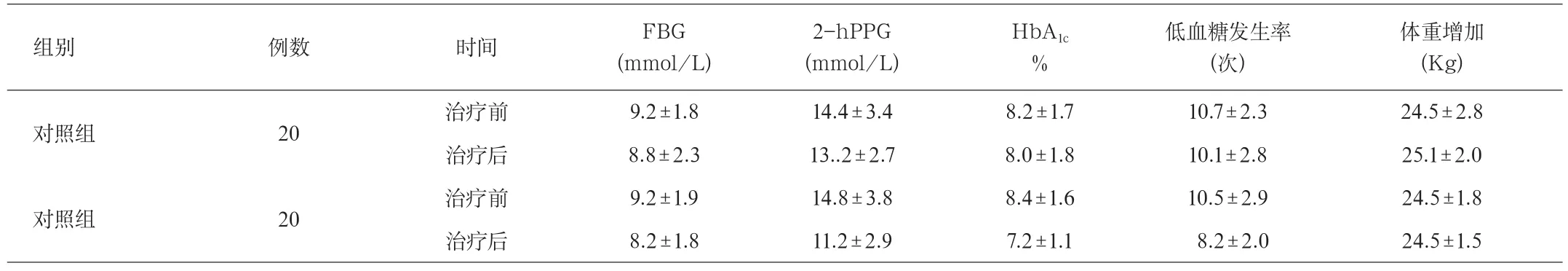
表1 2组治疗前后空腹血糖、餐后2小时血糖、HbA1c、低血糖发生率、体重变化情况比较(均数±标准差)
3 讨论
2型糖尿病存在多个关键缺陷[1-4]:(1)肌肉和脂肪组织内的葡萄糖摄取减少导致胰岛素抵抗。(2)进行性的β细胞功能障碍导致胰岛素缺乏。(3)β细胞释放胰岛素受损、α细胞释放过多胰高血糖素导致肝脏葡萄糖输出过多。磷酸西格列汀是一类被称为二肽基肽酶4(DPP-4)抑制剂的口服抗高血糖药物,在2型糖尿病患者中可通过增加活性肠促胰岛激素的水平而改善血糖控制。肠促胰岛激素包括胰高糖素样多肽-1(GLP-1)和葡萄糖依赖性促胰岛素分泌多肽(GIP),由肠道全天释放,并且在进餐后水平升高。肠促胰岛激素是参与葡萄糖内环境稳态生理学调控的内源性系统的一部分。当血糖浓度正常或升高时,GLP-1和GIP可通过涉及环磷腺苷的细胞内信号途径增加胰腺β细胞合成并释放胰岛素。在2型糖尿病动物模型中,GLP-1或DPP-4抑制剂治疗可以改善胰腺β细胞对葡萄糖的反应性并促进胰岛素的生物合成与释放[5-6]。随着胰岛素水平的升高,组织对葡萄糖的摄取作用增加。此外,GLP-1还可以抑制胰腺α细胞分泌胰高糖素。胰高糖素浓度的降低和胰岛素水平的升高可降低肝葡萄糖生成,从而降低血糖的水平。GLP-1或GIP的作用具有葡萄糖依赖性,当血糖浓度降低时,GLP-1不会促进胰岛素释放,也不会抑制胰高糖素分泌。当葡萄糖水平高于正常浓度时,GLP-1和GIP促进胰岛素释放的作用增强。此外,GLP-1不会损伤机体对低血糖的正常胰高糖素释放反应。GLP-1和GIP的活性受到DPP-4酶的限制,后者可以快速水解肠促胰岛激素,产生非活性产物。西格列汀能够防止DPP-4水解肠促胰岛激素,从而增加活性形式的GLP-1和GIP的血浆浓度。通过增加活性肠促胰岛激素水平,西格列汀能够以葡萄糖依赖的方式增加胰岛素释放并降低胰高糖素水平。对于存在高血糖症的2型糖尿病患者,胰岛素和胰高糖素水平发生的上述变化可降低糖化血红蛋白A1c(HbA1c)并降低空腹血糖和餐后血糖水平[7]。西格列汀的葡萄糖依赖性作用机制与磺酰脲类药物的作用机制不同,即使在葡萄糖水平较低时,磺酰脲类药物也可增加胰岛素分泌,从而在2型糖尿病患者和正常受试者人体中导致低血糖,而西格列汀促胰岛素分泌作用和胰高糖素抑制作用具有葡萄糖依赖性,因此不会降低血糖水平或导致低血糖。
综上所述,磷酸西格列汀通过提高活性肠促胰岛激素水平,以葡萄糖依赖的方式增加胰岛素水平,抑制胰高血糖素,显著改善β细胞功能和胰岛素敏感性,可显著降低空腹血糖并减少进食后血糖波动,显著降低HbA1c,减少低血糖和体重增加的风险,克服了传统口服药物的局限性,揭开了2型糖尿病治疗的新篇章。
[1]Buse JB,Polonsky KS,Burant CF.Type 2 diabetes mellitus.In:Kronenberg HM, Melmed S,Polonsky KS,et al.Williams Textbook of Endo crinology[M].11th ed.Philadelphia,PA:Saunders,2008:1329-1389.
[2]Powers AC.Diabetes mellitus.In:Fauci AS,Braunwald E,Kasper DL,et al,eds.Harrison’s Principles Of Internal Medicine[OL].17th ed.New York,NY:McGraw-Hill,008.http://www.accessmedicine.com/content.aspx?Aid=2891108.
[3]Del Prato S,Marchetti P.Beta-and alpha-cell dysfunction in type 2 diabetes[J].Horm Metab Res,2004,36:775-781.
[4]Muller WA,Faloona GR,Aguilar-Parada E,et al.Abnormal alpha-cell function in diabetes:response to carbohydrate and protein ingestion[J].N Engl J Med,1970,283:109-115.
[5]Aschner P,Kipnes MS,Lunceford JK,et al.Effect of the dipeptidyl peptidase-f inhibitor sitagliptin as monotherapy on glycemic control in patients woth type 2 diabetes[J].Diabetes Care,2006,29(12):2632-2637.
[6]Oneline apendex[OL].heep://care.diabetesjournals.org/content/29/12/2632/suppi/DC1.
[7]Mohan V,Yang W,Son HY,et al.Efficacy and safety of sitagliptin in the treatment of patients with type 2 diabetes in China,India,and korea[J].Diabetes Res Clin Pract,2009,83(1):106-116.