共刺激分子B7-H1和受体PD-1在溃疡性结肠炎患者结肠黏膜中的表达及意义
2011-03-09吕愈敏
于 伟,顾 芳,吕愈敏
北京大学第三医院消化科,北京 100191
溃疡性结肠炎(ulcerative colitis,UC)是一种病因尚不完全清楚的大肠慢性非特异性炎症性疾病。研究显示,肠道黏膜免疫系统在 UC发病中占有重要地位,尤其是肠黏膜 T细胞的免疫调节失衡可导致促炎介质的释放、促炎细胞的聚集和组织破坏。效应性 T细胞的活化不仅需要T细胞受体(TCR)介导的抗原特异性信号,还需要抗原呈递细胞(APCs)提供的共刺激信号。共刺激分子 B7-H1是近年来发现的 T细胞共刺激分子B7家族的成员,与T细胞表面相应的程序性死亡因子(progammed death1,PD-1)结合后,能下调T细胞的免疫反应,并促进活化 T细胞的凋亡[1]。目前对于共刺激分子B7-H1/PD-1在溃疡性结肠炎患者中的研究,国内外报道较少。本文通过对溃疡性结肠炎患者结肠黏膜中B7-H1和受体PD-1蛋白表达的研究,探讨二者在结肠黏膜炎症反应中的作用及意义。
1 材料与方法
1.1 研究对象及分组 选择 2009年 10月 ~2010年10月于北京大学第三医院确诊的的溃疡性结肠炎(ulcerative colitis,UC)患者45例,男34例,女11例,年龄21~69岁,平均(39.42±11.56)岁。45例患者中,溃疡性结肠炎活动期患者 30例,缓解期患者 15例。所有患者的诊断均符合《对我国炎症性肠病诊断治疗规范的共识意见》[2]中 UC的诊断标准。收集 10例健康志愿者的肠镜活检标本为正常对照组。根据 UC内镜下表现,将研究对象分为四组:UC活动期患者炎症最重部位(30例)、UC活动期患者炎症不明显部位(30例)、UC缓解期患者原炎症部位(15例)及正常对照组(10例)。本研究符合人体实验伦理学标准,已获得北京大学生物医学伦理委员会的批准。
1.2 实验方法 结肠镜观察,分别于溃疡性结肠炎活动期患者炎症最重部位黏膜及炎症不明显部位黏膜、UC缓解期患者原炎症部位黏膜各取活检 2块。并取正常对照组结肠黏膜 2块。所有标本采用免疫组织化学方法检测各标本中B7-H 1和PD-1的表达,以累计光密度值(IOD值)定量分析其表达含量。
标本处理:标本经4%多聚甲醛固定6 h,放于30%蔗糖溶液脱水至组织沉到底部,OCT包埋,放于液氮迅速冷冻,转入-80℃冰箱保存。切片使用Leica冰冻切片机,6μm切片,EnVision方法行免疫组化染色。一抗为小鼠抗人B7-H1单克隆抗体、小鼠抗人PD-1单克隆抗体(由中国科学院生物物理研究所感染与免疫中心王盛典教授惠赠),浓度均为 1∶200。
1.3 图像采集及分析 采用显微镜及图像采集系统(Nikon-ECLIPSE E600)采集高倍镜下图像,每次采集时参数调节处于手动状态,且保证各参数固定不变。高倍镜下,每个样本随机选取 10个视野进行图像采集。图像分析采用Image-ProPlus 6.0系统,测量指标为累积光密度值(integrated optical density,IOD)。
1.4 结果判定 采用Image-ProPlus6.0系统,测量各图像免疫组化阳性细胞的 IOD值,每个样本以 10幅图像的IOD平均值为最终测量值。比较UC活动期患者炎症最重部位、UC活动期患者炎症不明显部位、UC缓解期患者原炎症部位及正常对照组的IOD测量值。
1.5 统计学处理 应用SPSS 13.0软件进行统计。对统计资料进行正态性检验和方差齐性检验,多个均数比较方差齐时采用单因素方差分析,各组均数任意两组间的比较采用LSD法,方差不齐时采用Dunnett T3法分析。所有实验数据以±s表示,P<0.05为差异有统计学意义。
2 结果
2.1 B7-H1在结肠黏膜的表达 B7-H1阳性细胞主要在肠黏膜固有层单个核细胞表达,UC活动期患者炎症最重部位及炎症不明显部位、UC缓解期患者原炎症部位IOD均明显高于正常对照组。B7-H1表达强度最高的为UC活动期患者炎症最重部位,其后依次为UC活动期患者炎症不明显部位和UC缓解期患者原炎症部位,各组间比较差异均有统计学意义(P<0.05,见表1、图1)。
2.2 PD-1在结肠黏膜的表达 PD-1阳性细胞主要在肠黏膜固有层单个核细胞表达,UC活动期患者炎症最重部位及炎症不明显部位、UC缓解期患者原炎症部位累积光密度值(IOD)均明显高于正常对照组。PD-1表达强度最高的为 UC活动期患者炎症不明显部位,其后依次为UC活动期患者炎症最重部位和UC缓解期患者原炎症部位,各组间比较差异均有统计学意义(P<0.05,见表1、图2)。
3 讨论
表1 B 7-H 1、PD-1在不同实验组结肠黏膜中的表达(±s)Tab 1 Expression o f B 7-H 1 and PD-1 in colonic mucosa o f different groups(±s)
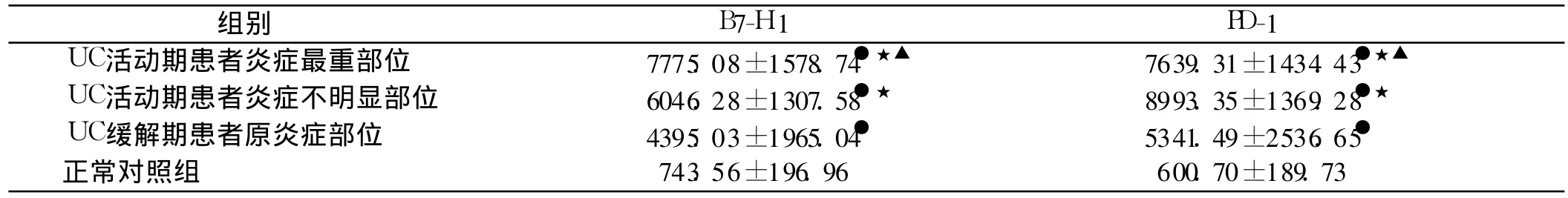
表1 B 7-H 1、PD-1在不同实验组结肠黏膜中的表达(±s)Tab 1 Expression o f B 7-H 1 and PD-1 in colonic mucosa o f different groups(±s)
与正常对照组相比,●P<0.05;与UC缓解期患者原炎症部位相比,★P<0.05;与UC活动期患者炎症不明显部位相比,▲P<0.05
组别 B7-H 1 PD-1 UC活动期患者炎症最重部位 7775.08±1578.74●★▲ 7639.31±1434.43●★▲UC活动期患者炎症不明显部位 6046.28±1307.58●★ 8993.35±1369.28●★UC缓解期患者原炎症部位 4395.03±1965.04● 5341.49±2536.65●正常对照组 743.56±196.96 600.70±189.73
共刺激分子B7家族的B7-H1(也称作PD-L1)低水平表达于静止 T、B细胞、骨髓细胞和树突细胞,也表达于肺、心和胎盘等器官中。当 T细胞、B细胞、骨髓细胞和树突细胞活化时,B7-H1可迅速上调[3,4]。研究已证实PD-1(programmed death-1)是B7-H1的确定受体,它是CD28和CTLA4的同源类似物,属于免疫球蛋白超家族成员。PD-1由活化的T细胞、B细胞和单核细胞诱导后生成[5]。Reynoso等研究发现B7-H1/PD-1信号可能在限制 CD8+T细胞的扩增中起主要作用[6]。另外,通过B7-H1抗体阻断或者用B7-H1或PD-1缺陷型小鼠,能使自身免疫性心肌炎、肾炎恶化,干扰移植物的生存等[7-9]。由此证实 B7-H 1和 PD-1结合后,可参与外周免疫耐受,防止自身免疫反应的发生。
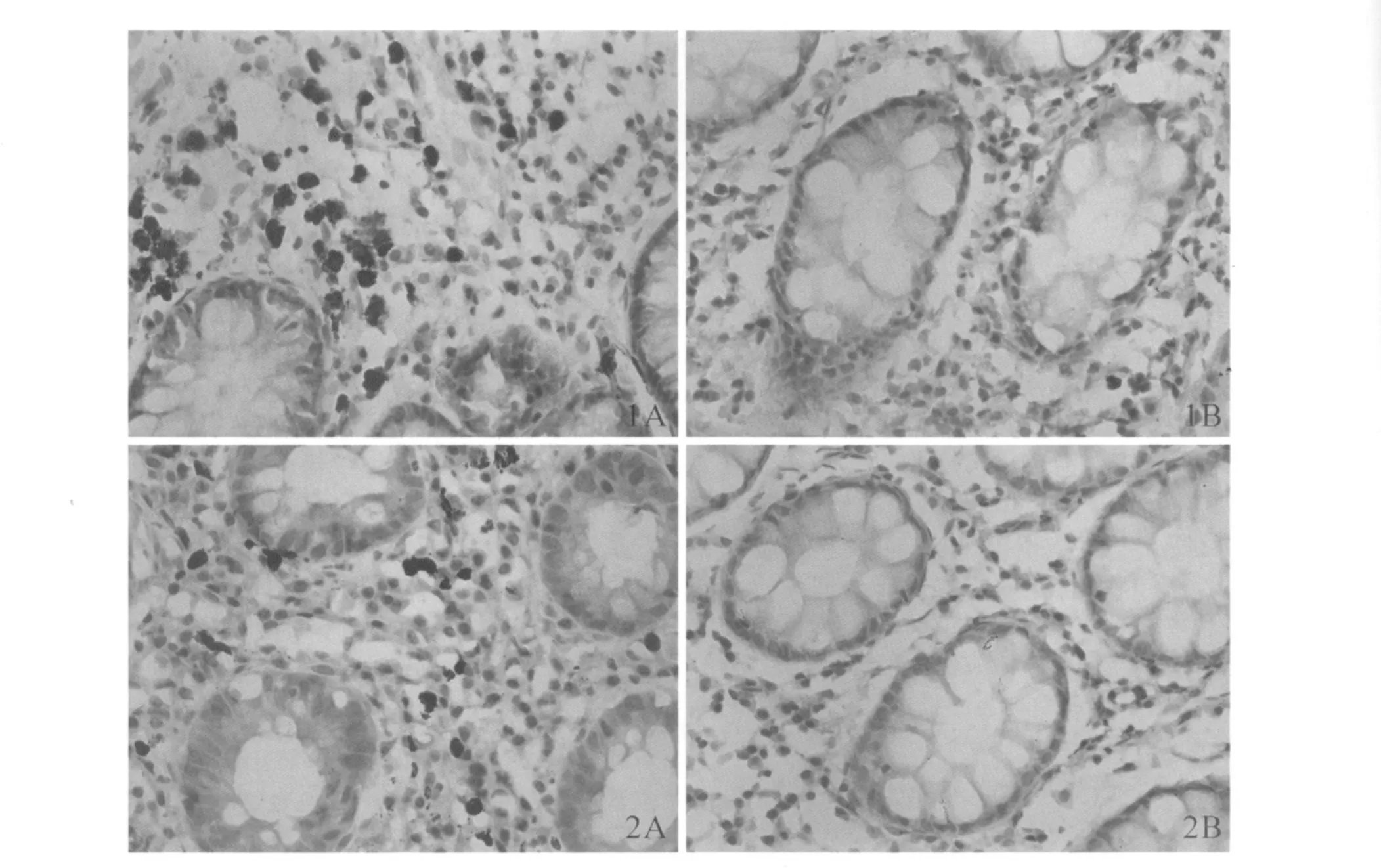
图1 B 7-H 1在不同实验组结肠黏膜的表达(400×);图2 PD-1在不同实验组结肠黏膜的表达(400×) A:UC活动期患者炎症最重部位;B:正常对照组Fig 1 Expression of B 7-H 1 in colonicmucosa of different groups(400×);Fig 2 Expression of PD-1 in colonic mucosa of different groups(400×) A:mucosa with severe inflammation of patientswith UC in active stage;B:normal colonic mucosa
本研究结果显示,UC活动期患者炎症最重部位及炎症不明显部位、UC缓解期患者原炎症部位结肠黏膜的固有层单个核细胞B7-H 1和PD-1的表达水平均明显高于正常对照,提示B7-H1及受体PD-1可能参与了UC患者肠道炎症的发生,这与Kanai等的研究一致[10]。同时,本研究中 UC缓解期病人尽管已达到临床缓解及结肠镜下黏膜愈合,病理组织学未提示活动炎症,但B7-H1和PD-1的水平均高于正常对照组,提示UC缓解期病人的肠道免疫系统仍然处于失衡状态。我们发现随着镜下炎症程度的加重,B7-H1表达随之升高,但 PD-1变化趋势并非与其完全一致,不同之处表现在UC活动期患者炎症最重部位PD-1的表达含量低于炎症不明显部位,推测部分原因可能与B7-H1/PD-1通路对机体免疫反应的负性调节有关,随着PD-1表达的增强,其下调免疫炎症反应的作用会增强,更有利于炎症的好转。这一结果也提示 B7-H1除了与PD-1直接结合发挥作用以外,可能存在其他途径参与炎症发生。Nakazawa等[11]利用炎症性肠病(IBD)病人手术切除标本,分离提取结肠上皮细胞,通过流式细胞仪检测发现 UC病人结肠上皮细胞表达B7-H1明显高于健康对照者。本试验中,未在上皮细胞中发现 B7-H1表达,推测可能与实验方法不同有关,需要进一步研究。
B7-H1的具体作用机制尚不十分清楚,目前已经明确的是B7-H1可以通过与受体 PD-1的相互作用,对机体免疫进行负向调节,参与诱导和维持外周组织的免疫耐受,导致外周自身反应性 T细胞的凋亡,对防止组织的炎性过度反应及自身免疫性疾病的发生具有积极作用。但有研究证实PD-1并非B7-H1的唯一受体,有未知的受体早期可与B7-H1结合,导致早期T细胞增殖和细胞因子产生。而PD-1则稍晚与B7-H1结合,导致细胞因子减少和 T细胞凋亡[12]。因此,B7-H1可以在不同阶段与不同受体结合,发挥刺激初始 T细胞活化和抑制效应 T细胞的双重作用,在炎症的不同阶段起重要作用,其具体机制错综复杂,国内外研究仍存在多种争论,有待进一步深入探讨。
[1]Dong H,Zhu G,Tamada K,et al.B7-H1,a third member of the B7 family,co-stimulates T-cell proliferation and interleukin-10 secretion[J]. Nat Med,1999,5(12):1365-1369.
[2]中华医学会消化病学分会炎症性肠病协作组.对我国炎症性肠病诊断治疗规范的共识意见[J].中华消化杂志,2007,27(8):545-550.
[3]Liang SC,Latchman YE,Buhlmann JE,et al.Regulation of PD-1, PD-L1,and PD-L2 expression during normal and autoimmune responses[J].Eur J Immunol,2003,33(10):2706-2716.
[4]Rodig N,Ryan T,A llen JA,et al.Endothelial expression of PD-L1 and PD-L2 down-regulates CD8+T cell activation and cytolysis[J]. Eur JImmunol,2003,33(11):3117-3126.
[5]Agata Y,Kawasaki A,Nishimura H,et al.Expression of the PD-1 antigen on the surface of stimulated mouse T and B lymphocytes[J].Int Immunol,1996,8(5):765-772.
[6]Reynoso ED,Elpek KG,Francisco L,et al.Intestinal tolerance is converted to autoimmune enteritis upon PD-1 ligand blockade[J].J Immunol,2009,182(4):2102-2112.
[7]Grabie N,Gotsman I,DaCosta R,et al.Endothelial programmed death-1 ligand 1(PD-L1)regulates CD 8+Tcellmediated injury in the heart[J].Circulation,2007,116(18):2062-2071.
[8]Menke J,Lucas JA,Zeller GC,et al.Programmed death 1 ligand (PD-L)1 and PD-L2 lim it autoimmune kidney disease:distinct roles[J].J Immunol,2007,179(11):7466-7477.
[9]Koehn BH,Ford ML,Ferrer IR,et al.PD-1-dependentmechanisms maintain peripheral tolerance of donor-reactive CD 8+T cells to transplanted tissue[J].J Immunol,2008,181(8):5313-5322.
[10]Kanai T,Totsuka T,Uraushihara K,et al.Blockade of B7-H 1 suppresses the developmentof chronic intestinal Inflammation[J].JImmunol,2003,171(8):4156-4163.
[11]Nakazawa A,Dotan I,Brimnes J,et al.The Expression and function of costimulatorymolecules B7h and B 7-H1 on colonic epithelial cells[J]. Gastroenterology,2004,126(5):1347-1357.
[12]Tamura H,Ogata K,Dong H,et al.Imuunology of B 7-H 1 and its roles in human disease[J].Int JHematol,2003,78(4):321-328.
