雌激素对结肠细胞错配修复活性的影响
2011-03-09牟韶娇盛剑秋陆晓娟
牟韶娇,盛剑秋,谢 惠,金 鹏,陆晓娟,高 巍
1.北京军区总医院消化内科,北京 100700;2.山西医科大学
流行病学研究表明,雌激素替代治疗能明显降低大肠癌发病率[1-3]。但雌激素对大肠癌预防作用的具体机制仍不明确。DNA错配修复(mismatch repair, MMR)系统在维持基因组稳定性中起关键作用,其主要功能为修复DNA复制过程中出现的错配和插入-缺失环(insertion-deletion loops,IDLs)。我们在前期工作中发现,雌激素对结肠细胞 MMR系统的影响可能是其预防大肠癌的机制之一,并观察到雌激素能上调结肠细胞 MMR基因表达[4]。本研究将构建细胞MMR活性检测平台,进一步探索雌激素对结肠细胞MMR活性的影响。
1 材料与方法
1.1 pEGFP-N 1质粒的改造
1.1.1 使用dam-感受态ER2925(美国NEB公司)去甲基化处理pEGFP-N1质粒(由国家人类基因组北方研究中心诺赛基因公司惠赠,序列详见:https://www. lablife.org/ct?a=viewvecseq&vectorid=350)。用限制性内切酶StuⅠ和SexAⅠ(美国NEB公司)双酶切pEGFPN1,去除包括SV40复制起点上下游的DNA片段(230 bp),琼脂糖凝胶电泳回收并纯化酶切后所得的大片段(约4.5 kb,柱离心型DNA凝胶回收与纯化试剂盒,北京威格拉斯生物技术有限公司,Lot#101BC,按试剂盒说明书进行),Klenow酶(美国NEB公司)补平大片段,T4连接酶(西班牙Fermentas公司)环化。转入dam+感受态DH5α(由国家人类基因组北方研究中心诺赛基因公司惠赠),纯化(柱离心型高纯质粒小量提取试剂盒,北京威格拉斯生物技术有限公司,Lot#102AE,按试剂盒说明书进行)后测序和酶切验证。
1.1.2 利用PCR定点诱变(PCR-based site-directed mutagenesis)技术,在质粒上EGFP基因的起始密码子ATG的上下游插入限制性内切酶EcoRⅤ和NruⅠ的酶切位点。引物序列:5′-ggtggcgaccgggatatcccgggccc-3′,5′-atggtgagcaatcgcgaggagctgttc-3′(下划线部分分别为EcoRⅤ和NruⅠ的酶切位点,引物由北京奥科生物技术公司合成)。PCR反应条件(50μL体系):引物各20 pmol、质粒模板59 ng、dNTPs 50 nmol、Pfu酶2.5 U、1×Pfu buffer。94℃30 s,72℃13 min,共20个循环。纯化PCR产物(DNA纯化与回收试剂盒,北京威格拉斯生物技术有限公司,Lot#101BD,按试剂盒说明书进行),T4连接酶环化。DpnⅠ酶(美国NEB公司)去除原始模板。转入感受态ER2925,纯化(柱离心型高纯质粒小量提取试剂盒),酶切和测序检验所得质粒。将新质粒命名为p95-1。
1.2 异源/同源双链质粒的构建
1.2.1 用限制性内切酶ApaⅠ和NruⅠ(美国NEB公司)双酶切P95-1质粒,琼脂糖凝胶电泳回收并纯化酶切后所得的大片段(约4.5 kb,柱离心型DNA凝胶回收与纯化试剂盒)。
1.2.2 构建与ApaⅠ/NruⅠ切下的小片段DNA序列相同,但在原EGFP基因起始密码子ATG处含T-G错配且无EcoRⅤ酶切位点的异源双链和不含错配且无EcoRⅤ酶切位点的同源双链。寡核苷酸单链序列: EGFP-11:5′-cgggatccaccggtcgccaccatggtgagcaatcg-3′,EGFP-12:5′-cgattgctcaccgtggtggcgaccggtggatcccgggcc-3′,EGFP-13:5′-cgattgctcaccatggtggcgaccggtggatcccgggcc-3′(下划线部分为原EGFP基因起始密码子位点,寡核苷酸单链由北京奥科生物技术公司合成)。其中EGFP-11与EGFP-12形成T-G错配(异源双链),为观察组;EGFP-11与EGFP-13不形成错配(同源双链),为对照组。退火反应条件(20μL体系):寡核苷酸单链各 20 pmol、1×T4 ligase Buffer、T4PNK(美国NEB公司)4 u。置于 37℃水浴锅中放置30min,再将此体系自100℃缓慢降至 4℃,即可得到所需双链。
1.2.3 用T4连接酶将异源/同源双链与ApaⅠ/NruⅠ酶切所得大片段连接,构建异源/同源双链质粒。连接反应条件:异源/同源双链2μL、P95-1经酶切后所得大片段30μL(EB溶解)、10×T4 ligase Buffer 5μL、T4 ligase 400 u加水补齐至50μL,16℃过夜。以EcoRⅤ酶(美国NEB公司)和PSAD酶(质粒稳定DNA酶,北京中北林格科技发展有限公司)去除原有的野生型质粒,纯化(DNA纯化与回收试剂盒,北京威格拉斯生物技术有限公司)。酶切鉴定所得质粒。
1.3 细胞转染及雌激素对细胞错配修复活性的影响去酚红培养基L-15(美国Hyclone公司)血清剥离培养(0.1%的活性炭滤过的胎牛血清+胸腺嘧啶2mmol/ L)结肠癌细胞株SW480(由国家人类基因组北方研究中心诺赛基因公司惠赠)24 h后,分别用等量的上述异源或同源双链质粒转染细胞。转染条件:96孔板培养细胞,100万细胞/每孔;每孔加入 200 ng质粒及 0.64 μL高效真核转染试剂(北京威格拉斯生物技术有限公司)。共转染:将红色荧光质粒pDsRed-N1与异源或同源双链质粒按1∶1比例共转染SW480细胞,转入DsRed的目的是为了评估转染效率。转染完成后孵育 24 h,更换血清剥离培养基,加入不同浓度的雌二醇(estrodiol, E2,美国sigma公司,0、10-10、10-8mol/L),孵育24 h,然后在流式细胞仪下观察绿色荧光细胞的数量和荧光强度。以EGFP相对表达值代表细胞MMR活性。EGFP表达值=(LR%gated+UR%gated)/(UL%gated+ UR%gated)。EGFP相对表达值=异源双链EGFP表达值/同源双链EGFP表达值。
2 结果
SW 480细胞为错配修复系统正常的结肠癌细胞株,转入异源双链质粒后,EGFP基因起始密码子上构建的错配可有部分被修复,修复成功后即表达正常的EGFP,可诱发绿色荧光。用异源或同源双链质粒与DsRed质粒共转染SW 480细胞,转染后荧光显微镜下大体观察转染效果,可见异源/同源双链质粒(绿色荧光)与DsRed质粒(红色荧光)均转染成功,异源双链荧光细胞数少于同源双链。加入不同浓度的 E2后,流式细胞仪检测绿色荧光强度和细胞数,得到异源/同源双链质粒EGFP表达值和EGFP相对表达值如表1所示。可见E2能增加SW480细胞的EGFP相对表达值,且呈剂量依赖关系,提示 E2能上调SW480细胞的MMR活性。
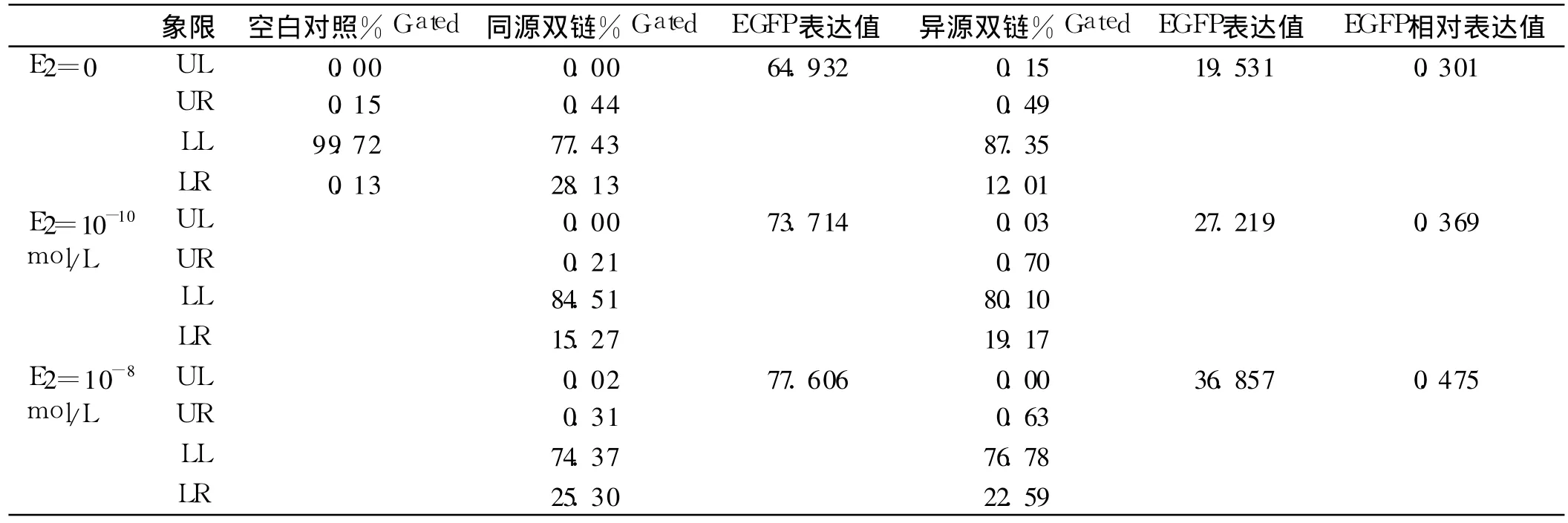
表1 流式细胞仪测定SW 480细胞株EGFP相对表达值Tab 1 The relative exp ression of EGFP in SW 480 cellsw ith Flow cy tometry
3 讨论
近年大量临床研究已证实,女性绝经后雌激素替代治疗能明显降低 CRC发病率[5,6]。这些证据表明雌激素对 CRC可能有预防作用[7],但是迄今这一作用具体机制仍不明确。DNA错配修复系统在维持基因组稳定性中起关键作用。大部分的遗传性结直肠癌由MMR基因种系突变引起,即遗传性非息肉病性结直肠癌(hereditary nonpolyposis colorectal cancer,HNPCC)。另外有10%~15%的散发性结直肠癌是由错配修复基因hMLH1表遗传学失活所致。MMR功能障碍导致的结直肠癌表现为微卫星不稳定性(microsatellite instability,MSI)。既往研究表明,在HNPCC家族中,男性突变携带者患结直肠癌的风险高于女性突变携带者[8];对中国人HNPCC家系的研究也发现了类似情况[9]:HNPCC家系中女性成员发病率低于男性成员,甚至在某些HNPCC家系中,达到平均发病年龄的男性均发生大肠癌,但携带突变基因的女性成员迄今为止无1例发病。这种HNPCC发病率上的性别差异可能与雌激素有关[10]。而Slattery等[11]的研究发现,年轻女性MSI阳性结肠癌的发生率低于年老女性,而绝经后雌激素替代治疗能降低MSI阳性结肠癌风险,因此认为雌激素可以预防MMR功能缺陷引起的结直肠癌。在本研究中,我们建立了一种能检测体外活细胞MMR功能的体系,并观察了雌激素对结肠细胞MMR功能的影响。
该方法在质粒pEGFP-N1的增强型绿色荧光蛋白(EGFP)基因起始密码子上引入错配,用含错配EGFP的质粒转染细胞,只有修复该错配才能产生有功能的EGFP,因此可以用绿色荧光强度代表细胞MMR活性。既往检测细胞MMR功能的方法多使用细胞裂解后提取的蛋白(含错配修复蛋白),比较费时费力,且不能测定活细胞MMR功能的实时变化。本方法能实时定量检测活细胞 MMR功能的变化,适合于判断雌激素对结肠细胞 MMR功能的影响。方法学上,为了确保观察组和对照组细胞含EGFP基因的量基本相同,即EGFP质粒转染细胞后不再大量复制扩增,我们去除了pEGFP-N1质粒含SV40启动子的片段。同时为了去除原有的野生型质粒,确保转染细胞的质粒为新合成的异源/同源双链质粒,我们在 PCR定点诱变时加入了限制性酶切位点EcoRⅤ,且在合成寡核苷酸单链时未包含 EcoRⅤ酶切位点。转入异源双链质粒后, SW 480细胞的错配修复系统即可修复一部分转入的含错配启动子的EGFP基因,修复成功后即表达正常的EGFP,可诱发绿色荧光;共转的DsRed质粒作为内参,反映转染效率;而转入同源双链质粒的细胞,理论上诱发的荧光强度不受错配修复系统影响,可作为对照得到EGFP相对表达值。
面对我国日益增加的大肠癌发病率和死亡率,本研究为雌激素类似物预防大肠癌的应用提供了一定的理论基础。
[1]Chlebowski RT,Wactawski-Wende J,Ritenbaugh C,et al.Estrogen plus progestin and colorectal cancer in postmenopausal women[J].N Engl JMed,2004,350(10):991-1004.
[2]Toft D,Gorski J.A receptormolecule for estrgens:isolation from the rat uterus and prelim inary characterization[J].Proc Natl Acad Sci U SA,1966,55(6):1574-1581.
[3]Greene GL,Gilna P,Waterfield M,et al.Sequence and expression of human estrogen receptor complementary DNA[J].Science,1986, 231(4742):1150-1154.
[4]Jin P,Lu XJ,Sheng JQ,et al.Estrogen stimulates the expression of mismatch repair gene hMLH 1 in colonic epithelial cells[J].Cancer Prev Res,2010,3(8):910-916.
[5]Chlebowski RT,Wactawski-Wende J,Ritenbaugh C,et al.Estrogen plus Progestin and colorectal cancer in postmenopausalwomen[J].N Engl JMed,2004,350(10):991-1004.
[6]Rossouw JE,Anderson GL,Prentice RL,et al.Risks and benefits of estrogen plus progestin in healthy postmenopausalwomen:principal results from the Women's Health Initiative random ized controlled trial[J].JAMA,2002,288(3):321-333.
[7]Kennelly R,Kavanagh DO,Hogan AM,et al.Oestrogen and the colon:potential mechanisms for cancer prevention[J].Lancet Oncol, 2008,9(4):385-391.
[8]Froggatt NJ,Green J,Brassett C,etal.A common MSH 2mutation in English and North American HNPCC families:origin,phenotypic expression,and sex specific differences in colorectal cancer[J].JMed Genet,1999,36(2):97-102.
[9]Sheng JQ,Fu L,Sun ZQ,et al.Mismatch repair genemutations in Chinese HNPCC patients[J].Cytogenet Genome Res,2008,122 (1):22-27.
[10]Ferreira AM,Westers H,Albergaria A,et al.Estrogens,MSI and Lynch syndrome-associated tumors[J].Biochim Biophys Acta, 2009,1796(2):194-200.
[11]Slattery ML,Potter JD,Curtin K,et al.Estrogens reduce and withdrawal of estrogens increase risk of microsatellite instability-positive colon cancer[J].Cancer Res,2001,61(1):126-130.
