Barrett食管黏膜中Ghrelin表达
2011-03-09于群德曲海霞卫红军
于群德,曲海霞,卫红军,王 青
青岛大学医学院附属青岛市市立医院1.消化科(东院);2.病理科(东院),山东青岛 266071
Barrett食管是指食管下段鳞状上皮被柱状上皮取代,无论是否有肠化生的存在[1]。相比于正常的食管上皮,Barrett食管黏膜特别是特殊肠化生黏膜发生腺癌的几率增加[2]。本文对Barrett食管黏膜中Ghrelin的表达、胆汁反流及H.pylori感染的关系做初步探讨,为Barrett食管的治疗及预防提供线索。
1 材料与方法
1.1 病例资料 选取于我院2008年8月~2010年8月就诊的 2 530例胃食管反流病患者。临床症状为胃食管反流表现,如反酸、烧心、胸骨后疼痛等。排除食管糜烂、上消化道狭窄和肿瘤、消化性溃疡、肝、胆、胰等其他消化系统疾患、腹部手术史、严重心肺疾病、糖尿病、神经系统疾病,经胃镜及组织病理确诊为Barrett食管 66例,男 38例,女 28例,作为研究组,年龄 25~76岁,平均(55.14±15.07)岁。
BE诊断依据 2006年 10月三亚《中国胃食管反流病共识意见》[3]:内镜检查发现食管远端有明显的柱状上皮化生并得到病理学检查证实,即可诊断为BE。
依据病理组织学分为贲门腺型组、胃底腺型组及特殊肠化生型组。
对照组为 30例,男 20例,女 10例,年龄 27~65岁,平均(51.20±11.27)岁。对照组入选标准:胃镜检查食管部正常,齿状线清晰,无反酸、烧心、胸痛等胃食管反流病症状,无腹部手术史、无消化系统慢性病史、无糖尿病和肝、胆、胰疾患及无肿瘤病史。
1.2 标本采集 常规内镜准备,患者均在清醒状态下由经验丰富的内镜医师操作。首先明确鳞、柱状上皮交界(SCJ)及食管胃结合处(GEJ)的内镜检查标志。SCJ为食管鳞状上皮表现为淡粉色,光滑;胃柱状上皮为橘红色,鳞柱状上皮交界构成齿状线。GEJ是食管与胃的交界,其内镜下定位的标志为食管下段纵行栅栏样血管末梢或最小充气状态下胃黏膜皱襞的近侧缘。内镜下典型的BE表现是GEJ近端出现橘红色柱状上皮,即SCJ与GEJ分离。取材部位在SCJ远端与GEJ之间沿病变的整个长轴四象限每隔2 cm活检取材共4块。对照组在SCJ远端的食管内四象限活检,共取 4块。所有病例均同时在距幽门胃窦小弯部和大弯部取材。标本经 10%甲醛固定,行食管、胃黏膜垂直包埋、连续切片,分别用于HE染色、AB-PAS染色、改良Giemsa染色及免疫组化检查。
所有受试者在入组前均符合试验伦理学标准并得到伦理委员会的批准,受试对象签署知情同意书。
1.3 胆汁反流的判定及幽门螺杆菌测定 内镜下黏液池黄染,且胃镜停留幽门口1 min仍有胆汁反流者诊断为胆汁反流。快速尿素酶试验阳性及胃窦大弯和小弯经改良Giemsa染色镜检找到H.pylori者,确诊H.pylori感染。
1.4 免疫组织化学染色 组织切片经脱蜡水化,抗原修复,血清封闭,滴加一抗(一抗浓度为2μg/L),4℃恒温过夜,滴加二抗,DAB显色,苏木精复染,盐酸酒精分化、脱水、透明、封片、镜检。Ghrelin阳性染色主要位于化生的腺体内及部分鳞状上皮内(见图 1、图2),为棕黄色颗粒沉积,免疫组织化学结果定量判断:染色后先在光镜下做定性观察,然后于高倍镜下(400 ×)观察食管黏膜Ghrelin阳性表达,随机选取互不重叠的5个视野,用VIDAS计算机图像分析系统测定每个视野阳性染色的积分光密度(积分光密度=染色强度×染色面积),取其平均值作为该切片食管黏膜Ghrelin表达的半定量指标。
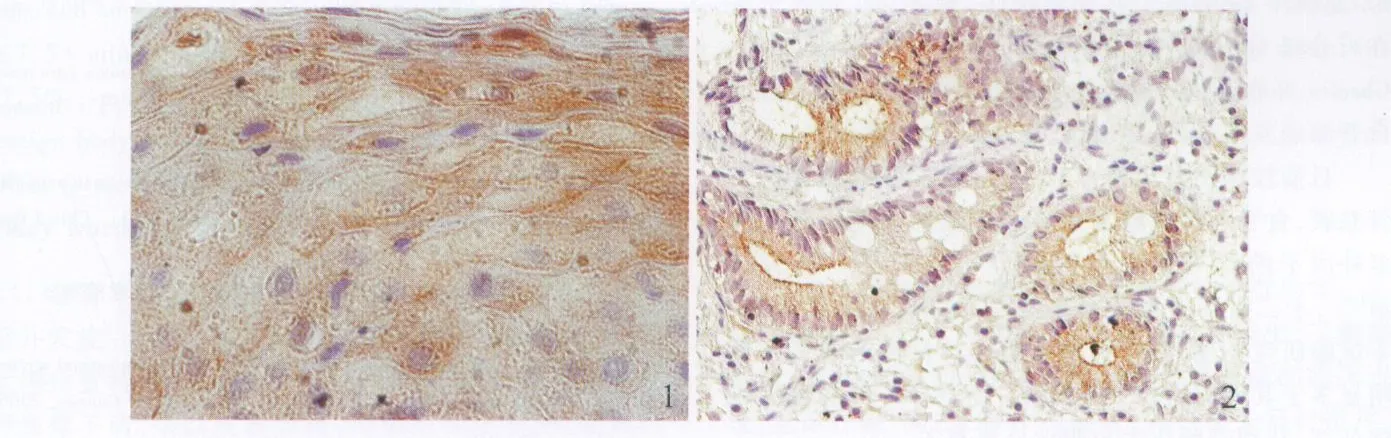
图1 正常食管黏膜中Ghrelin的表达(400×);图2 BE食管黏膜中Ghrelin的表达(400×)Fig 1 Exp ression of Ghrelin in contro lgroup(400×);Fig 2 Exp ression o f Ghrelin in BE group(400×)
1.5 统计学处理 应用SPSS 11.7软件,对所得计数资料阳性率的比较采用 χ2检验。计量资料数据均以均数±标准差(±s)表示,多组资料间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 不同病理组织学黏膜中Ghrelin表达及胆汁反流的比较 Ghrelin在特殊肠化生组黏膜表达高于对照组、贲门腺型组及胃底腺型组,Ghrelin在胃底腺型组黏膜表达高于对照组及贲门腺型组,Ghrelin在贲门腺型组黏膜表达高于对照组(F=22.64,P<0.05,见表1);不同化生BE胆汁反流患者比例特殊肠化生组高于其他两组,差异有统计学意义(χ2=12.61,P<0.05,见表1)。
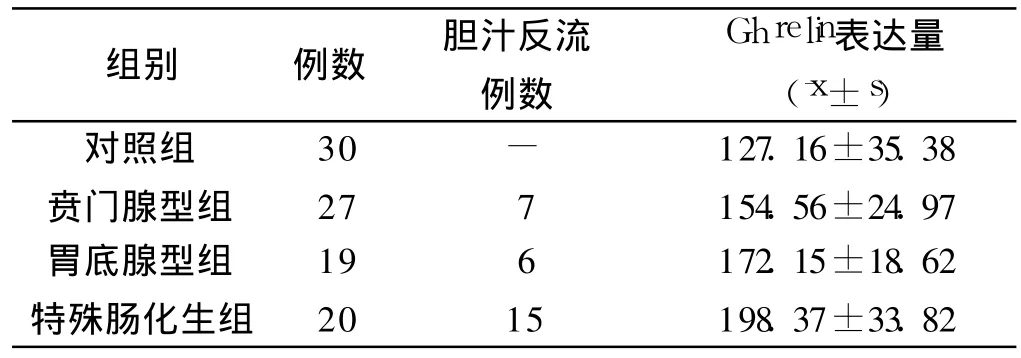
表1 食管黏膜病变中Ghrelin的表达及胆汁反流例数Tab 1 The exp ression of Ghrelin in esophagea lmucosa and the number of bile reflux in different groups
2.2 BE组与对照组黏膜Ghrelin表达量比较 对照组30例、BE组66例Ghrelin表达量分别为127.16± 35.38和 175.28±33.62,差异有统计学意义(t= 5.76,P<0.05)。
2.3 BE与H.pylori感染关系的比较 BE组H.pylori阳性感染 15例,对照组阳性感染 16例,BE组的H.pylori感染率低于对照组,差异有统计学意义(χ2= 8.84,P<0.05)。
3 讨论
东西方BE患病率差异较大,在美国的胃食管反流病患者中患病率为 13.3%[4]。本研究发现我院就诊的胃食管反流病患者中BE的检出率为2.6%,低于美国的患病率,分析原因可能与不同地域的生活及饮食习惯有关。田阳等研究认为 BE多发于男性、年长患者[5]。
Ghrelin的生物学作用十分广泛,可调节多种激素释放、促进摄食、调节血流动力、促进胃动力和胃酸分泌[6]。研究表明:Ghrelin能够在多种恶性肿瘤中表达,且与肿瘤细胞的增生及侵袭关系密切。目前关于Ghrelin在食管腺癌中的表达及其对食管腺癌发生的作用机制研究较少,BE作为一种公认的癌前病变,从化生到癌变经历肠化生—低度异型增生—高度异型增生—原位癌—浸润性腺癌的序贯过程。BE患者的食管黏膜Ghrelin的表达较对照组明显增加(P<0.05), BE黏膜中Ghrelin阳性细胞增多,推测BE黏膜中存在可分泌Ghrelin的细胞增多,使Ghrelin分泌增加, Ghrelin可能通过其促进细胞增殖,诱导Barrett食管向食管腺癌发展,但具体机制有待进一步研究。
目前较多学者认为胃十二指肠内容物反流刺激食管黏膜,食管下段黏膜复层鳞状上皮的多能干细胞在多种因子的诱导下发生细胞分化异常[10]。研究显示[11],十二指肠胃反流可能是引起 BE的独立因素。本试验研究发现,特殊肠化生组胆汁反流的患者比例明显多于其他两组(P<0.05)。提示BE的病理组织学分型,特别是肠化生与胆汁反流有关。
有关H.pylori感染与BE的关系尚存在争议。H. pylori感染对食管的保护机制之一与H.pylori感染引起胃内酸度的改变有关。Rugge等[12]观察到在伴有高H.pylori感染率的萎缩性胃炎患者中,GERD的发病率较H.pylori阴性者显著降低,在对胃酸过低的患者根除H.pylori后,胃酸分泌可以达到或接近正常水平。H.pylori感染引起胃内酸度改变的另一个机制则是H.pylori可以产生尿素酶,尿素酶分解尿素产生氨,氨能够对胃酸进行中和,提高胃内 pH值并减轻反流的胃内容物对食管的腐蚀,从而保护食管黏膜[13]。本研究发现BE患者幽门螺杆菌的感染率低于对照组(P<0.05),进一步证实H.pylori感染可能对食管有保护作用。
综上所述,随着Barrett食管黏膜损伤程度的加重,不同类型的食管黏膜上皮化生,从贲门型黏膜到特殊肠化生型黏膜中Ghrelin的表达逐渐增高;胆汁反流在BE黏膜组织肠化生过程中起重要作用;H.pylori感染可能对食管有保护作用。
[1]Jankowski JA,Harrison RF,Perry I,et al.Barrett'smetaplasia[J]. Lancet,2000,356(9247):2079-2085.
[2]Lagergren J.Adenocarcinomaofoesophagus:what exactly is the size of the problem and who is atrisk[J]?Gut,2005,54(1):i1-i5.
[3]The expertgroup of GRED China.Expert consensus of GRED in China (2006◦10 San Ya)[J].Chin J Intern Med,2007,46(2): 170-173.
中国胃食管反流病共识意见专家组.中国胃食管反流病共识意见(2006◦10三亚)[J].中华内科杂志,2007,46(2):170-173.
[4]Westhoff B,Brotze S,Weston A,et al.The frequency of Barrett's esophagus in high-risk patientswith chronic GERD[J].Gastrointest Endosc,2005,61(2):226-231.
[5]Tian Y,Li YQ.The relationship of pathology and c linical,endoscopic characteristics in Barrett's esophagus[J].Chin JGastrointerol Hepatol,2009,18(8):728-731.
田洋,李延青.Barrett食管临床及内镜特点与病理关系分析[J].胃肠病学和肝病学杂志,2009,18(8):728-731.
[6]Duxbury MS,Waseem T,Ito H.et al.Ghrelin promotes pancreatic adenocarcinoma cellular proliferation and invasiveness[J].Biochem Biophys Res Commun,2003,309(2):464-468.
[7]Yan XY,Wang BM,Liu WT.Expression of gastrointestinal hormones in esophagealmucosa of patients Barrett'sesophagus[J].Chin JDig, 2002,22(8):3.
阎雪燕,王邦茂,刘文天.Barrett食管黏膜胃肠激素的表达[J].中华消化杂志,2002,22(8):3.
[8]Ekeblad S,Nilsson B,Lejonklou MH,et al.Gastrointestinal stromal tumors express the orexigen ghrelin[J].Endocr Relat Cancer,2006, 13(3):963-970.
[9]Duxbury MS,Waseem T,Ito H,et al.Ghrelin promotes pancreatic adenocarcinoma cellular proliferation and invasiveness[J].Biochem Biophys Res Commun,2003,309(2):464-468.
[10]Anandasabapathy S,Jhamb J,Davila M,et al.Clinical and endoscopic factors predict higher pathologic gradesof Barrettdysplasia[J]. Cancer,2007,109(4):668-674.
[11]Westhoff BC,Weston A,Cherian R,et al.Development of Barrett' sesophagus six months after total gastrectomy[J].Am J Gastroenterol,2004,99(11):2271-2277.
[12]Rugge M,Russo V,BusattoG,et al.Thephenotype of gastricmucosa coexistingwith Barrett'soesophagus[J].JClin Pathol,2001,54 (6):456-460.
[13]Rajendra S,Ackroyd R,Robertson IK,et al.Helicobacter pylori, ethnicity,and the gastroesophageal reflux disease spectrum:a study from the East[J].Helicobacter,2007,12(2):177-183.
