β-连环蛋白和 APC蛋白在胃腺瘤和胃癌中的表达及意义
2011-03-09王震凯汪芳裕
王震凯,刘 炯,汪芳裕,刘 畅
南京军区南京总医院消化内科,南京 210002
胃癌是常见的消化道肿瘤,近来研究发现Wnt信号通路在肿瘤的发生发展中起重要作用。经典 Wnt信号通路中,β-连环蛋白和 APC蛋白是主要成员。β-连环蛋白是该通路异常激活的关键环节;而家族性腺瘤样息肉病蛋白(adenomatous polyposis coli p rotein, APC蛋白)在 β-连环蛋白降解过程中起着重要作用[1]。胃腺瘤型息肉(简称胃腺瘤)是胃癌癌前状态之一。本研究通过观察 β-连环蛋白和APC蛋白在正常胃黏膜、胃腺瘤和胃癌组织中的表达,探讨其在胃癌发生、发展中的作用及其对胃癌早期诊断的意义。
1 材料与方法
1.1 标本来源 收集 1999年2月 ~2010年3月南京军区南京总医院消化内科胃镜检查活检病理标本,共选取 126例,男 75例,女 51例,年龄 26~87岁,平均(53±4)岁。诊断均经病理检查证实,根据世界卫生组织(WHO)肿瘤分类,胃腺瘤38例,其中低级别上皮内瘤变 22例,高级别上皮内瘤变 16例;胃癌 48例,其中低分化、中分化和高分化腺癌各 16例。40例无胃癌家族史、活检病理检查诊断为非胃肿瘤者作为正常对照。标本 4%甲醛溶液固定,石蜡包埋、切片。
1.2 免疫组化试剂及染色方法 鼠抗人β-连环蛋白(浓缩型)和兔抗人APC蛋白(浓缩型)单克隆抗体均购自福州迈新生物技术有限公司,采用 ABC法,具体步骤参照试剂说明书进行,DAB显色。
判断标准:参照Mayuyama等[2]采用的方法,从细胞膜、细胞质和细胞核着色三个方面判断 β-连环蛋白的表达特征。β-连环蛋白阳性染色呈棕黄色。于光学显微镜下随机选择10个高倍视野(400×),每一视野计数 100个胃腺上皮细胞。细胞膜阳性表达、阳性细胞数>70%为正常表达,反之为膜表达缺失;细胞质或细胞核阳性表达、阳性细胞数 >10%为异位表达。膜表达缺失和异位表达统称为异常表达。
APC蛋白产物表达特征:正常细胞APC阳性表达主要定位于胞浆,成棕色颗粒。结果判定:同一切片阳性着色细胞数<30%为异常表达,≥30%为正常表达。
1.3 统计学分析 应用SPSS 10.0统计软件,率的比较行χ2检验,小样本率的比较采用 Fish精确概率检验。β-连环蛋白和APC蛋白在胃癌和胃瘤中表达的相关性采用spearman等级相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 β-连环蛋白在不同胃上皮组织中的表达 正常胃黏膜 β-连环蛋白表达呈清晰的棕黄色,几乎全部定位于细胞膜(100%),仅个别标本(3例)有极弱细胞质染色,未见细胞核表达。胃腺瘤组织 β-连环蛋白的异常表达主要发生在高级别上皮内瘤变组织中,表现为细胞质异位表达,个别标本(3例)有极弱核染色。而在低级别上皮内瘤变组织中均为正常表达。胃癌组织 β-连环蛋白细胞质和细胞核表达明显增加(89.6%),细胞膜表达明显减少。正常胃黏膜、胃腺瘤和胃癌组织异常表达率两两比较,差异均有统计学意义(见表1)。
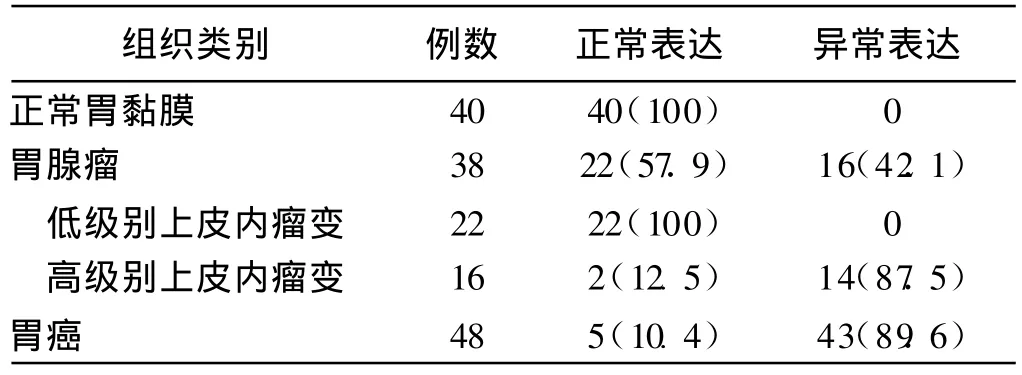
表 1 β-连环蛋白在不同胃上皮组织中的表达比较[例数(%)]Tab 1 Comparison ofβ-catenin in different gastric epithelial tissues[n(%)]
2.2 APC蛋白在不同胃上皮组织中的表达 正常胃黏膜、胃腺瘤、胃癌组织 APC蛋白异常表达率呈递增趋势,两两比较,差异均有统计学意义(见表2)。高级别上皮内瘤变APC蛋白异常表达率虽然高于低级别上皮内瘤变,但差异无统计学意义(见表3)。
2.3 β-连环蛋白和APC蛋白在胃腺瘤和胃癌组织中表达的相关性 48例胃癌组织中,5例 β-连环蛋白和APC蛋白均同时表达正常,43例 β-连环蛋白和 APC蛋白均同时表达异常,β-连环蛋白异常表达和APC蛋白异常表达呈显著正相关(r=1.0,P=0.000)。
38例胃腺瘤组织中,11例 β-连环蛋白和 APC蛋白均同时表达正常,10例β-连环蛋白和APC蛋白均同时表达异常,β-连环蛋白异常表达和 APC蛋白异常表达无明显相关性(r=0.169,P=0.430)。
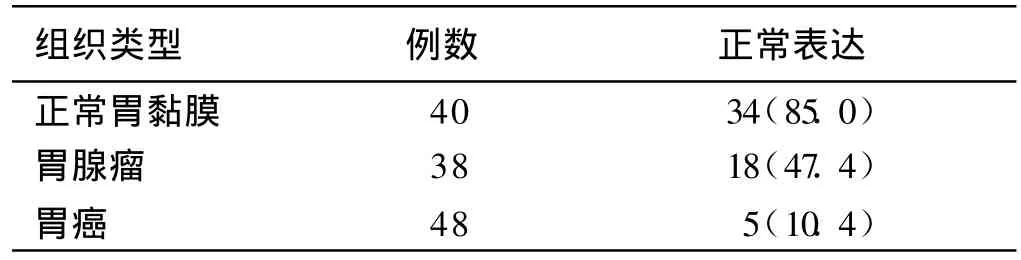
表2 APC蛋白在不同胃上皮组织中的表达比较[例数(%)]Tab 2 Comparison ship of APC p rotein in different gastric epithelial tissues[n(%)]
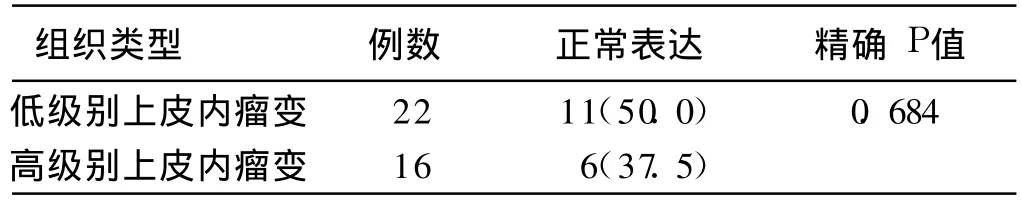
表3 胃腺瘤组织类型与APC表达的关系[例数(%)]Tab 3 Relation o f gastric adenomas types with the exp ression o f APC[n(%)]
3 讨论
经典的Wnt信号通路的异常激活,可引起生长发育缺陷,并参与肿瘤的发生。该通路通过 β-连环蛋白在细胞核中累积而启动靶基因。正常成熟细胞中,胞质内 β-连环蛋白大部分与细胞膜上的 E-钙黏蛋白结合,参与细胞同质性黏附,少部分 β-连环蛋白通过氨基端富含丝氨酸/苏氨酸残基可与 APC-轴蛋白-GSK3β多蛋白复合体结合,磷酸化后被降解;如这些残基突变或缺失,则 β-连环蛋白因不能被降解而致游离β-连环蛋白增加,激活Wnt信号通路[1]。APC基因定位于人染色体 5q21,其结构特点为:①其氨基端区几乎不含脯氨酸,易形成 α螺旋结构,两个 α螺旋间的相互作用而形成同源或异源二聚体;②其中心区富含脯氨酸,具有降解 β-连环蛋白的能力[3]。抑癌基因APC突变、缺失、启动子区域甲基化均会导致APC基因失活,主要方式仍为等位基因的突变。基因突变常使APC蛋白缩短,形成“去顶”(truncation)改变,使APC蛋白空间结构发生改变。正常APC多肽的七价重复区能稳定两个 α螺旋间的相互作用而形成一个卷曲螺旋,使它们结合成二聚体,该二聚体与抑制细胞有丝分裂有关,突变可使APC蛋白对细胞增殖抑制能力减弱。突变若使中心区中结合 β-连环蛋白的区域异常,则使APC蛋白不能与β-连环蛋白结合,同时也失去了对 β-连环蛋白水平调节作用,并使细胞获得持续生长的信号,进而发生恶性转化[4]。突变的APC蛋白多无羧基端结构,失去了对微管系统的调节作用,微管组装减缓而分解加速,导致细胞 DNA合成旺盛、有丝分裂异常及恶性表型形成。APC蛋白“去顶”改变可破坏与m3mAchR的同源序列,使其失去对细胞有丝分裂所必需的 Ca2+/磷酸肌醇信号通路的抑制作用,导致细胞的无限生长[5]。因此,β-连环蛋白和APC-轴蛋白-GSK3β多蛋白复合体是导致Wnt通路异常激活的关键环节。
本研究结果显示,正常胃黏膜 β-连环蛋白为胞膜表达,胃腺瘤和胃癌均存在异常表达,异常表达率分别为0、42.1%和89.6%,组间差异均有统计学意义。其中,高级别上皮内瘤变胃腺瘤和高、中分化腺癌主要为胞质表达,低分化腺癌胞质、胞核均有表达。提示 β-连环蛋白从胞膜到胞核的转移与胃癌的发生、发展密切相关。APC蛋白在胃腺瘤及胃癌组织中表达均明显低于正常胃黏膜,表明在癌前病变胃黏膜组织中APC蛋白表达已出现异常。可见,β-连环蛋白和APC蛋白与胃癌的发生、发展密切相关。Spearman等级相关分析表明β-连环蛋白和 APC蛋白在胃癌组织中的表达存在着密切关系(P=0.000),说明二者可能在胃癌发生、发展中存在互相协同作用。Abraham等[6]的研究表明,91%的胃腺瘤存在 β-连环蛋白基因突变。肠型胃癌中 β-连环蛋白基因外显子 3缺失和错义的发生率达 26.9%[7]。Ebert等[8]的研究也发现,肠型胃癌中β-连环蛋白增加是因为APC蛋白和β-连环蛋白基因突变,导致β-连环蛋白降解障碍。Hao等[9]通过分析微卫星D5S346、D5S82和D5S299,研究74例结直肠腺瘤和 21例结直肠癌的组织中等位基因的缺失,发现有55例(占57.8%)存在APC等位基因的缺失;同时,在细胞株突变中,大多数APC也是无义或移码突变,产生截短蛋白。APC突变也与其他肿瘤有关,包括髓母细胞瘤、侵袭性纤维腺瘤及乳腺癌等。以上研究说明,APC和(或)β-连环蛋白的基因突变可能在肿瘤的发生、发展过程中起重要作用。
本研究表明在胃腺瘤组织中 β-连环蛋白和APC蛋白异常表达相关性无统计学意义。APC蛋白各种功能的异常可由不同类型的突变引起,但是某种APC蛋白基因错义突变较少引起其表面型改变[10]。因此,腺瘤组织的一个APC等位基因的轻微突变(如点突变)不一定使其失去与APC抗体C2端结合的能力。另外,APC蛋白可形成同源二聚体,“截短蛋白”可与全长蛋白形成二聚体破坏 APC蛋白的功能也不一定影响其与APC抗体C2端的结合,本实验中的无功能APC基因蛋白产物却表现为全长APC蛋白的免疫反应,因而影响实验统计学结果。另一方面,在胃癌早期事件中,参与胃癌发生发展的影响因素、基因、途径很多,在胃癌早期事件中,APC蛋白和β-连环蛋白在其中发挥的作用及相互作用的具体机制仍有待进一步探讨。
总之,β-连环蛋白和 APC蛋白在胃癌的发生、发展中起重要作用。对此进行深入研究有助于我们进一步了解肿瘤的发生发展机制,可能为胃癌的诊断和基因治疗提供新的依据。
[1]Wang ZK,Zhu RM.Update of theWntsingnaling path in tumor[J]. Journey of Medical Postgraduates,2007,20(12):1294-1297.
王震凯,朱人敏.Wnt信号转导通路在肿瘤中的研究进展[J].医学研究生学报,2007,20(12):1294-1297.
[2]Mayuyama K,Ochiai A,Akimoto S,et al.Cytoplasmic beta-catenin accumulation asa predictor of hematogenousmetastasis in human colorectal cancer[J].Oncology,2000,59(4):302-309.
[3]Su LK,Steinbach G,Sawyer JC,et al.Genomic rearrangements of the APC tumor-suppressor gene in familial adenomatous polyposis[J]. Hum Genet,2000,106(1):101-107.
[4]Jilong Y,Jian W,Xiaoyan Z,et al.Analysis of APC/beta-catenin genesmutations and Wnt signalling pathway in desmoid-type fibromatosis[J].Pathology,2007,39(3):319-325.
[5]Andresen PA,Johansen T,Eide TJ,et al.Gene symbol:APC[J]. Hum-Genet,2007,121(2):288.
[6]Abraham SC,Nobukawa B,Giardiello FM,et al.Sporadic fundic gland polyps:common gastric polyps arising through activating mutations in the beta-catenin gene[J].Am J Pathol,2001,158(3): 1005-1010.
[7]Park WS,Oh RR,Park JY,et al.Frequent somatic mutations of the beta-catenin gene in intestinal-type gastric cancer[J].Cancer Res, 1999,59(17):4257-4260.
[8]Ebert MP,Fei G,Kahmann S,et al.Increased beta-catenin mRNA levels and mutational alterations of the APC and beta-catenin gene are presentin intestinal-type gastric cancer[J].Carcinogenesis,2002,23 (1):87-91.
[9]Hao X,Frayling I,Willcocks T,et al.Beta-catenin expression and allelic loss atAPC in sporadic colorectal carcinogenesis[J].Vir-chows Arch,2002,440(4):362-366.
[10]Ficari F,Cama A,Valanzano R,et al.APC gene mutations and colorectal adenomatosis in fam ilial adenomatous polyposis[J].Br J Cancer,2000,82(4):348-353.
