禽呼肠孤病毒σ2基因的真核表达及其免疫效果研究
2011-03-07邓显文谢芝勋谢丽基谢志勤刘加波庞耀珊
邓显文,谢芝勋,谢丽基,谢志勤,刘加波,庞耀珊
(广西兽医研究所,广西 南宁 530001)
禽呼肠孤病毒(ARV)广泛存在于世界范围内的商品肉鸡群中,可感染鸡、火鸡及一些鸟类[1],临床上主要引起鸡关节炎/腱鞘炎、吸收障碍综合症、矮小综合症和呼吸道病等多种疾病,造成很大的经济损失[1-2]。
ARV的基因组为双股RNA(dsRNA),由大(L)、中(M)和小(S)三组共 10个节段基因组成[3]。S组有S1、S2、S3、S4四个基因,其中S1基因编码的σ3蛋白是外壳蛋白中最小的一种蛋白,携带有ARV的特异性中和反应的表面抗原,能刺激机体产生保护性的中和抗体[4-5],该蛋白还是一种细胞吸附的特异性蛋白,能够特异地吸附到禽类细胞上[6]。由S2基因编码的σ2蛋白与σ3蛋白一样,都是病毒的外壳蛋白之一,拥有367个氨基酸,携带有群特异型中和抗原决定簇。σ2通过σ3作用,提高感染细胞上的能力,并在病毒的致病机理上起着一定的作用[7]。一些研究者据此进行了不同类型ARV疫苗的探索,包括灭活疫苗、弱毒苗和亚单位疫苗等[8-9]。DNA疫苗是将编码目的抗原蛋白基因序列的真核质粒导入机体细胞,通过宿主细胞的转录和翻译系统合成抗原蛋白,表达出的抗原蛋白经MHC I类和II类分子提呈免疫系统,诱发机体产生特异性体液免疫和细胞免疫反应,其抗原表达可持续数月[10-11]。因此,DNA疫苗具备类似自然感染的优点,成为研究的热点课题。本研究将ARV S1133毒株和广西分离株R1的编码σ2蛋白的基因克隆到pcDNA3.1(+)真核表达载体,用抽提、纯化的重组质粒DNA进行多点肌肉注射的SPF鸡,应用PCR检测pCDNA3.1+-S1133-σ2和 pcDNA-R1-σ2阳性重组质粒的存在,现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 ARV S1133毒株由美国康州大学Khan博士惠赠,宿主菌JM109,广西分离株R1[12],为本室保存。pcDNA3.1(+)真核表达载体购自Promega公司。
1.1.2 主要酶与试剂 Taq DNA聚合酶、RT-PCR试剂盒和限制性内切酶Eco R I、Xho I购自大连宝生物公司。M λDNA/Eco R I+Hind Marker,低分子量蛋白Marker,T4 DNA连接酶和质粒提取试剂盒购自Promega公司。羊抗鸡IgG和Trizol抽提试剂购自GIBCOL公司。禽呼肠孤病毒阳性血清购自哈尔滨兽医研究所。
1.2 方法
1.2.1 引物的设计与合成 根据ARV毒株S1133 S2基因序列[U20642]设计合成了一对跨越σ2蛋白基因的特异性引物。上游引物序列为XZ141:5’-GCGAATTCGCGCAAGCCGCAATGGAG-3’;下游引物 序 列 为 XZ142:5’-GCTCGAGTGACCCGGAGGTACCTTA-3’。两引物的5’端分别含有Eco R I和Xho I酶切位点,扩增的目的片段长为1 146 bp。引物由大连宝生物公司合成,用TE Buffer配成适当浓度,贮存于-20℃备用。
1.2.2 ARVσ2蛋白基因的获取 (1)RNA的提取:参照GIBCOL公司RNA提取试剂盒操作说明。(2)RT-PCR扩增ARVσ2基因:反转录合成cDNA,建立如下反转录体系,总反应体积为20μL,RNA 为 2 μL(约 20 μg),4 μL 8 mM MgCl2,2 μL 10×PCR缓冲液,2μL 10 mM dNTP(4种碱基),1 μL RNA抑制剂,1μL随机引物,1μL Mulv反转录酶,用无Rnase水加至总体积为20μL,离心均匀,于 25 ℃ 10min,42℃ 60min,99℃ 5min,4℃结束cDNA合成,供PCR扩增备用。(3)σ2基因的PCR扩增:采用100μL反应体系,即在20μL cDNA管中加入 4 μL 8 mM MgCl2,8 μL 10×PCR 缓冲液,600 ng上游引物和下游引物,0.5μL(2.5单位)Taq DNA聚合酶,用无菌水加至总体积为100 μL,首先 94℃ 5 min,然后进入 94℃ 1min,60℃退火1min,72℃延伸1.5min的循环,循环35次后,最后72℃延伸10min结束,4℃保存。
1.2.3 重组表达载体的构建与鉴定 用DNA片段回收试剂盒,切胶回收目的片段,经Eco R I和Xho I双酶切,取纯化的ARVσ2蛋白基因产物按2∶1的比例与经同样双酶切的真核表达载体pcDNA3.1(+)混匀,反应体系为 10×buffer 1 μL,PCR 回收产物(200mg/L)2 μL,pCDNA3.1+载体(100mg/L)1 μL,dH2O 6μL。16℃连接过夜(16 h)。吸取10μL连接产物,分别加入到200μL JM109α(CaCl2法制备)的感受态细胞中,随后冰浴30 min,42℃ 1.5 min,冰浴1~2min,加入800μL无Amp的LB培养液于37℃摇床振荡培养45min。然后吸100 uL均匀涂布于含有Amp(终浓度为100 mg/L)的LB琼脂平板上,待液体吸干后37℃预热20 min,倒置平板,于37℃培养过夜。挑选呈白色菌落的重组质粒,经PCR初步鉴定后,用Eco RⅠ和XhoⅠ进行双酶切鉴定,将鉴定的ARV S1133、广西分离株R1的阳性重组质粒命名为 pCDNA3.1+-S1133-σ2、pCDNA3.1+-R1-σ2。分别提取阳性菌落的质粒DNA测序。
1.2.4 免疫疫苗的制备 (1)pCDNA3.1+-S1133-σ2、pCDNA3.1+-R1-σ2:将阳性重组质粒划线于含有Amp的LB琼脂平板上,挑取单个菌落在含Amp(终浓度为100mg/L)的LB培养基中,37℃振荡培养过夜。使用质粒提取试剂盒提取重组质粒DNA。经紫外分光光度计测定OD260值,计算重组质粒DNA 的浓度。(2)σ2蛋白:ARV σ2结构蛋白采用广西兽医研究所已构建好的质粒菌,参照谢芝勋等[13-14]介绍的方法表达、鉴定并且纯化,加入弗氏佐剂制备而成。(3)ARV灭活苗:由本实验室灭活ARV S1133,加入弗氏佐剂制备而成。
1.2.5 免疫保护试验 (1)试验鸡分组及免疫接种:试验前随机抽取5只SPF鸡,剖杀取关节、肝、肾、脾、法氏褰、胸腺、脑等7个部位样品,处理[11]抽提核酸后,参照谢芝勋[12]的方法进行RT-PCR检测。试验设 pCDNA3.1+-S1133-σ2免疫 1组、pCDNA3.1+-R1-σ2免疫 2 组、灭活苗免疫组、σ2蛋白组及空白对照组。pCDNA3.1+-S1133-σ2免疫1组、pCDNA3.1+-R1-σ2免疫 2组:按 40 μg的剂量免疫14日龄SPF鸡(各15只)2次,每次间隔一周,采用多点肌肉注射。灭活苗免疫组:各取0.1mL的ARV灭活苗经颈部皮下免疫14日龄SPF鸡(15只)2次,每次间隔一周。σ2蛋白免疫组:按100μg的剂量经颈部皮下免疫14日龄SPF鸡(15只)2次,第一次免疫时加入等量的弗氏完全佐剂,第2次免疫时加入等量的弗氏不完全佐剂。空白对照组(15只):注射0.1mL的生理盐水。(2)免疫鸡血清的 Western-blotting 分析:pCDNA3.1+-S1133-σ2、pCDNA3.1+-R1-σ2免疫组及空白对照组免疫前和第2次免疫后2周,采血收集血清,参考文献[13]进行Western-blotting分析。(3)试验鸡的RT-PCR检测 :pCDNA3.1+-S1133-σ2免疫 1 组、pCDNA3.1+-R1-σ2免疫2组、灭活苗免疫组、σ2蛋白免疫组及空白对照组第2次免疫后2周,试验鸡经爪垫攻毒10倍稀释的ARV S1133株鸡胚尿囊液0.1mL。攻毒第3天开始扑杀试验鸡,分别在第3、5、7天采集关节、肝、肾、脾、胸腺、胰腺、法氏囊等7个部位样品,应用RT-PCR检测ARV S1133 RNA存在,统计结果,用Excel软件进行分析。
2 结果与分析
2.1 ARVσ2基因的RT-PCR扩增
用引物XZ141和XZ142进行RT-PCR扩增,S1133、R1扩增产物电泳,由图1可见ARV S1133毒株和广西分离株R1扩增产物在1 146 bp处均有一条清晰的条带,与预期扩增目的基因大小相一致,说明引物设计合理,RT-PCR反应条件正确,成功扩增了σ2基因。
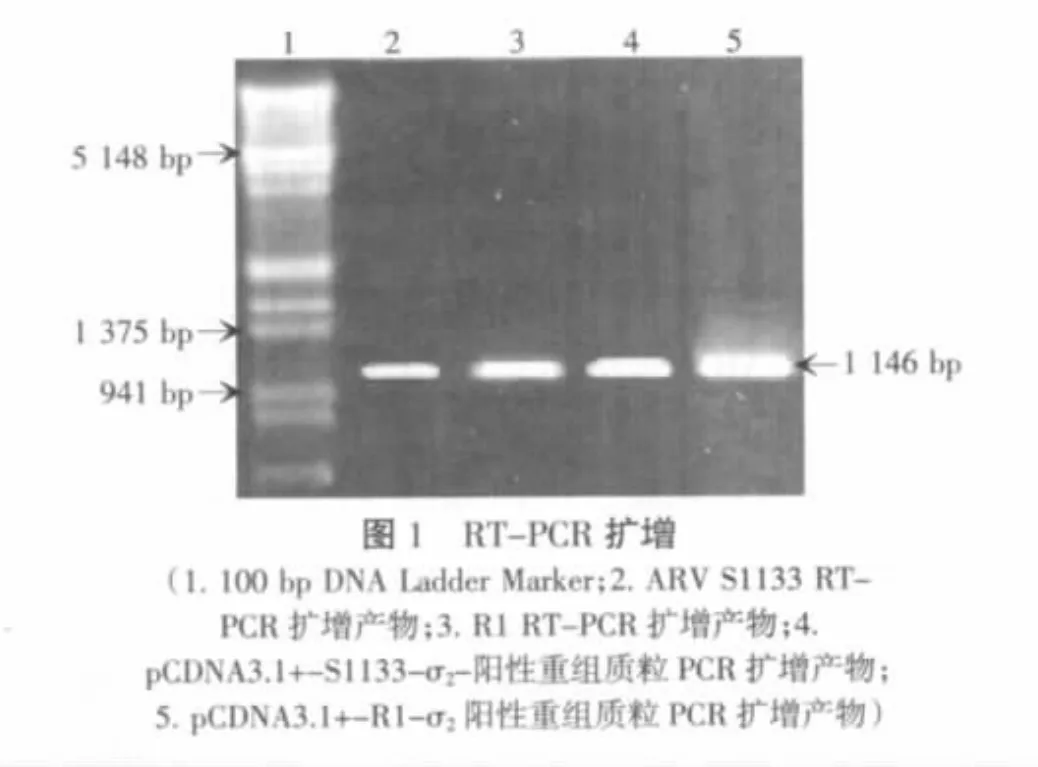
2.2 重组质粒的PCR、酶切和测序鉴定
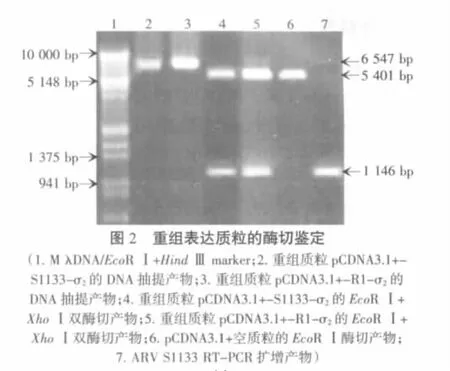
用筛选的阳性重组质粒作为模板进行PCR扩增,用1%的琼脂糖凝胶分析PCR产物,扩增的目的片段与预期扩增目的基因大小相一致,约为1 146 bp,说明质粒初步鉴定为阳性质粒。取阳性重组表达质粒DNA进行Eco RⅠ和XhoⅠ双酶切鉴定,经1%琼脂糖凝胶电泳分析,得到4 968 bp的载体DNA和1146 bp的σ2基因片段(见图2),说明目的基因已经插入到表达载体中,测序结果与GenBank数据库进行比较,表明插入的片段为σ2目的基因,表达σ2基因插入的位置,大小和阅码框架均正确。
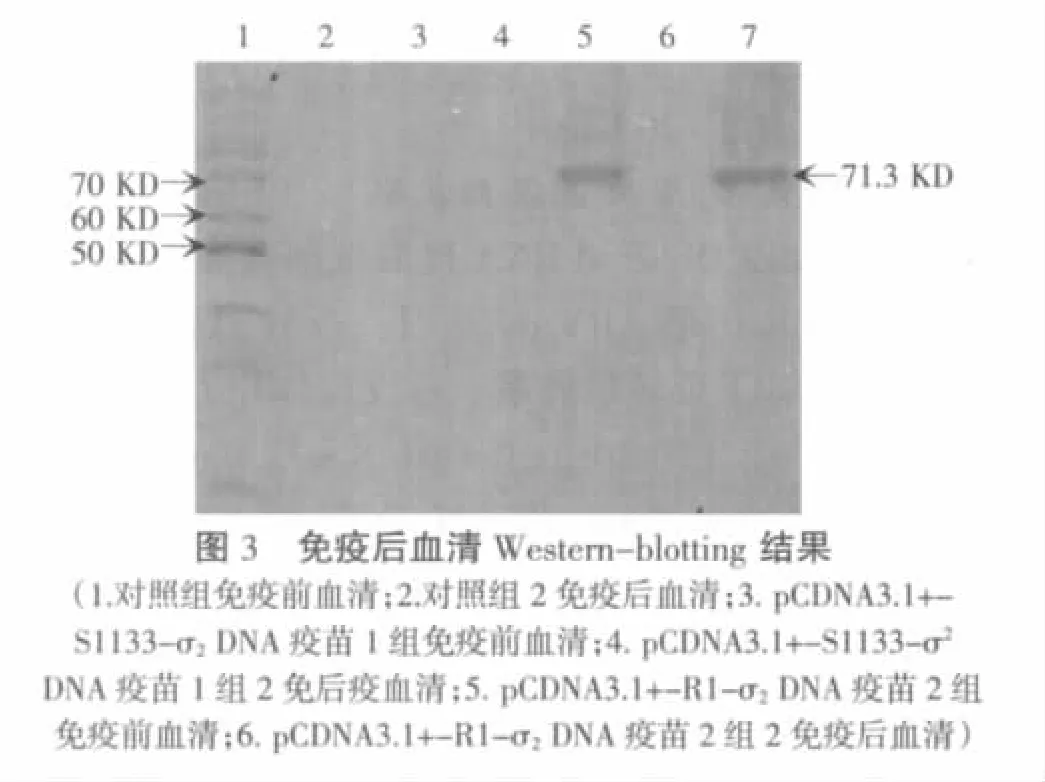
2.3 Western-blotting结果
如图3所示,pCDNA3.1+-S1133-σ2免疫1组、pCDNA3.1+-R1-σ2免疫2组二免后收集的血清在71.3 kD左右有一特异条带,而对照组及pCDNA3.1+-S1133-σ2、pCDNA3.1+-R1-σ2免疫组免疫前收集的血清无此特异性反应,说明pCDNA3.1+-S1133-σ2免疫 1 组、pCDNA3.1+-R1-σ2免疫 2 组免疫SPF鸡后能产生特异性血清。
2.4 免疫效果
用RT-PCR检测接种前扑杀鸡的关节、肝、肾、脾、胸腺、胰腺和法氏囊均未检出ARV RNA。用RT-PCR检测SPF鸡攻毒后的不同组织抽提的ARV RNA,检测结果见表1。从表中可看,空白对照组与灭活苗免疫组、pCDNA3.1+-S1133-σ2免疫1组 、pCDNA3.1+-R1-σ2免疫2组和σ2蛋白免疫组差异均显著(p<0.05);σ2蛋白免疫组与 pCDNA3.1+-S1133-σ2免疫 1 组、pCDNA3.1+-R1-σ2免

表1 SPF鸡免疫后人工感染ARV后RT-PCR的检出率
疫2组差异显著(p<0.05),其中空白对照组与灭活苗免疫组、pCDNA3.1+-S1133-σ2免疫 1 组 、pCDNA3.1+-R1-σ2免疫2组和σ2蛋白免疫组差异均极显著(p<0.01)。σ2蛋白免疫组与pCDNA3.1+-S1133-σ2免疫 1 组 、pCDNA3.1+-R1-σ2免疫 2 组差异不显著(p>0.05);pCDNA3.1+-S1133-σ2免疫 1组 、与pCDNA3.1+-R1-σ2免疫2组差异不显著(p>0.05)。灭活苗免疫组检出率为 5.7%,pCDNA3.1+-S1133-σ2免疫1组检出率为11.4%,pCDNA3.1+-R1-σ2免疫 2组检出率为 10.5%,σ2蛋白免疫组免疫组检出率为8.6%,检出率均明显低于空白对照组,说明各免疫组的相应疫苗都发挥了免疫保护作用。在整个试验中,最高检出部位为关节、胸腺、胰腺和法氏囊检出率比较低。
3 结论与讨论
(1)根据ARV毒株S1133 S2基因序列[U2064 2]设计合成了一对跨越σ2蛋白基因的特异性引物XZ141和XZ142进行RT-PCR扩增,成功扩增了σ2基因,扩增的目的片段长为1 146 bp。回收σ2基因目的片段并克隆到真核表达载体pcDNA3.1(+)中,经PCR鉴定和Eco RⅠ、XhoⅠ双酶切鉴定,说明目的基因已经插入到表达载体中,测序结果与GenBank数据库进行比较,表明插入的片段为σ2目的基因的位置,大小和阅码框架均正确。
(2)pcDNA载体为含有tac启动子以及Amp抗性基因的真核高效表达载体,通过宿主细胞的转录系统合成目的蛋白抗原,诱导宿主产生对该蛋白的免疫应答,诱导出针对保护性抗原的特异性体液免疫和细胞免疫,从而达到预防和治疗疾病的目的[15]。本实验采用RT-PCR技术扩增完整的禽呼肠孤病毒ARVσ2基因,将其插入到真核表达载体pcDNA3.1(+)中,成功构建真核表达质粒。经抽提、纯化的重组质粒DNA进行多点肌肉注射的SPF鸡,应用RT-PCR技术在第7天仍能从注射肌肉部位、肝、关节检出 pCDNA3.1+-S1133-σ2、pCDNA3.1+-R1-σ2阳性重组质粒,说明了pCDNA3.1+-S1133-σ2、pCDNA3.1+-R1-σ2能在鸡体内存活;用Western-blotting对免疫鸡血清分析表明,该阳性重组质粒能够诱导机体产生抗ARVσ2基因蛋白的抗体。
(3)在被检测的7种组织中,攻毒后关节的ARV RNA的检出率最高,其次为脾和肾,胸腺、胰腺和法氏囊检出率比较低,说明攻毒所用的ARV毒株对关节具有亲嗜性。
(4)本实验采用RT-PCR技术扩增完整的禽呼肠孤病毒ARVσ2基因,将其插入到真核表达载体pcDNA3.1(+)中,成功构建真核表达质粒pCDNA3.1+-S1133-σ2、pCDNA3.1+-R1-σ2。用抽提的pCDNA3.1+-S1133-σ2、pCDNA3.1+-R1-σ2重组质粒接种SPF鸡2次后,以ARV S1133毒株进行攻毒,使用RT-PCR方法对免疫鸡关节及内脏器官进行检测,从表1可看出,pCDNA3.1+-S1133-σ2免疫 1组检出率为 11.4%,、pCDNA3.1+-R1-σ2免疫2组检出率为10.5%明显低于空白对照组(32.4%)(p<0.05),与灭活苗免疫组比较差异不显著(p>0.05),说明用构建的 pCDNA3.1+-S1133-σ2、pCDNA3.1+-R1-σ2免疫SPF鸡,鸡只获得了较好的免疫保护。同时,pcDNA-σ2免疫组的检出率还稍微高于σ2蛋白免疫组的原因,是否是受重组质粒DNA免疫剂量、免疫途径或者σ2蛋白免疫剂量高的影响,重组质粒 pCDNA3.1+-S1133-σ2、pCDNA3.1+-R1-σ2免疫鸡能否有更好的免疫效果还有待于进一步研究。
(5)σ2蛋白是ARV外壳蛋白之一,携带有群特异型中和抗原决定簇,与σ2蛋白一样能刺激机体产生保护性的群特异性抗体,σ2通过σ3作用,提高病毒感染细胞的能力,在ARV的感染和致病作用上有着重要作用。通过对S1133、R1广西分离株σ2蛋白基因克隆至真核表达载体pcDNA3.1(+),并证明了该重组质粒能诱导机体产生抗σ2基因蛋白的抗体,为进一步研究ARV免疫奠定了基础。
[1]BW.卡尔尼克(高福等译).禽病学(第10版)[M].北京:中国农业大学出版社,1999,902-908.
[2] Dale R,pedro K H,Kleven S.Characteristics and pathogenicity of two avian veoviruses lsolated from chickens with leg problems[J].Avian Diseases,1983,27(1):255-660.
[3] 殷 震,秀景华.动物病毒学(第2版)[M].北京:科学出版社,1997.544-548.
[4] NI Y,kenp M C.A comparative study of avian reovirus pathogenicity:virus Spread and replication and induction or lesion[J].Avian Disease,1995,39:554-566.
[5]NIY,Raming R F,Kemp M C.Identification of Proteins encode by avian reovirases and evidence for posl-trouslationalmodification[J].Virology,1993,193:466-469.
[6] Meanger J,Wickramasinghe R.Association between the protein of avian reovirus and virus induced fusion of cell[J].Archives of virology,1999,144:193-197.
[7] Hung JL,Long H L,Hsiao W H,et al.Molecular evolution of avian reovirus:evidence for genetic diversity and reassortmemt of the S-class genome segment and multiple cocirculating lineages[J].Virology,2003,314:336-349.
[8]RauW E,vander H L,Kalbac M,etal.Onset of progeny immunity against viral arthritis/tenosynovitis after experimental vaccination of parent b reeder chickens and cross-immunity against six reovirus isolates[J].Avian Dis,1980,24(3):648-57.
[9] Shapouri M R S,Kane M,Letarte M,et al.Cloning sequencing and expression of the S1 gene of avian reovirus[J].Journal of Genetal Virology,1995,76:1515-1520.
[10]Danko I,Wolff JA.Direct gene transfer intomoscle[J].Vaccine,1994,12(16):1449-1502.
[11]SakaguchiM,Nakamura H,Sonoda K,etal.Protection of chickens from Newcastle disease by vaccination with a linear plasmid DNA expression the F protein of Newcastle disease virus[J].Vaccine,1996,14(8):747-752.
[12]廖 敏,谢芝勋,刘加波,等.鸡呼肠孤病毒分离与鉴定[J].中国家禽,2002,24(1):12-14.
[13]邓显文,谢芝勋,刘加波,等.禽呼肠孤病毒广西分离株σ2基因的克隆和表达[J].中国兽医学报,2006,26(2):133-135.
[14]谢芝勋,秦春香,谢丽基.禽呼肠孤病毒P17蛋白基因在大肠杆菌中的表达及其ELISA检测方法的建立[J].中国兽医科学,2007,37(09):777-782.
[15]宋勤叶,杨汉春.核酸疫苗研究进展[J].动物医学进展,2004,25(3):37-40.
