白假丝酵母菌对人脐静脉内皮细胞株ECV304细胞增殖的诱导作用
2011-03-07张琳车团结史晓艳何祥一
张琳 车团结 史晓艳 何祥一
(1.兰州大学口腔医学院 口腔修复研究室;2.兰州大学生命科学院 细胞生物学研究所,兰州 730000)
白假丝酵母菌对人脐静脉内皮细胞株ECV304细胞增殖的诱导作用
张琳1车团结2史晓艳1何祥一1
(1.兰州大学口腔医学院 口腔修复研究室;2.兰州大学生命科学院 细胞生物学研究所,兰州 730000)
目的 研究白假丝酵母菌(S.albicans)对人脐静脉内皮细胞株ECV304细胞增殖及细胞周期的影响。方法 体外培养ECV304,实验分为S.albicans上清液组、S.albicans灭活菌液组、上清液和灭活菌液混合组、对照组。采用MTT法、细胞计数法、倒置显微镜及流式细胞术分别观察各组对ECV304细胞增殖及细胞周期的影响。结果 在不同浓度、不同时间的培养条件下,4倍稀释的S.albicans上清液在培养48 h能显著促进细胞增殖;倒置显微镜观察发现4倍稀释的S.albicans上清液实验组细胞密度明显增高;上清液和灭活菌液分别作用细胞40h后,上清液组细胞S期、G2/M期所占百分比显著升高,增殖指数(PI)增高,与对照组相比,有显著性差异(P<0.05)。而灭活菌液组的PI值无显著性差异(P>0.05)。结论S.albicans的代谢产物可引起ECV304细胞的增殖。
白假丝酵母菌; 增殖; 代谢产物; 细胞周期
酵母菌为条件致病菌,可寄生于正常人皮肤或口腔黏膜表面。当有全身或局部诱发因素如有营养摄入不足、长期使用广谱抗生素或免疫抑制剂、长期配戴活动义齿等条件时易诱发口腔黏膜感染。
自Jepsen等在口腔黏膜白斑的上皮角质层中找到酵母菌的菌丝以来[1],白假丝酵母菌(Saccharomyces albicans,S.albicans)与口腔白斑的关系引起国内外学者广泛关注。口腔白假丝酵母菌性白斑又称口腔慢性增殖性白假丝酵母菌病(chronic hyperplasticSaccharomyces albicans,CHS),是口腔白斑伴有酵母菌慢性感染,属于角化型癌前病变。研究[2-3]发现:在口腔酵母菌菌群中,S.albicans是最常见的病原体,约占67%~80%。流行病学的调查[4]显示:口腔白斑患者中,S.albicans的检出率为34%,受S.albicans感染过的动物可建立白斑动物模型。病理观察[5]发现:白斑伴有上皮细胞异常增生时,其恶变潜能随上皮细胞异常增生程度的增加而增大。这些研究表明:侵入上皮的S.albicans不仅并发感染引起炎性反应,还有可能引起上皮增殖形成白斑。S.albicans在口腔白斑发病过程中的致病机制尚无定论,目前主要集中在研究S.albicans与上皮关系的层面上,如Zhu等[6]阐述了S.albicans黏附机制和入侵黏膜上皮细胞的分子机制。本研究采用体外培养人脐静脉内皮细胞ECV304的实验方法来模拟人口腔黏膜上皮细胞,利用S.albicans培养上清液及其灭活菌体处理成分与细胞共培养,观察其对细胞增殖的影响。
1 材料和方法
1.1 材料
S.albicansATCC 90028(由四川大学口腔疾病研究国家重点实验室惠赠)。ECV304购自中国科学院上海药物研究所;MTT(批号9710)(Sigma公司,美国);RPMI 1640培养基(Gibco公司,美国),新生小牛血清(杭州四季青生物公司)。
1.2 方法
1.2.1S.albicans上清液和灭活菌液的制备 将S. albicans在37℃沙堡氏液体培养基中振荡培养48 h后,并高速离心(4 000 r·min-1、30min)。上清液用0.22μm滤膜2次过滤除菌后得到S.albicans上清液;10%甲醛溶液固定菌沉淀5 d,磷酸缓冲液洗2次后稀释沉淀物至每毫升5×106CFU,即得S.albicans灭活菌液,备用。
1.2.2 实验分组 1)S.albicans上清液组:作用时间恒定(40h)、不同作用浓度(RPMI 1640细胞培养液倍比稀释S.albicans上清液为3个实验终浓度1×、4×、16×);作用浓度恒定(4×)、不同作用时间(24、48、72 h)。2)S.albicans灭活菌液组:作用时间恒定(40 h)、不同作用浓度(RPMI 1640细胞培养液倍比稀释S.albicans灭活菌液为3个实验终浓度1×、4×、16×);作用浓度恒定(4×)、不同作用时间(24、48、72 h)。3)上清液和灭活菌混合组,即将4×稀释的上清和灭活菌分别按1∶2、2∶1进行混合:作用时间恒定(40 h)、不同作用浓度(RPMI 1640细胞培养液倍比稀释上清液加灭活菌混合液为3个实验终浓度4×、16×、64×);作用浓度恒定(4×)、不同作用时间(24、48、72 h)。4)对照组:加入等量完全培养基。
1.2.3 ECV304细胞传代培养 ECV304细胞来源于健康产妇正常娩出的胎盘游离端脐带,分离脐静脉后得到的永生内皮细胞株。早在1984年国外已有学者应用其进行感染菌与宿主细胞交互作用方面的实验探索[7]。因缺乏正常口腔黏膜细胞系的来源,而脐带内皮细胞具有与口腔黏膜细胞最为接近的生理特性,故本实验用ECV304模拟人口腔黏膜上皮细胞。
复苏冻存的ECV304细胞,在含10%小牛血清的RPMI 1640完全培养基中,37℃、5%CO2、95%空气及饱和湿度的培养箱中培养。每2~3 d更换1次培养基,当细胞长满瓶壁的80%以上时传代。收获指数生长期的ECV304细胞,备用。
1.2.4 MTT法测定ECV304细胞增殖率 用完全培养基调整细胞密度至每毫升1×105个,接种于96孔板,每孔100mL,设3个平行。24 h细胞完全贴壁进入对数生长期后,将上清液、灭活菌液(1×、4×、16×);上清加灭活菌液(2∶1)、上清加灭活菌液(1∶2)(4×、16×、64×),每孔10μL分别加入细胞中。37℃培养40 h后,每孔加入MTT(5mg·mL-1)10μL,继续培养4 h后弃去孔内液体,加入10%SDS液每孔120μL,置于培养箱中12 h后,EL340酶联免疫仪在490 nm单波长下测定每孔的吸光度A值。每组设5孔平行。细胞增殖率(%)=(实验组吸光度A值-对照组吸光度A值)/对照组吸光度A值×100%。
1.2.5 细胞计数法测定ECV304细胞增殖变化 用完全培养基调整细胞密度至每毫升5×104个接种于6孔板,每孔2mL。24 h细胞完全贴壁进入对数生长期后加入4×上清液、4×灭活菌悬液、16×上清加灭活菌液(2∶1)、16×上清加灭活菌液(1∶2),每孔200μL。置于培养箱中分别培养24、48和72 h后取出,胰酶消化后细胞计数,每组设3孔平行。
1.2.6 光镜密度观察ECV304细胞 ECV304细胞以每毫升5×104个密度接种在6孔板中,培养24 h后分别加入4×上清液、4×灭活菌悬液,40 h后在倒置显微镜下观察细胞密度变化。
1.2.7S.albicans上清液和灭活菌液对ECV304细胞周期的影响 将ECV304细胞置于10mL完全培养液中培养24 h,细胞贴壁进入对数生长期后,加入1mL的4×上清液、4×灭活菌悬液、另设单独培养的细胞为对照。继续培养40 h后,2.5 g·L-1胰酶消化细胞,收集于离心管中,PBS洗2次,加入碘化丙啶染液,避光4℃作用30min,流式细胞仪收集检测细胞DNA周期。软件分析G0/G1期、S期、G2/M期细胞百分数,每组实验均设3个平行。增殖指数(proliferation index,PI)(%)=(S+G2/M)/(G0/G1+S+G1/M)×100%。
1.2.8 统计学分析 结果用均数±标准差表示。应用SPSS 13.0软件包进行分析,分别对各个实验组进行单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 S.albicans上清液与灭活菌液对ECV304细胞增殖作用的影响
不同浓度的S.albicans上清液与灭活菌液对ECV 304细胞增殖作用的影响见表1,由表1可见,不同稀释浓度的上清液,当作用时间为40 h时均可促细胞增殖,与对照组相比差异有显著性(P<0.05);不同稀释浓度的灭活菌液对细胞增殖的作用,在4×灭活菌液时,与对照组相比差异有显著性(P<0.05)。但在原倍(1×)和高倍(16×)稀释时,经检验差异无统计学意义(P>0.05)。
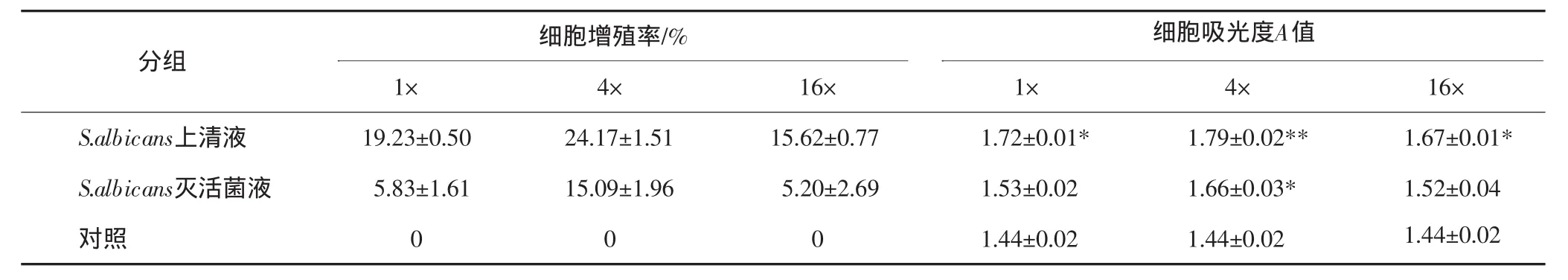
表1 上清液和灭活菌液作用40 h后对ECV304细胞增殖的影响Tab 1 The effect of S.albicans supermatant and inactivated bacilli on cell proliferation of ECV304 after 40 h
2.2 S.albicans上清液加灭活菌混合液对ECV304细胞增殖作用的影响
不同浓度的S.albicans上清液加灭活菌混合液对ECV304细胞增殖作用的影响见表2,由表2可见,上清液和灭活菌的混合液作用细胞40 h后,随着稀释倍数的增大,促细胞增殖率逐渐降低。当上清液加灭活菌液(2∶1)作用细胞时,在较低稀释倍数(4×、16×)时,明显促细胞增殖,与对照组相比差异有显著性(P<0.05)。但当稀释倍数增大到64×时、上清液加灭活菌液(1∶2)的混合液作用后无明显变化(P>0.05)。

表2 上清液和灭活菌混合液作用40 h后对ECV304细胞增殖的影响Tab 2 The effect of S.albicans supermatant and inactivated bacillim ixture on cell proliferation of ECV304 after 40 h
2.3 S.albicans不同组分在不同培养时间下对ECV304细胞增殖作用的影响
S.albicans不同组分在不同培养时间下对ECV304细胞增殖作用的影响见图1。

图1 各组对ECV304细胞生长影响的曲线图Fig 1 The influence of each component on the growth of ECV304
由图1可见,用细胞计数法测定一定浓度的S. albicans不同组分分别作用ECV304细胞24、48、72h,随着时间增长,4×上清液和4×灭活菌液在不同时间较正常对照组均有不同程度的增殖。其中4×上清液在作用24、48 h时,与对照组相比有显著差异(P<0.05)。但72h时,与正常相比无明显变化(P>0.05);4×灭活菌液在作用48 h时对细胞有显著促进增殖的作用(P<0.05),而在24 h和72 h则无明显变化(P>0.05)。与对照组相比,16×上清和灭活菌的混合液在各个作用时间均对细胞无明显促进增殖的作用(P>0.05)。
2.4 S.albicans上清液和灭活菌液对ECV304细胞密度变化的影响
ECV304细胞经不同实验组处理40 h后(图2),4倍稀释的灭活菌液组(图2C)与对照组(图2A)细胞密度相当,4倍稀释的S.albicans上清液组(图2B)细胞密度明显高于4倍稀释的灭活菌液组与对照组。
2.5 S.albicans上清液和灭活菌液对ECV304细胞周期的影响
S.albicans的上清液和灭活菌液在作用ECV304细胞40 h后,各实验组细胞周期时相结果见表3。与对照组相比,上清液组G0/G1组细胞所占比例降低,S期、G2/M期所占百分比显著升高,反映细胞增殖活力指数PI增高,经统计学检测S期和G2/M期与对照组间差异有显著性(P<0.05)。而灭活菌组的细胞PI值与对照组相比无明显变化(P>0.05)。

图2 不同组作用40 h后ECV304细胞密度变化 倒置显微镜 ×100Fig 2 The changes in cell density of ECV304 for 40 hours by different groups inverted microscope ×100
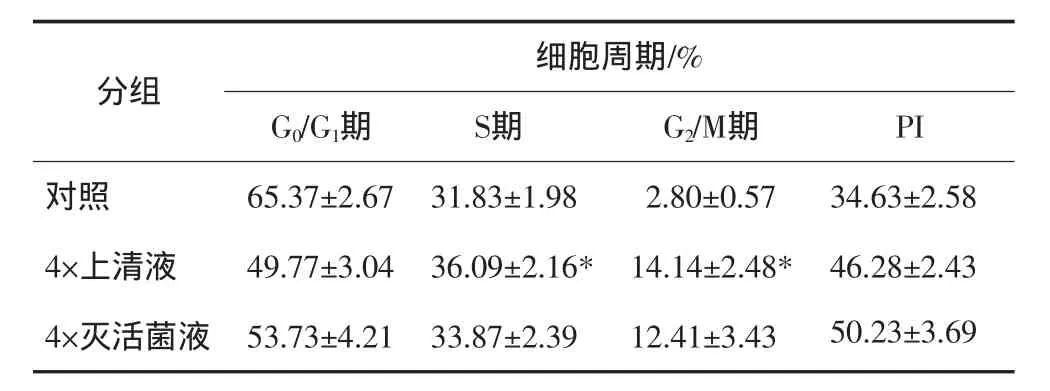
表3 上清液和灭活菌液对ECV304细胞细胞周期的影响Tab 3 The effect of S.albicans supernatant and inactivated bacteria on cell cycle distribution of ECV304
3 讨论
许多研究从体外实验和动物实验等方面阐述了S.albicans有很大的致病潜力,但S.albicans致病机制尚无定论[8]。在人和动物假丝酵母菌病中,尽管菌丝成分未侵入角质层以下,但在上皮内和上皮下的组织都发生了明显的改变[9]。病变区上皮较其他白斑厚,上皮深层增生显著,有丝分裂增加,常出现错角化。张凌等[10]采用流式细胞仪观察白假丝酵母菌对口腔上皮细胞的增殖及细胞周期的影响,发现菌丝型白假丝酵母菌可改变口腔上皮细胞周期。促增殖的因素可以是菌体本身,也可能是活菌产生的代谢产物所致。但对此方面深入的研究,国内尚无报道。本研究提取S.albicans上清液和灭活菌液分别作用细胞,采用MTT法进行横向比对(固定时间,不同作用浓度),细胞计数法进行纵向比对(固定浓度、不同作用时间),以及细胞密度观察,流式细胞术研究S. albicans代谢产物和菌体自身对细胞增殖作用的影响,以解析S.albicans的致病性。
研究结果显示:在固定时间,不同作用浓度的实验条件下,较高浓度上清液和灭活菌液可促使细胞增殖,上清液是主要因素。在固定浓度、不同作用时间的实验条件下,在实验早期(0~48 h),不同组分对细胞促增殖影响基本呈正相关,以上清液促增殖最为明显,在作用时间为48 h时,促细胞增长达到最大。一定浓度灭活菌液在作用48 h时,与对照相比,也有促增殖影响。延长培养时间至72 h,发现实验组和对照组均已无显著差异。可能的原因是随着时间的增长,上清液和灭活菌液促细胞增殖的活性物质发生了降解。也可能由于培养时间过长,细胞在6孔板有限的竞争空间不足有关。
倒置显微镜观察结果显示:ECV304细胞经不同实验组处理40 h后,上清液作用的细胞密度显著高于正常组和灭活菌液组,说明上清液对细胞增殖产生了影响。
细胞周期中G1期是DNA合成前期,主要包括RNA和DNA聚合酶的合成。S期是DNA合成期,G2/M期是DNA合成后期,主要进行RNA及蛋白质的合成。增殖旺盛的细胞处于S期和G2/M期比例较高。本研究结果显示:上清液组G0/G1期细胞所占比例降低,S期、G2/M期所占百分比显著升高,反映细胞增殖活力指数PI增高(P<0.05)。而灭活菌液组的细胞PI值与对照组相比无明显变化。说明当上清液、灭活菌液分别作用细胞时,上清液仍是主要促细胞增殖因素。
高岩等[11]对假丝酵母菌性白斑的研究表明:假丝酵母菌白斑的上皮较其他白斑的上皮厚,有丝分裂增多,DNA合成较多,细胞周期时间缩短;上皮层次紊乱,部分基底细胞极性消失,核大而浓染,细胞呈现多形性。提示白假丝酵母菌的慢性感染可导致细胞分裂活动增加,最终引起黏膜增生。这与本实验发现白假丝酵母菌上清液可诱导ECV304细胞增殖的结果相符合。
S.albicans黏附并成功定植在宿主黏膜表面是其致病的第一步,也是最关键的一步。近年来,关于S. albicans黏附、入侵黏膜内皮进而感染机体的机制性研究也开展了许多。Dalle等[12]研究发现:S.albicans入侵上皮细胞并感染机体不仅取决于S.albicans的形态和活力,也在于上皮细胞的形态和对微生物的敏感性。本实验的研究表明:白假丝酵母菌的代谢产物对内皮细胞增殖有诱导作用,但其机制还有待于进一步的研究。
[1] 陈晓,蒋文晖.念珠菌性白斑的研究概况[J].国外医学口腔医学分册,2004,31(2):138-143.
CHEN Xiao,JIANG Wen-hui.The reseach overview ofCandidaleukoplakia[J].Foreign Medical Sciences(Stomatology),2004,31(2):138-143.
[2] 魏昕,周学东,李秉琦,等.健康老年人口腔念珠菌与义齿修复的相关研究[J].华西口腔医学杂志,2006,24(1):39-41,47.
WEI Xin,ZHOU Xue-dong,LI Bing-qi,et al.Correlation of oralCandida spp.and denture-wearing in healthy elderly[J].West China J Stomatol,2006,24(1):39-41,47.
[3] 陈方淳,林梅.口腔念珠菌病患者口内菌株的检出和药敏性观察[J].华西口腔医学杂志,2007,25(1):37-41.
CHEN Fang-chun,LIN Mei.Oral isolates ofSaccharomycesin patients with oral fungal infection and their susceptibility to antifungal drugs[J].West China J Stomatol,2007,25(1):37-41.
[4] 李秉琦.口腔黏膜病学[M].北京:人民卫生出版社,2003:88-92.
LI Bing-qi.Oral mucosal diseases[M].Beijing:People’s Medical Publishing House,2003:88-92.
[5] 于世凤.口腔组织病理学[M].北京:人民卫生出版社,2003:194-197.
YU Shi-feng.Oral histopathology[M].Beijing:People’s Medical Publishing House,2003:194-197.
[6] Zhu W,Filler SG.Interactions ofCandida albicanswith epithelial cells[J].Cell Microbiol,2010,12(3):273-282.
[7] Silverman DJ,Bond SB.Infection of human vascular endothelial cells byRickettsia rickettsii[J].J Infect Dis,1984,149(2):201-206.
[8] Taweechaisupapong S,Choopan T,Singhara S,et al.In vitroinhi bitory effect ofStreblus asperleaf-extract on adhesion ofCandida albicansto human buccal epithelial cells[J].J Ethnopharmacol, 2005,96(1/2):221-226.
[9] 孙立新.白色念珠菌病的发病机制[J].山东医药,2001,41(17):58-59.
SUN Li-xin.Pathogenesis ofCandida albicans[J].Shandong Pharmaceutical,2001,41(17):58-59.
[10]张凌,唐晓琳,王兆元,等.白色念珠菌对口腔上皮细胞细胞周期的影响[J].实用口腔医学杂志,2007,23(1):111-113.
ZHANG Ling,TANG Xiao-lin,WANG Zhao-yuan,et al.Effect ofCandida albicanson cell cycle distribution of KB cells[J].J Pract Stomatol,2007,23(1):111-113.
[11] 高岩,刘鼎新.口腔念珠菌白斑的细胞增殖[J].中华口腔医学杂志,1993,28(1):35-37.
GAO Yan,LIU Ding-xin.Cell proliferation in oralCandidiasisleukoplakia[J].Chin J Stomatol,1993,28(1):35-37.
[12] Dalle F,Wächtler B,L’Ollivier C,et al.Cellular interactions ofCandida albicanswith human oral epithelial cells and enterocytes [J].Cell Microbiol,2010,12(2):248-271.
(本文编辑 汤亚玲)
A study on hum an umbilical vein endothelial cell ECV304 proliferation induced by Saccharomyces albicans
ZHANG Lin1,CHE Tuan-jie2,SHI Xiao-yan1,HE Xiang-yi1.(1.Dept.of Prosthodontics,School of Stomatology,Lanzhou University,Lanzhou730000,China;2.Cell Biology Institute,School of Life Science,Lanzhou University,Lanzhou730000,China)
ObjectiveTo study the effects ofSaccharomyces albicans(S.albicans)on the cell cycle distribution and proliferation of human umbilical vein endothelial cell ECV304 cellsin vitro.MethodsThe line of ECV304 culturedin vitrowere divided into four groups which were treated byS.albicanssupernatant,S.albicansinactivated bacilli,supernatant and inactivated bacillimixture,normal culture medium.The proliferous effect of ECV304 induced by supernatant, inactivated bacilli,supernatant and inactivated bacilli mixture using the methods of MTT,cell count,microscope and flow cytometry were conducted.Results In the condition of different times and different culture concentrations,ECV304 cells incubated with 4-fold dilutedS.albicanssupernatant for 48h increased the proliferation rate.The S and G2/M population of ECV304 cells increased after incubated withS.albicanssupernatant for 40h,which showed significant increasing cell proliferation index(PI)(P<0.05).The PI of the cells treated by inactivated bacilli showed no significant change(P>0.05).ConclusionS.albicanscould induce ECV304 cell proliferation which depends on the release of metabolic products ofS.albicans.
Saccharomyces albicans; proliferation; metabolic product; cell cycle
R 781.5
A
10.3969/j.issn.1000-1182.2011.03.018
1000-1182(2011)03-0289-05
2010-06-19;
2010-12-21
甘肃省科技攻关计划基金资助项目(0709TCYA053)
张琳(1983—),女,陕西人,硕士
何祥一,Tel:13038730686
