胶质细胞源性神经营养因子在自体静脉桥修复面神经缺损中促进神经再生的效应
2011-03-07唐杰戚孟春胡静
唐杰 戚孟春 胡静
(1.上海交通大学医学院附属第九人民医院 口腔颌面外科,上海 200011;2.河北联合大学 口腔系,唐山 063000;3.四川大学华西口腔医学院 口腔颌面外科学教研室,成都 610041)
胶质细胞源性神经营养因子在
自体静脉桥修复面神经缺损中促进神经再生的效应
唐杰1戚孟春2胡静3
(1.上海交通大学医学院附属第九人民医院 口腔颌面外科,上海 200011;2.河北联合大学 口腔系,唐山 063000;3.四川大学华西口腔医学院 口腔颌面外科学教研室,成都 610041)
目的 旨在研究胶质细胞源性神经营养因子(GDNF)在自体静脉桥修复面神经缺损中促进神经再生的效应。方法 选用36只成年雄性新西兰大白兔作为实验动物,切除双侧10mm长面神经颊支,制作面神经缺损动物模型。以同侧面后静脉作为神经再生管道,修复面神经缺损。静脉管腔内分别注入生理盐水(A组,n=16)或GDNF溶液(B组,n=16)。分别于手术后当时,及术后4、8、16周诱发面神经动作电位,评价神经功能。于术后4、8、16周每组分别随机处死6只动物,切取术区神经标本,行组织学与透射电镜观察。结果 手术后当时,2组实验动物均无动作电位产生;而术后4、8、16周,2组均有动作电位出现。除术后4周时动作电位波宽2组无显著差异外,B组动作电位的波幅在术后4周和8周均显著高于A组(P<0.01),而潜伏期显著短于A组(P<0.01),波宽在术后8周显著高于A组(P<0.01)。术后16周,除动作电位波幅B组显著高于A组外(P<0.01),波宽和潜伏期2组均无显著差异。形态学及透射电镜观察显示,B组再生神经有更多的成熟的有髓神经纤维,更早出现有活力的Schwann细胞。结论GDNF在自体静脉桥修复面神经缺损中可有效促进神经再生;GDNF复合自体静脉桥为临床面神经缺损修复提供了一个极具价值的途径。
面神经缺损; 自体静脉移植; 胶质细胞源性神经营养因子; 动作电位
外伤、肿瘤切除或医源性因素很容易造成面神经损伤与缺损;自体静脉作为桥接的管道用来修复神经缺损在临床及动物实验中已有较多报道[1-4]。尽管自体静脉作为神经再生的管道有其独特的优越性,但仍然不能早期很好地恢复神经的功能。有研究[5-7]表明:胶质细胞源性神经营养因子(glial cell derived neurotrophic factor,GDNF)对神经损伤修复具有重要作用,能够促进外周神经再生,逆转轴突切除引起的运动神经元的死亡,并能显著促进神经外胚层细胞的存活。其能否应用于面神经缺损的修复,目前国内外还缺乏研究报道。本研究旨在探索GDNF在自体静脉桥修复面神经缺损中促进神经再生的作用,以寻求早期恢复面神经功能的有效方法,为临床上面神经缺损修复提供实验依据。
1 材料和方法
1.1 动物模型及分组
选用36只健康成年雄性新西兰大白兔作为实验动物(四川大学华西实验动物中心提供),体重2.0~2.5 kg。经口外在双侧下颌骨下缘上方1.5 cm、眶下2 cm,从下颌骨后缘至鼻翼做平行于下颌骨下缘的切口,暴露面后静脉、嚼肌及腮腺组织。截取长约13~14mm的面后静脉,生理盐水冲洗管腔,室温下置于生理盐水中待用。自腮腺前缘向前分离面神经颊支,节段性切除10mm,保留分布于上唇方肌的主支,制作面神经局部缺损动物模型。同时,以同侧面后静脉作为修复神经缺损的管道,将静脉袖套式缝合于神经2个残端的神经外膜上,面神经残端插入静脉腔内约2mm[1]。实验动物随机分为A、B组(各18只):A组静脉管腔内注入0.4mL生理盐水;B组则注入0.4mL GDNF溶液(5 ng·mL-1)。缝合手术创口,常规动物饲养;术后实验动物肌注青霉素每天每只80万单位,连续肌注3 d,预防创口感染。
1.2 检测指标与方法
1.2.1 神经功能恢复评价 面神经功能恢复评价采用神经干动作电位法。测试设备包括刺激电极和计算机程控刺激器(中国BL-NewCentury生物机能实验软件)。测试前应用测试设备测定诱发正常面神经神经干动作电位的最适刺激强度。
将刺激电极与计算机程控刺激器的输出端相连,并将刺激电极置于修复再生的神经近心端,给予1.00 V的单脉冲电刺激(正常面神经的最适刺激强度);将记录电极置于修复再生神经的中份,记录电极引导的生物电输入计算机电位通道接口,经程控生物放大器放大,A/D转换,计算机处理显示动作电位。
分别于手术后当时、术后第4、8、16周,从2组动物中随机选择6只动物,全麻下解剖出术区面神经,测定再生神经的动作电位。观察指标有神经干动作电位的幅度、波宽和潜伏期。
1.2.2 形态学及超微结构检测 于手术后第4、8、16周,在测定神经干动作电位后,麻醉下处死实验动物(每组每一时间点6只动物),解剖分离再生的面神经,在距神经断端近中、远中各约4mm截取标本,标记近远中方向。左侧面神经标本用10%中性甲醛固定24~48 h,常规乙醇脱水、石蜡包埋;并制备5μm厚切片,Harris苏木精-伊红染色。
右侧面神经标本在再生神经正中,截取长2mm的标本,3%的戊二醛(pH7.3~7.4)4℃固定24 h,磷酸盐缓冲液冲洗。然后用1%四氧化饿(pH7.3~7.4)4℃二次固定2 h,磷酸盐缓冲液再次冲洗20min,梯度丙酮逐级脱水,Epon 812环氧树脂横向包埋。制备半薄切片(1μm),美兰染色,在光镜下任意选择15个40μm×40μm的视野,对再生的有髓神经纤维用OPTMAS 6.0-2计算机软件进行计数。再制备超薄切片,布于覆盖有Formvar膜的圆形铜载网上,醋酸铀和枸缘酸铅双重染色后透射电镜观察,了解神经微观结构及Schwann细胞再生情况。
1.2.3 统计学分析 计量资料用均数±标准差表示。应用SPSS 10.0软件对2组实验动物再生神经动作电位的参数和再生有髓神经纤维数目进行独立样本的t检验,比较2组的差异。P≤0.05表示差异具有统计学意义。
2 结果
2.1 面神经缺损动物模型
所有实验动物均很好地耐受了手术,术后创口无感染,并能自由取食。本研究成功建立了自体静脉修复兔面神经缺损的动物模型。
2.2 神经功能恢复评价
正常面神经最适刺激强度(1.00±0.11)V,神经动作电位波幅为(12.25±0.33)mV,波宽为9.06ms,潜伏期为(1.26±0.03)ms。2组实验动物在手术后当时(0周),给予电刺激后均无动作电位产生;而术后第4、8、16周,均出现动作电位,但动作电位参数二者有明显差异(图1,表1)。
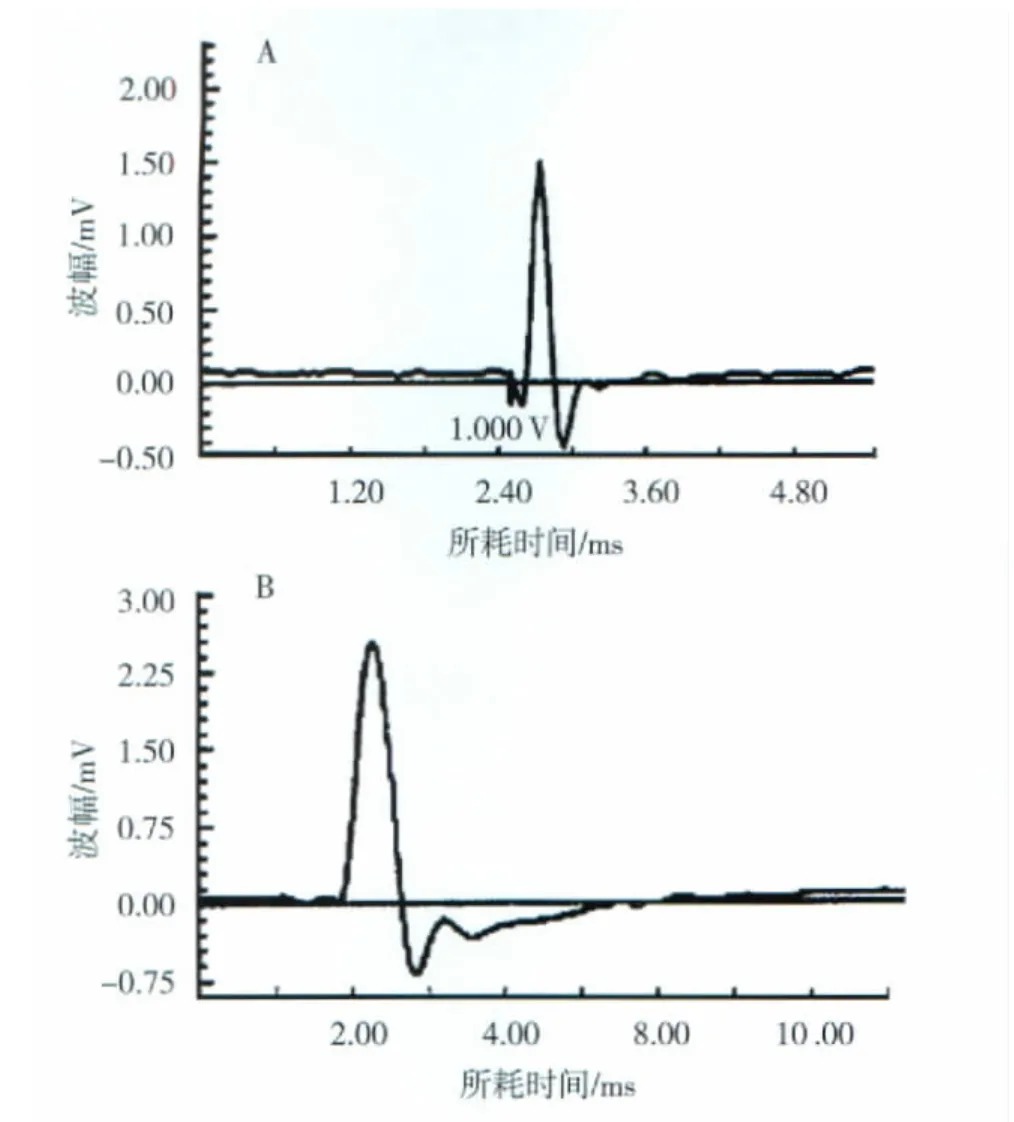
图1 术后4周A组(A)和B组(B)再生神经动作电位Fig 1 Action potential of group A(A)and group B(B)4 weeks after operation
手术后4周,2组再生神经动作电位的波幅和潜伏期比较均有统计学差异(P<0.01),A组波幅显著小于B组,而潜伏期长于B组。波宽2组无显著差异(P>0.05)。手术后8周,2组神经动作电位的波幅、波宽和潜伏期比较均有统计学差异(P<0.01),A组波幅、波宽显著小于B组,而潜伏期长于B组。手术后16周,2组神经动作电位除波幅A组显著小于B组外(P<0.01),波宽和潜伏期二组比较无统计学差异。手术后随着时间的延长,2组神经动作电位的波宽和波幅逐渐增加,而潜伏期逐渐缩短,说明神经功能趋于正常;但是直到术后16周,2组面神经动作电位3项参数与正常值比较均有统计学差异(P<0.01)。

表1 不同时间点再生面神经动作电位比较Tab 1 Analysis of action potential of regenerated facial nerve in differentiation time points
2.3 形态学及超微结构观察
术后4、8周2组再生神经纤维经常形态见图2。

图2 术后4、8周2组再生神经纤维Fig 2 Regenerated myeliated nerve fibers of two groups after 4 and 8 weeks of operation
手术后4周,2组静脉桥管内可见再生神经纤维形成,成束排列,主要为无髓神经纤维,有髓神经纤维较少,且髓鞘壁较薄;神经束间可见新生血管,并可见大量的胶原纤维,鞘壁Schwann细胞增生活跃,核大,异染色质分布不均匀(图2A,2D)。再生神经只占据静脉管腔的一部分,且神经纤维数目A组明显少于B组。手术后8周,2组再生神经纤维数目均明显增加(表2)。2组比较,A组神经纤维较稀疏,有髓神经数目较少,胶原纤维较多;而B组再生神经纤维密集成束,有髓神经纤维较多,胶原纤维较少;有髓神经纤维髓鞘壁较厚(图2B,2C)。术后16周,2组新生神经纤维数目继续增加,有髓神经纤维数目在新生轴索中占绝对多数,髓鞘壁进一步增厚,少见活跃的Schwann细胞;但B组神经纤维数目仍明显多于A组。
表2 2组再生有髓神经纤维数比较Tab 2 Com paration of new ly regenerated m yeliated nerve fibers between two groups ±s

表2 2组再生有髓神经纤维数比较Tab 2 Com paration of new ly regenerated m yeliated nerve fibers between two groups ±s
注:△2组比较,P<0.01。
组别 术后4周△ 术后8周△ 术后16周A 728±36 1 974±86 4 340±179 B 1 623±141 3 012±77 4 697±291
3 讨论
外伤、肿瘤切除或医源性因素等很容易造成面神经缺损。面神经缺损的再生修复受到许多因素的影响。Longo等[8]认为神经再生的成功与否有赖于是否存在适宜神经再生的生理微环境。该适宜的生理微环境包括具有活力的Schwann细胞、各种神经生长因子(nerve growth factors,NGF)、营养因子(nutrient promoting factor,NPF)的参与、局部良好的血液供应和供神经生长的空间神经导管系统。可以作为神经再生导管系统的材料有很多,多采用自体导管系统和合成生物材料。后者有硅胶管、胶原管、聚四氟乙烯管等[9-11]。自体导管系统多为自体动、静脉[1-4]。
自体静脉作为神经再生导管有其独特的优越性:不会引起免疫反应和供区功能障碍、容易获取、不需要开辟第二个手术区;管壁薄,有一定的通透性,既能阻挡周围结缔组织的长入,又有利于营养物质穿透静脉壁。Levine等[12]的研究还发现静脉壁上有神经生长因子的表达,在神经生长过程中可能会起到促进神经生长的作用。临床及实验研究[1-4]均证明:自体静脉可用以修复外周神经缺损,使神经功能达到一定程度的恢复。但是,自体静脉修复神经缺损是缓慢的过程,而早期神经功能的恢复不仅可尽快行使相应的功能,而且可以避免因为神经功能缺失而引起的肌肉萎缩。因此,寻求早期促进神经功能恢复的方法仍然是神经再生修复领域研究的重点。
GDNF对神经再生有重要促进作用。Mograbi等[7]研究表明:GDNF可通过提高Akt活性对抗ERK途径引起的神经外胚层细胞凋亡。GDNF基因转染的Schwann细胞可提高运动神经元存活,并有效促进外周神经再生[5]。GDNF还可通过作用于Schwann细胞内的信号通路,促进其迁移,并在有髓神经形成早期发挥作用[13]。
本研究在采用自体面静脉桥修复面神经缺损的基础上,应用GDNF来促进神经的再生修复。实验结果表明,在手术后4周,应用GDNF组面神经动作电位的波幅显著高于对照组,而潜伏期显著小于对照组;说明实验组面神经功能优于对照组,GDNF发挥了促进面神经再生的作用。而GDNF的作用在手术后8周更为明显,实验组神经动作电位的波幅、波宽均显著高于对照;而潜伏期则显著小于对照。到手术后16周,GDNF的作用明显减弱,除实验组波幅显著高于对照组外,波宽及潜伏期2组均无显著差异。上述结果说明,GDNF具有在早期(4、8周)明显促进面神经再生的作用,其作用在术后8周达到最高;而随着时间的延长,GDNF的作用逐渐消退。形态学及超微结构观察也表明,GDNF处理组有髓神经数目、Schwann细胞活跃程度及新生血管情况均明显优于对照组。进一步证实了GDNF促进神经再生的效应。
需要指出的是,在本研究中虽然GDNF可在自体静脉桥修复面神经缺损中有效促进神经再生,一定程度上在早期恢复了面神经功能;但GDNF促进面神经再生的作用仍有限,直到术后16周,GDNF组再生神经功能尚未恢复正常,这可能与以下2个因素有关:首先,GDNF为胶质细胞源性的神经生长因子,需要作用于神经节细胞才可以起到促进神经生长的作用[6],本研究是把GDNF注入静脉的桥管内,GDNF可能需要沿近心端神经轴索上溯至神经节细胞才能对其产生修复作用。因此表现为在最早期促进神经修复的作用较弱。其次,本实验为一次性给药,经过长时间机体的作用,GDNF会被消耗或崩解,这可能是后期GDNF作用有限的原因。如果采用在距离神经节细胞较近的部位比如茎乳孔给药,或者采用持续或多次给药的方法可能会收到更好的效果。
本研究在采用自体面静脉桥修复面神经缺损的基础上,应用GDNF有效促进了面神经缺损的再生,在一定程度上促进了神经功能的早期修复。该方法对临床面神经缺损的修复具有重要的借鉴意义。
[1] Tang J,Wang XM,Hu J,et al.Autogenous standard versus inside-out vein graft to repair facial nerve in rabbits[J].Chin J Traumatol,2008,11(2):104-109.
[2] Acar M,Karacalar A,Ayyildiz M,et al.The effect of autogenous vein grafts on nerve repair with size discrepancy in rats:An electrophysiological and stereological analysis[J].Brain Res, 2008,1198:171-181.
[3] Pogrel MA,Magben A.The use of autogenous vein grafts for inferior alveolar and lingual nerve reconstruction[J].J Oral Maxillofac Surg,2001,59(9):985-988.
[4] Berenholz L,Segal S,Gilad VH,et al.Agmatine treatment and vein graft reconstruction enhance recovery after experimental facial nerve injury[J].J Peripher Nerv Syst,2005,10(3):319-328.
[5] Li Q,Ping P,Jiang H,et al.Nerve conduit filled with GDNF gene-modified Schwann cells enhances regeneration of the peripheral nerve[J].Microsurgery,2006,26(2):116-121.
[6] Barati S,Hurtado PR,Zhang SH,et al.GDNF gene delivery via the p75(NTR)receptor rescues injured motor neurons[J].Exp Neurol,2006,202(1):179-188.
[7] Mograbi B,Bocciardi R,Bourget I,et al.Glial cell line-derived neurotrophic factor-stimulated phosphatidylinositol 3-kinase and Akt activities exert opposing effects on the ERK pathway:Importance for the rescue of neuroectodermic cells[J].J Biol Chem, 2001,276(48):45307-45319.
[8] Longo FM,Hayman EG,Davis GE,et al.Neurite-promoting factors and extracellular matrix components accumulating in vivo within nerve regeneration chambers[J].Brain Res,1984,309(1):105-117.
[9] Bailey SB,Eichler ME,Villadiego A,et al.The influence of fibronectin and laminin during Schwann cell migration and peripheral nerve regeneration through silicon chambers[J].J Neurocytol,1993,22(3):176-184.
[10]Epply BL,Delfino JJ.Collagen tube repair of the mandibular nerve:A preliminary investigation in the rat[J].J Oral Maxillofac Surg,1988,46(1):41-47.
[11] Vasconclos BC,Gay-Escoda C.Facial nerve repair with expanded polytetrafluoroethylene and collagen conduits:An experimental study in the rabbit[J].J Oral Maxillofac Surg,2000,58(4):1257-1262.
[12] Levine MH,Yates KE,Kaban LB.Nerve growth factors is expressed in rat femoral vein[J].J Oral Maxillofac Surg,2002,60(1):729-734.
[13] Iwase T,Jung CG,Bae HJ,et al.Glial cell line-derived neurotrophic factor-induced signaling in Schwann cells[J].Neurochem, 2005,94(6):1488-1499.
(本文编辑 汤亚玲)
Effect of glial cell derived neurotrophic factor on regeneration of facial nerve defects by autogenous vein conduit
TANG Jie1,QI Meng-chun2,HU Jing3.(1.Dept.of Oral and Maxillofacial Surgery,The Ninth People’s Hospital,Shanghai Jiao Tong University School of Medicine,Shanghai200011,China;2.Dept.of Stomatology, Hebei United University,Tangshan063000,China;3.Dept.of Oral and Maxillofacial Surgery,West China College of Stomatology,Sichuan University,Chengdu610041,China)
ObjectiveTo study the effects of glial cell derived neurotrophic factor(GDNF)on regeneration of facial nerve defects by autogenous facial vein conduit.MethodsThirty-six rabbits were used in this study and 10 mm-length facial nerve defects were made on both sides of all animals.The nerve gaps were bridged using autoge-nous posterior facial vein graft of the same side.The animals
injection of either saline(group A,n= 16)or GDNF(group B,n=16)into the veins.Nerve function was evaluated by evoking nerve action potential immediately after operation and 4,8 and 16 weeks after operation.Regenerated nerve samples were harvested at 4,8, and 16 weeks after operation and processed for histology and transmitting electron microscopic examination(TEM). Results Action potential did not exist immediately after operation but it was evoked at 4,8,and 16 weeks in both groups.At 4 and 8 weeks after operation,the amplitude and width of action potential were significantly higher in group B than group A(P<0.01),except wave width at 4 weeks,which showed no significant differences,while the latency period was significantly shorter in group B than that in group A(P<0.01).At 16 weeks,action potential was similar between two groups,except wave amptitude,which was higher in group B than group A(P<0.01).Morphologic and TEMexaminations showed more matured myelinated nerve fibers and active Schwann’s cells in group B when compared group A during the whole regeneration process.ConclusionGDNF can promote nerve regeneration at early stage during reconstruction of facial nerve defects by autogenous faical vein conduit and combination of GDNF and autogenous vein graft provides a valuable method for clinical reconstruction of facial nerve defects.
facial nerve defect; autogenous vein graft; glial cell derived neurotrophic factor; action potential
R 622
A
10.3969/j.issn.1000-1182.2011.01.021
1000-1182(2011)01-0087-05
2010-04-10;
2010-06-24
四川省科技攻关基金资助项目(05SG022-019-3)
唐杰(1973—),女,河南人,副主任医师,博士
胡静,Tel:028-85502339
