益生菌对异育银鲫生长和饲料消化率及RNA/DNA的影响
2011-03-07陈勇周洪琪
陈勇,周洪琪
(1.南京晓庄学院生物化工与环境工程学院,江苏 南京 210017;2.上海海洋大学 水产与生命学院,上海 201306)
益生菌对鱼类生长有明显的促进作用[1–2]。对益生菌促进鱼类生长机理的研究通常是从维持肠道微生态平衡[3]、调节养殖水体[4]和刺激免疫系统[5]等方面进行的。笔者从益生菌对鱼类饲料消化率及对鱼体蛋白质合成能力影响的角度对其促进鱼类生长的机理进行研究。
1 材料与方法
1.1 材 料
二龄异育银鲫鱼种购自上海市南汇水产养殖场,体重为(78.31±2.15) g,无病无伤。益生菌由复旦大学遗传学研究所提供,由枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)和嗜热球状芽孢杆菌(Bacillus thermosphaericus)等混合而成。
基础饲料的主要原料为鱼粉、豆粕、菜籽粕、次粉、玉米粉。在基础饲料中添加啤酒酵母、植物油和复合添加剂制得试验饲料。
1.2 试验设计
分别将基础饲料的主要原料粉碎,研磨至过孔径0.246 mm筛上物低于20%。将鱼粉、豆粕、菜籽粕、次粉、玉米粉、啤酒酵母、植物油、复合添加剂按10.0%、20.0%、20.0%、25.0%、17.5%、5.0%、1.0%、1.5%的比例混合,采用逐级放大法使其混合均匀,用小型平模制粒机制成粒径为 2.0~3.0 mm的硬颗粒饲料。饲料加工过程中温度设为65~70 ℃,持续时间约1 min。风干后于4 ℃保存备用。基础饲料的粗蛋白、粗脂肪、粗灰分含量分别为31.12%、6.52%和 8.48%。在基础饲料中分别添加 0.05%、0.20%、0.80%的益生菌作为试验组,每组3个重复。以基础饲料组为对照。
试验在上海水产大学南汇养殖场进行。将试验鱼随机分到12个5.0 m×2.0 m×1.0 m的水泥池中,有效水位0.6 m,每池50尾。先用基础饲料驯化1周,待鱼摄食正常后开始试验,每天分3次(8:30、12:30、16:30)按体重的3%投喂每种饲料,并根据水温、水质、摄食情况调整,尽量让投喂的饲料全部吃完不留残饵。每天充气12 h,不定期吸污,换水。饲养试验为时64 d。试验期间水温为21~35 ℃,DO含量高于5 mg/L,NH3–N含量低于0.3 mg/L。各池水质基本一致。
在基础饲料和试验饲料中分别添加 0.5%的Cr2O3用作消化率测定试验饲料。经过64 d的饲养试验后,分别从各饲料组随机取15尾试验鱼(分3次,每次5尾)放入另外4个大水族箱中,充气,不定期换水。先用不含Cr2O3的基础饲料饲养,待鱼摄食正常后改用含Cr2O3的基础饲料驯化,待试验鱼适应后正式开始试验。分别投喂含Cr2O3的试验饲料和基础饲料。投喂量同饲养试验,尽量让投喂的饲料全部吃完不留残饵。投喂含Cr2O3的试验饲料和基础饲料5 d 后,用虹吸法分别收集刚刚排出的、形状完整的粪便,放滤纸上吸干水分,70 ℃烘干,多次收集样本到足够分析使用的量待测。
1.3 测定指标及方法
在开始饲养试验及试验结束时,分别让试验鱼饥饿1 d后称重、计数,于其中取20尾鱼量体长。每饲料组取10尾鱼的肌肉待测。水分含量、粗蛋白含量、粗脂肪含量、灰分含量分别用常压干燥法、凯氏定氮法(GB/T6432—1994)、索氏抽提法(GB/ T6433—1994)、550℃马福炉灰化灼烧法(GB/ T6438—1992)测定。蛋白质、脂肪和灰分均为干物质中的含量。用Cr2O3作为指示剂,用间接法测定饲料(表观)消化率。用湿式灰化比色法测定饲料和粪便中的Cr2O3含量。饲养试验结束后,每个饲料组随机选取10尾鱼,分别取每尾鱼的白肌0.5~ 1.0 g,参照司亚东等[6]的方法测定白肌的RNA和DNA含量。
相关指标的计算公式:
特定增重率=(ln池鱼终重-ln池鱼初重)/饲养时间。
特定增长率=(ln池鱼终长-ln池鱼初长)/饲养时间。
饲料系数=试验期间池鱼投饲量/(池鱼终重-池鱼初重)。
蛋白质效率=体重增加量/(投饲量×饲料蛋白质含量)。
饲料总营养物质的消化率=l-(B/B’);某营养物质消化率=l-(A’/A)×(B/B’),其中:A、A’分别为饲料和粪便中某营养物质的含量;B、B’分别为饲料和粪便中Cr2O3的含量。
1.4 数据分析方法
用 ANOVA对试验数据进行方差分析,用Duncan’s进行多重比较。
2 结果与分析
2.1 益生菌对异育银鲫生长的影响
2.1.1 对异育银鲫特定生长率、饲料系数、蛋白质效率及成活率的影响
各饲料组异育银鲫的成活率均为100%。由表1可见,饲料中添加0.20%、0.80%益生菌对异育银鲫的特定生长率、饲料系数和蛋白质效率有显著影响(表1):饲料中添加0.20%和0.80%益生菌均显著提高了异育银鲫的特定生长率和蛋白质效率,显著降低了异育银鲫的饲料系数,但两组间的差异不显著。
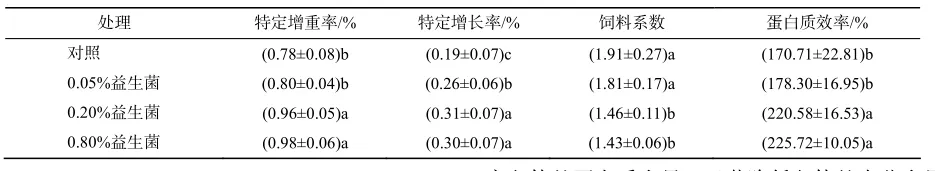
表1 不同处理异育银鲫的特定生长率、饲料系数和蛋白质效率Table 1 Effect of probiotics on specific growth rate, feed coefficient and protein efficiency rate of gibel carp
2.1.2 益生菌对异育银鲫肌肉成分的影响
益生菌对异育银鲫肌肉营养成分有一定影响(表2):与对照比较,添加0.80%益生菌可以显著提高鱼体的蛋白质含量,显著降低鱼体的水分含量;添加0.05%益生菌可以显著提高鱼体的灰分含量;添加益生菌对鱼体脂肪含量影响不显著。

表2 不同处理异育银鲫的肌肉成分Table 2 Effect of probiotics on nutrient ingredients in the muscle of gibel carp %
2.2 益生菌对异育银鲫饲料消化率及 RNA/DNA的影响
由表3可见,与对照比较,饲料中添加益生菌可显著提高异育银鲫对饲料蛋白质的消化率。0.05%益生菌组与0.20%益生菌组差异显著,0.20%益生菌组和0.80%益生菌组差异不显著;添加少量益生菌(0.05%益生菌组)对饲料总消化率和脂肪消化率影响不显著,但添加量为0.20%、0.80%时,对饲料总消化率和脂肪消化率的影响显著,且0.20%益生菌组与 0.80%益生菌组的脂肪消化率差异显著,0.05%益生菌组与0.20%益生菌组的总消化率差异显著。
添加少量益生菌(0.05%益生菌组)对异育银鲫白肌RNA/DNA的影响不显著,当添加量达0.20%及以上时,可显著提高异育银鲫RNA/DNA,且0.20%益生菌组与0.80%益生菌组的RNA/DNA差异显著。

表3 不同处理异育银鲫的饲料营养成分消化率及白肌RNA/DNATable 3 Effect of probiotics on digestibilities and RNA/ DNA in white muscle of Gibel carp %
3 结论与讨论
以投喂基础饲料为对照,在基础饲料中分别添加0.05%、0.20%和0.80%的益生菌制备试验饲料,饲养初重(78.31±2.15) g的异育银鲫64 d,测定其特定生长率、饲料系数、蛋白质效率、成活率、异育银鲫肌肉营养成分及白肌 RNA/DNA,并以 Cr2O3为指示剂,采用间接法测定饲料消化率。结果表明,与对照相比,0.20%和0.80%益生菌添加组异育银鲫的特定增重率和特定增长率均显著提高(P<0.05),饲料系数显著降低(P<0.05),蛋白质效率显著提高(P<0.05),饲料的总消化率、饲料蛋白质消化率、脂肪消化率和异育银鲫白肌RNA/DNA均显著提高(P<0.05),除脂肪消化率和异育银鲫白肌RNA/DNA外,以上指标0.20%和0.80%益生菌添加组间的差异均不显著;添加0.80%的益生菌可以显著提高鱼体的蛋白质含量(P<0.05)。考虑到成本因素,在饲料中添加0.20%的益生菌较为适宜。
本试验中对照组异育银鲫对饲料蛋白质的消化率略低于沈晓民等[7]的研究结果,这可能是因本试验饲料的鱼粉用量少,鱼对植物性蛋白的消化率比对鱼粉低所至。
添加适量的益生菌可以提高异育银鲫对饲料蛋白质消化率、饲料脂肪消化率及饲料总消化率的原因可能是本试验中的益生菌具有耐高温和产蛋白酶、淀粉酶的特性,也可能是益生菌提高了试验鱼内源性蛋白酶的活性[1,8],益生菌与肠道有益菌增殖后可以产生脂肪酶,有助于脂肪的消化[9]。饲料中添加益生菌增加了试验鱼肠道消化酶的含量,促进了异育银鲫对饲料营养物质的吸收。对于同样的营养物质,消化吸收率高,鱼体获得的营养物质就多,可利用和贮留的营养物质就多,生长就快。这与异育银鲫生长方面的研究结果一致。
鱼类的生长主要是蛋白质的积累。蛋白质积累是通过蛋白质生物合成实现的。蛋白质生物合成是RNA以DNA为模板,连接氨基酸完成的。当鱼体生长速率加快,即鱼体蛋白质合成速率加快时,鱼体组织中的RNA含量就会增加,即蛋白质的合成取决于RNA的量变。因为单位组织样品中细胞数量影响RNA和DNA的含量,而RNA/DNA能够准确反映蛋白质的合成速率,可以作为衡量鱼类生长速率的指标[10–13]。白肌是表达鱼体生长最有代表性的组织[14]。本试验中异育银鲫白肌RNA/DNA的变化与益生菌促进鱼体生长的结果一致,说明益生菌提高了鱼体蛋白质的合成能力,从而使鱼体得到了更多的蛋白质积累。
[1] 华雪铭,周洪琪,张宇峰.饲料中添加壳聚糖和益生菌对暗纹东方纯幼鱼生长及部分消化酶活性的影响[J].水生生物学报,2005,29(3):301–305.
[2] 华雪铭,周洪琪,邱小琮,等.饲料中添加芽孢杆菌和硒酵母对异育银鲫的生长及抗病力的影响[J].水产学报,2001,25(5):448–453.
[3] 陈勇,黄权,李月红,等.溢康素对鲤鱼肠道菌群生长的影响[J].北华大学学报:自然科学版 ,2001(5):442–443.
[4] 齐欣,魏雪生,陈颖,等.益生菌对彭泽鲫生长性能及水体环境的影响[J].中国饲料,2007(17):27–29.
[5] 刘克琳,何明清.益生菌对鲤鱼免疫功能影响的研究[J].饲料工业,2000,21(6):24–25.
[6] 司亚东,金有坤,周洪琪,等.鲤鱼白肌中RNA/DNA值与生长的关系[J].上海水产大学学报,1992,12(3):159–167.
[7] 沈晓民,刘永发,唐瑞瑛,等.异育银鲫的蛋白质消化率研究[J].水产学报,1995,19(1):52–58.
[8] 刘小刚,周洪琪,华雪铭,等.微生态制剂对异育银鲫消化酶活性的影响[J].水产学报,2002,26(5):448–452.
[9] Refstie S,Sahlström S,Bråthen E,et al. Lactic acid fermentation eliminates indigestible carbohydrates and antinutritional factors in soybean meal forAtlantic salmon(Salmo salar) [J].Aquac,2005,244(1):1–10.
[10] Pelletier D,Blier P U,Lambert Y,et al.Deviation from the general relationship between RNA concentration and growth rate in fish[J].J Fish Biol,1995,47,920–922.
[11] Clemmesen C.The effect of food availability,age or size on the RNA/DNA ratios of individually measured herring larvae:Laboratory calibration[J].Mar Biol,1994,118,377–382.
[12] 梁萌青,王成刚,陈超,等.几种添加剂对红鳍东方鲀的促生长效果与RNA/DNA关系[J].海洋水产研究,2001,22(2):38–41.
[13] Gwak W S,Tsusaki T,Tanaka M.Nutritional condition as evaluated by RNA/DNA ratios of hatchery-reared Japanese flounder from hatch to release[J].Aquac,2003,219(1/4):503–514.
[14] Smith T R,Buckley L J.RNA–DNA ratio in scales from juveniles cod provides a nonlethal measure of feeding condition[J].Trans Am Fish Soc,2003,132(1):9–17.
