猪繁殖与呼吸障碍综合征病毒河南09分离株ORF5基因的克隆及结构分析
2011-03-07杨春华韩志涛胡慧钟毅王冬祝建新
杨春华,韩志涛,胡慧,钟毅,王冬,祝建新*
(1.江西出入境检验检疫局 检验检疫综合技术中心,江西 南昌 330002; 2.河南农业大学 牧医工程学院,河南 郑州 450002)
猪繁殖与呼吸障碍综合征(porcine reproductive and respiratory syndrome, PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种高度接触性传染病[1]。PRRSV包括2个基因亚型,分别为以ATCC VR-2332株为代表的美洲型和以LV株为代表的欧洲型。中国的多是美洲型,且存在变异株[2-3]。该病 1987年在美国首次报道,现已遍及世界各地,严重危害世界养猪业。目前该病毒已成为中国猪病的主要病原之一[4-6]。2006年以来由PRRSV变异株引起的“高热病”给中国养猪业造成了巨大的经济损失[7-8]。PRRS与 PCV-2、CSFV、PRV等病毒的混合感染也时有发生,使该病变得更为复杂[2]。PRRSV基因组大小约为15 kb,包括9个开放阅读框架,可编码6种结构蛋白和2种非结构蛋白,其中ORF5编码的糖基化囊膜蛋白(又称gp5或E蛋白)是该病毒主要的结构蛋白,也是一种多功能性蛋白[9]。不同国家和地区分离株的ORF5基因差异较大,已有利用其序列差异性来研究PRRSV遗传进化的报道[10-13]。不同PRRSV分离株在毒力、基因序列和抗原性等方面都存在较大差异,找出各株之间的关系和变异规律,已成为当前研制PRRSV疫苗和了解PRRSV致病机理及流行趋势的关键。2009年,河南省北部暴发了以“蓝耳病”症状为特征的疫情。为探寻引起该病的病原,从河南省漯河市某猪场采集了临床诊断为感染PRRSV的病料,对PRRSV的ORF5基因进行克隆、序列和结构分析,并与往年分离提取的几种分离株的核苷酸序列进行比对,在GeneBank查询并下载了河北、山东、山西、安徽、黑龙江等省和典型美洲型的19个ORF5序列,利用DNASTAR软件对以上序列进行了比较分析。
1 材料与方法
1.1 病料采集及预处理
病料采自河南省漯河市某猪场,临床检测初步诊断为PRRSV感染。无菌条件下取病死仔猪的淋巴结、肺脏、脾脏等,剪碎,加入适量的PBS液研磨,将研磨后的样品移入1.5 mL的离心管中,-20℃保存,备用。
1.2 主要试剂及仪器
pGEM-T Easy载体、反转录试剂盒和T4DNA连接酶均购自Promega公司;限制性内切酶、PCR相关试剂、DNA Marker、异丙基-β-D-硫代半乳糖苷(IPTG)、5-溴-4-氯-3-吲哚半乳糖苷(X-gal)购自大连宝生物公司,DNA凝胶回收试剂盒购自杭州维特洁生物技术有限公司,质粒提取试剂盒购自北京博大泰克生物公司。PCR 仪(PTC 200)为美国MJ公司产品。其他常规试剂及仪器均由河南省动物性食品安全实验室提供。
1.3 引物的设计与合成
根据 GenBank发表的PRRSV的ORF5基因序列,应用 Primer 5.0软件设计1对引物。上游引物P1:5′-CCGTTGTAGCTTGTCTTT-3′;下游引物P2:5′-GGCGTGTAGATACTGGAA-3′。引物由上海生工生物工程技术服务有限公司合成。
1.4 疑似PRRS病料RNA的提取
用Invitrogen公司的TRIzol试剂,按其说明书和文献[14]的方法提取病毒总 RNA。提取的 RNA用20 µL无RNase水溶解沉淀,-20 ℃保存,备用。
1.5 模板cDNA的制备和PCR
以提取的RNA为模板,按照反转录说明书进行反转录。将反转录后的cDNA 置于-20 ℃保存。PCR反应体系(50 µL):10×PCR缓冲液5 µL,MgCl2(25 mmol/µL)4 µL,dNTPs 3 µL (25 mmol/ µL),Taq酶1 U,引物为1 µL(50 pmol/µL),反转录cDNA液5 µL。最后用双蒸水补至50 µL,将EP管置PCR仪,按如下程序进行扩增:94 ℃预变性5 min,98 ℃变性50 s,55 ℃退火50 s,72 ℃延伸100 s,35个循环,72 ℃延伸10 min。反应结束后,取5 µL扩增产物琼脂糖凝胶电泳检测。
1.6 目的基因的克隆
以合成的cDNA为模板,用合成的上、下游引物扩增目的片段,扩增产物经电泳鉴定后,用胶回收试剂盒回收目的片段,然后将目的片段与pGEM-T Easy载体连接,将其转化DH5α感受态细胞[12],挑取疑似阳性菌落进行培养,提取重组质粒,对重组质粒进行PCR和酶切鉴定。
1.7 核酸序列测定及分析
将鉴定正确的重组菌液送大连宝生物公司测序,并利用 DNAstar软件,将所测核酸序列与GenBank上登录的相应序列进行比较分析。
1.8 GP5蛋白结构分析
用ANTHEPROT对河南09分离株HN-09株和美洲型AF494042株编码的GP5蛋白质进行分析。
2 结果与分析
2.1 PRRSV的ORF5全基因RT-PCR扩增结果
将提取的总RNA作为模板,用设计合成的引物进行RT-PCR扩增。经1%琼脂糖凝胶电泳检测,均获得了约721 bp的扩增产物(图1),与预期扩增的DNA片段大小相符。

图 1 PRRSV的ORF5基因扩增结果Fig.1 PCR result of ORF5 gene of PRRSV
2.2 ORF5基因的克隆与酶切鉴定
将纯化的PCR产物与pGEM-T Easy载体连接、转化后,筛选阳性重组菌,提取质粒[13]。以该质粒为模板,以P1、P2为引物进行PCR扩增,得到约721 bp的目的片段(图2);对重组质粒进行酶切鉴定,所得片段与预期片段的大小相符(图3),表明目的基因已插入到载体中。
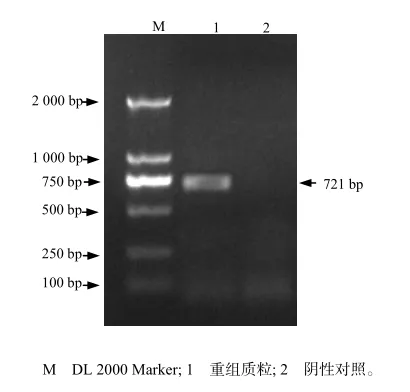
图 2 重组质粒的PCR扩增结果Fig.2 PCR result of recombinant plasmid
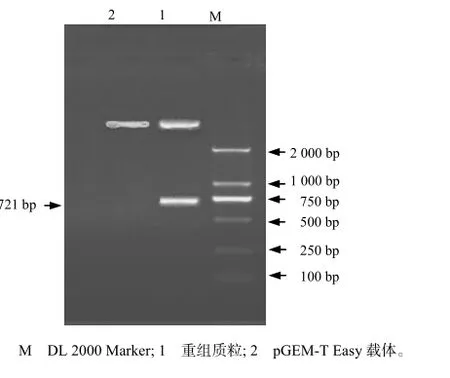
图 3 重组质粒的酶切鉴定结果Fig.3 Result of recombinant plasmid by restriction endonclease
7
2.3 PRRSV的ORF5基因同源性分析
本试验扩增出了PRRSV的ORF5基因,片段长度为721 bp,命名为HN-09,其中,603 bp的碱基编码GP5蛋白序列。由表1可见,该分离株与山西分离株的同源性最高,为99.2%,它们之间的亲缘关系较近。与典型美洲型AF494042株核苷酸的同源性为 93.5%;与山东分离株 GU977232和FJ765744的同源性分别为98.8%和98.7%,遗传关系也较近;与河南2004年2个分离株的同源性较低,均为88.7%,遗传关系较远。核苷酸进化树(图4)也反映出了与此相同的结果。

表1 PRRSV不同分离株ORF5的核苷酸序列同源性Table 1 Homology analysis of ORF5 nucleotide sequence of PRRSV of different strains

图4 不同地区分离株ORF5核苷酸序列的系统进化树Fig.4 Phylogentic tree of ORF5 nucleotide sequence of strains from different regions
2.4 PRRSV的ORF5基因系统进化树的构建
图4中,各分离株均属于美洲型的变异毒株,其中,HN-09株与山西株 FJ895329及山东株FJ765744、GU977232的同源性最高,处于进化树的同一个分支上;与河南省 2004年分离的毒株的亲缘关系最远,处于不同的亚型。
2.5 ORF5编码蛋白质的组成分析
经分析,HN-09株的GP5蛋白的相对分子质量大约为2.2×104,与美洲型相比变化不大。不同氨基酸的含量有所变化,其中含量变化较小的氨基酸有Leu、Gys、Asp、Lys、Pro、Trp;含量增加的有Ala、His、Ile、Asn、Gln、Tyr;含量下降的有Glu、Phe、Gly、Arg、Ser、Thr、Val。HN-09株中亮氨酸(Leu)含量最高达14%,其次是Val和Ala,含量分别为9.0%和8.5%。中性氨基酸中Cys、Ser、Thr的含量较高,为 5%~7.5%,酸性氨基酸(Asp、Glu)和碱性氨基酸(His、Lys)的含量相当,为3%左右。
2.6 ORF5编码蛋白质的二级结构分析
蛋白质的二级结构包括α螺旋、β折叠、β转角和无规则卷曲。由于HN-09株中碱基的突变,造成其氨基酸序列与美洲型有所不同,形成的二级结构有一定的差异,但二级结构元件大致分布与美洲型相同,β折叠和β转角主要分布在N端和中间部分,α螺旋主要分布在中间及C端。该蛋白在N端存在3个潜在的信号肽切割位点,分别在第25~27位、第28~30位和第33~35位。
3 结论与讨论
河南PRRSV HN-09株ORF5基因全长为721 bp,其中编码GP5蛋白的ORF为603 bp,共编码200个氨基酸残基。该毒株的ORF5序列与山东、山西的同源性较高,为 99.2%~99.8%。与其他不同地方近几年的分离株同源性也较高,为93.4%~ 98.7%;与美洲型AF494042的同源性为93.5%,各地分离株与美洲型的同源性为93.4%~96.7%;与河南2004年分离株的同源性较低,为88.7%。近几年河南省流行的 PRRSV毒株与周边省份分离的毒株均为美洲型变异株,具有高致病性的生物学特征。虽然与各地分离株的ORF5都有一定的差异,但总体变异不大,引起2009年河南漯河该猪场PRRS疫情的原因可能来自疫苗株变异或在猪体内毒力返强。
本试验中分离的HN-09株序列编码200个氨基酸残基,其编码的GP5蛋白的相对分子质量大约为2.2×104。信号肽序列位于N端变异区内,其切割位点可能在第 33~35位(N)。二级结构中β折叠含量最高达41%,无规则卷曲含量较少,为14%,与美洲型AF494042相比,β转角数量有所减少,β折叠和无规则卷曲含量增加。变化主要分布在 N端(前74个氨基酸),而在第74位氨基酸以后,HN-09株和美洲型的氨基酸序列基本一致,形成的二级结构的数量和分布大致相同,说明该分离株所编码的GP5的主要功能区域氨基酸残基没有发生较大的变异,不影响该蛋白在病毒粒子中的功能。由于氨基酸中Ala、Asn、Pro等的含量增加,Gly、Ser、Thr等的含量减少,导致β转角的数量减少,β折叠、无规则卷曲数量增加。在第 9位上氨基酸残基由Gly变为Cys,导致此部位的β转角变成β折叠;第29位的Gly变为Ala、第30位的Ser变为Asn,在此形成α螺旋结构;在第58位由Lys变成Gln后,α螺旋断裂,形成无规则卷曲,并在第61位和第62位出现一个β转角。由这些变化可推测,HN-09株的突变主要集中在N端。此区域可能包含了一个信号肽序列,至于信号肽区的改变对该蛋白产生的影响,还需进一步研究。
[1] 殷震, 刘景华. 动物病毒学[M]. 2版. 北京: 科学出版社, 1998: 1137-1182.
[2] 童光志, 周艳君, 郝晓芳,等. 高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报, 2007, 29(5): 323-326.
[3] Snjider E J. Meulenberg J J. The molecular biology of artiiviruses[J]. Gen Virol, 1998, 79: 961-979.
[4] Hall W V. Porcine reproductive and respiratory syndrome (PRRS) virus a significant disease of pigs[J]. Aust Vet J, 2005, 83 (5): 260-261.
[5] 李志杰, 丁壮, 孟轲音, 等. PRRSV 缺失变异毒株JL/07/ SW株的分离鉴定及序列分析[J]. 中国兽医学报, 2009, 29(7): 830-835.
[6] An T Q, Zhou Y J, Liu G Q, et al. Genetic diversity and phylogenetic analysis of glycoprotein 5 of PRRSV isolates in mainland China from 1996 to 2006: Coexistence of two NA-subgenotypes with great diversity [J]. Vet Microbiol, 2007, 123: 43-52.
[7] Chen J, Liu T, Zhu C G, et al. Genetic variation of Chinese PRRSV strains based onORF5sequence[J]. Biochem Genet, 2006, 44: 425-435.
[8] Hermann J, Hoff S, Muñoz-Zanzi C, et al. Effect of temperature and relative humidity on the stability of infectious porcine reproductive and respiratory syndrome virus in aerosols[J]. Vet Res, 2007, 38: 81-93.
[9] Lopez O J, Osorio F A. Role of neutralizing antibodies in PRRSV protective immunity[J]. Vet Immunol Immunopathol, 2004, 102(3): 155-163.
[10] Nelsen C J, Murtaugh M P, Faaberg K S. Porcine reproductive and resirtory syndrome virus comparison: Divergent evolution on two continents[J]. J Virol, 1999, 73(1): 270-280.
[11] 尹彦涛, 夏平安, 崔保安, 等. 猪繁殖与呼吸障碍综合征病毒河南分离株ORF3~7基因克隆与序列分析[J].中国兽医学报, 2008, 28(5): 496-500.
[12] 黄泽彬, 李润成, 尹德明, 等. 高致病性 PRRSV缺失变异株Nsp2基因的克隆与遗传变异分析[J]. 湖南农业大学学报: 自然科学版, 2008, 34(6) : 680-685.
[13] 李大志, 邓子牛, 熊兴耀, 等. 番茄组织总 RNA提取
方法研究[J]. 湖南农业大学学报: 自然科学版, 2007, 33(5) : 572-575.
英文编辑:罗文翠
