鸭肝炎病毒FC64株的全基因组序列测定与分析*
2011-03-07宋翠萍韩先干仇旭升于圣青陈鸿军胡青海
宋翠萍,韩先干,仇旭升,于圣青,陈鸿军,胡青海,丁 铲
(中国农业科学院上海兽医研究所,上海200241)
鸭病毒性肝炎(Duck viral hepatitis,DVH)是由鸭肝炎病毒(Duck hepatitis virus,DHV)引起的一种具有急性、高度接触性、致死性的雏鸭传染病。本病以发病急、传播迅速、病死率高为特征。临诊表现为角弓反张,病理变化为肝炎和出血。DHV曾被分为1个~3个血清型[1-2],其中,DHV-1属小RNA病毒科成员,DHV-2和DHV-3属于鸭星状病毒(DAsV)[3-5]。2007年,在我国台湾地区和韩国,Tseng等和Kim等发现了在血清学和基因水平与之相差甚远的鸭肝炎病毒新血清型(DHV new serotype,DHV-N),定名为DHV-1B(台湾株)和DHV-1C(韩国株)[6-9]。近年来,我国学者也不断从发病鸭中分离到与DHV-1和DHV-3无血清学相关性的DHV-N毒株,但通过对分离株的全基因序列比对发现,自1958年发生鸭肝炎至今,我国DHV-1仍占主导地位[1]。
DHV-1野生病毒可以通过鸡胚的反复适应性培养而突变为对鸭无致病性的毒株,一些弱毒株C80、A66等便是使用这样的方式成功减毒[4]。笔者于2009年在福建省某鸭场分离获得了一株DHV强毒株(命名为FC株),经SPF鸡胚反复传64代后,培育成为对鸭无致病力的弱毒株,命名为FC64。为了对该弱毒株的遗传背景进行分析,本研究拟通过测定其全基因组序列,旨在明确该毒株的遗传背景,为研制鸭病毒性肝炎弱毒疫苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 病毒 DHV-1 FC毒株从福建省某发病鸭场12日龄樱桃谷肉鸭肝组织中分离,经9日龄SPF鸡胚增殖,收获死亡鸡胚肝组织,加入灭菌生理盐水配成1∶5的匀浆液,再反复传60代后,培育获得弱毒株,命名为FC64。上述2种毒株均分装保存于—80℃。
1.1.2 试剂 反转录酶及反转录试剂和pGEM-T easy载体为Promega公司产品;RNA提取试剂、Accquire Taq HF酶为Invitrogen公司产品;凝胶回收试剂盒、DNA片段快速回收试剂盒、质粒提取试剂盒等为北京天根公司产品。
1.2 方法
1.2.1 病毒RNA提取 DHV RNA的提取按常规方法进行[9]。即取上述病毒鸡胚肝组织匀浆液,反复冻融3次后,12 000 r/min离心5 min,取100 μ L上清液,加入1 mL Trizol试剂,反复摇匀。室温放置20 min,加入200 μ L氯仿,反复振荡混匀。室温放置10 min,在4℃以12 000 r/min离心15 min。取上层水相,加入等体积的异丙醇,4℃放置15 min,4℃12 000 r/min离心10 min。弃上清,沉淀用750 mL/L无RNA酶的乙醇洗涤,在4℃以12 000 r/min离心10 min,弃上清,室温干燥15 min。用30 μ L无RNA酶的纯水重悬,取部分RNA进行逆转录,其余保存于—20℃。
1.2.2 反转录PCR(RT-PCR) 根据Ⅰ型DHV国内弱毒株C80全基因组序列[4],利用Primer Premier 5.0设计出5对特异的引物(表1),由上海英骏公司合成。以提取的病毒RNA为模板,应用随机引物在MMLV反转录酶的作用下逆转录获得病毒基因组cDNA,随后利用Accquire Taq HF酶PCR扩增。反应结束后,取8 μ L PCR产物在10 g/L琼脂糖凝胶上电泳。

表1 全长测序的引物Table 1 Primers for sequencing
1.2.3 克隆与测序 用DNA快速回收试剂盒纯化回收PCR产物,连接至pGEM-T easy载体,转化DH5a感受态大肠埃希菌,在LB抗性培养基中过夜培养后,用碱裂解法提取质粒,重组质粒用酶切和PCR扩增法鉴定阳性重组子,由上海生工生物工程技术服务有限公司(简称上海生工)完成测序工作。
1.2.4 基因序列的拼接与分析 采用DNA Star的MegAlign程序将序列测定结果进行拼接,获得DHV-ⅠFC64弱毒株的全长基因组序列,将该序列与GenBank中登录的DHV-Ⅰ序列进行比对(表2),进行同源性和遗传进化分析。
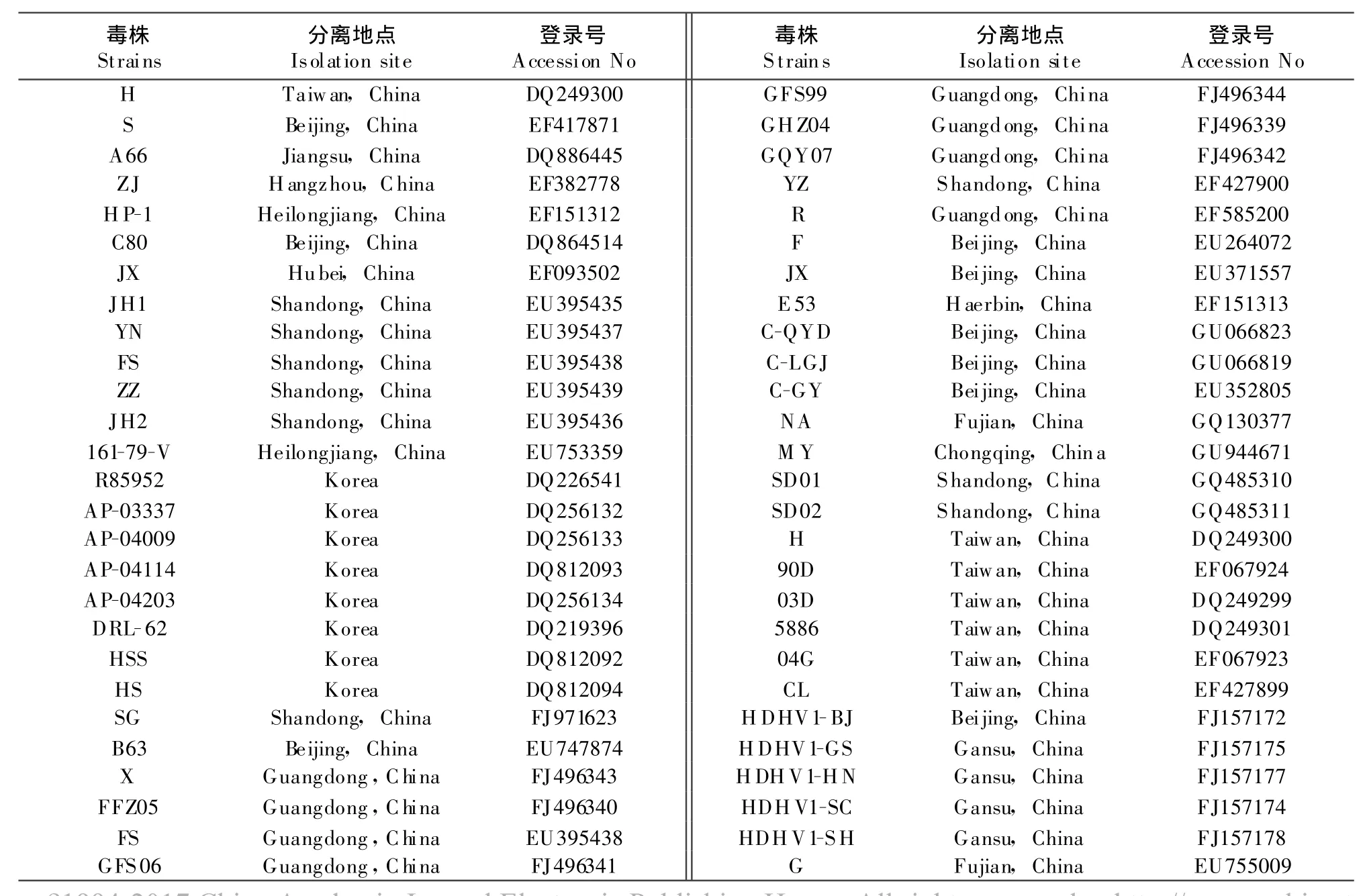
表2 参与比对的序列T able 2 Blast of the complete sequences in DHV-1 strains
2 结果
2.1 全基因组RT-PCR扩增结果
5个PCR扩增产物均与预期片段大小相符,回收后成功克隆入pGEM-T easy载体中(图1)。各连接产物的质粒DNA由上海生工生物工程技术服务有限公司测序。
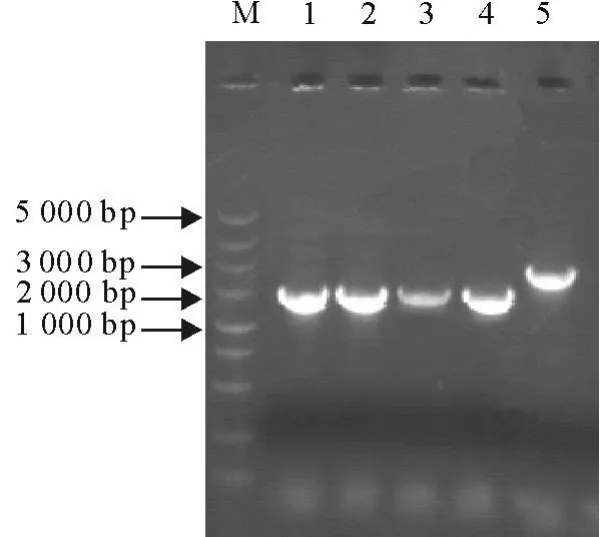
图1 全基因组RT-PCR结果Fig.1 RT-PCR result of the complete genome
2.2 基因组序列测定结果
根据各片段间相互重叠的区域,利用DNA Star软件包中MegAlign将FC64株各基因片段的测序结果进行拼接,得到Ⅰ型DHV FC64株的全基因组核苷酸序列。结果显示,FC64株全基因组为7 692 bp(未包括polyA尾),碱基组成为:腺嘌呤28.8%,鸟嘌呤22.64%,尿嘧啶28.05%和胞嘧啶20.51%,A+U含量丰富,占56.85%。5′端非编码区(5′UT R)为626 bp,3′UT R约为314 bp,编码含2 249个氨基酸的一个多聚蛋白,该蛋白的等电点(pI)为6.88,分子质量约为252.5 ku。多聚蛋白经过一系列蛋白裂解,产生3种结构蛋白(VP0、VP3、VP1)和8个非结构蛋白(2A1、2A2、2B、2C、3A、3B、3C、3D)。
2.3 基因组序列分析
根据测序结果,笔者将FC64毒株的全基因序列上传GenBank,获取登录号为:HQ232302。目前,GenBank登录了近100株DHV基因组全序列。采用Cluster W方法将参考的序列(表2)与FC64测序结果进行比对(图2),根据全基因组序列分析表明,DHV可分为3大群,现在已被广泛接受为DHV-1的3种血清型(1A、1B、1C)。而且,中国内地、中国台湾和韩国三地的分离株明显存在地域性差异。其中,除了国际上广泛分离和流行的1A血清型之外,90D、04G属于中国台湾分离株(血清1B型),AP-03337、AP-04009、AP-04114和AP-04203等属于1Ca型(韩国分离株),SD01、SD02、B63、FS、G、CGY等属于中国内地分离株(1Cb型),这1B和1C血清型均为DHV-N,这3种血清型毒株的全基因序列同源性均在80%以下。FC64株与国内分离或培育的JX强毒株、C80、MY和A66等3株弱毒株处于同一较小的分支,这表明这些毒株具有相近的遗传关系。FC64株ORF的核苷酸序列与DHV-1A血清型其他各株的同源性在94.3%~99.6%之间。尤其是,FC64与国内的A66、C80、MY弱毒株的核苷酸和氨基酸序列的同源性均很高,为99.6%,与同一分支的JX强毒株的同源性为98.7%(图3)。这些结果说明,Ⅰ型DHV的氨基酸序列在种内高度保守。FC64株与90D、04G、AP-03337株的核苷酸和氨基酸序列的同源性分别仅为71.1%~72.0%,表明DHV不同血清型间存在较高变异性。
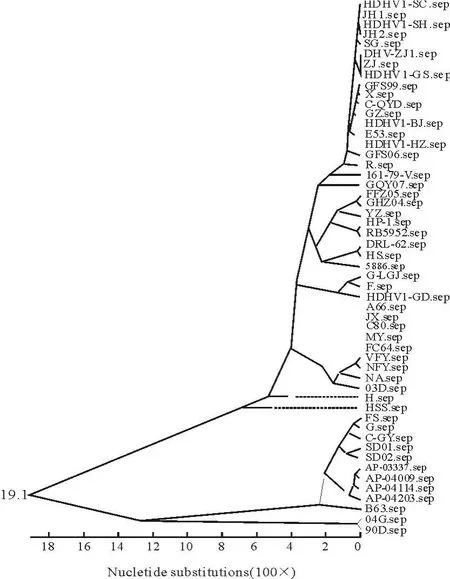
图2 通过Cluster W比对DHV分离株全基因组序列Fig.2 Blast of complete genomes of DHV isolates by Cluster W

图3 核苷酸及氨基酸同源性分析Fig.3 Nucleotide acid and amino acid homology analysis with the complete genome of the strains
3 讨论
根据全基因组序列分析表明,DHV可分为3大群,现在已被广泛接受为DHV-1的3种血清型(1A、1B、1C)[4-6]。而在DHV-N中,中国内地、中国台湾和韩国三地的分离株明显存在地域性差异。其中,90D、04G属于中国台湾分离株(血清1B型),AP-03337、AP-04009、AP-04114和AP-04203等属于1Ca型(韩国分离株),SD01、SD02、B63、FS、G、CGY等属于中国内地分离株(1Cb型),这1B和1C血清型均为DHV-N,同源性在80%以下[7-9]。而国际上目前主要的分离株仍位于1A群,为经典血清1型[11-12]。根据全基因序列的比对,本研究对象FC64毒株(登陆号为:HQ232303)亦属于经典血清1型DHV。其核苷酸序列与DHV-1A血清型其他各株的同源性在94.3%~99.6%之间。根据目前已知的DHV-I分离株的全基因组进化树对比分析(图2),笔者发现,DHV-1A分离株明显分为5个基因群体,建议将DHV-1分为5个基因型(1Aa~e),弱毒株主要集中在1Ab基因型中。最近,中国农业科学院兰州兽医研究所分离获得多株强致病力的毒株(HDHV-1),这些毒株的全基因组序列大部分在1Ae分支上,而且最近国内1Ae基因型的毒株分离率越来越高(表2、图2)。这说明随着分离年代的推移,DHV毒株形成明显的毒力增强趋势。这暗示着DHV-1A的毒力正在逐渐演变。
Ding C Y等[4]对我国分离的一株DHV-1进行鸡胚传代80代,对传代致弱的毒株(C80)进行了全基因序列的测定,发现了数个DHV-1基因组的特征性结构,如具有与猪捷申病毒(Porcine tescho virus)和丙型肝炎病毒(Hepatitis C virus)相似的内部核糖体进入位点;而引导蛋白长度较短,与其他小RNA病毒不同。Jin X等[11]对DHV-1湖北分离株JX进行了全序列测定,该株病毒在鸭胚中和反应和雏鸭保护性试验中显示出良好的抗原性。通过全基因序列比对发现,本研究对象FC64毒株与JX株和C80毒株存在极高的同源性(99.6%)。这暗示利用该毒株制成的弱毒疫苗与国内其他几株疫苗株一样,能够很好地抵抗DHV-1A血清型强毒的攻击。本研究对该毒株的全基因组测序结果更加佐证了该疫苗株的免疫原性。
然而,DHV不同血清型之间的同源性不高(<80%),交叉免疫原性很低。随着近年来DHV-1C血清型类韩国毒株在我国开始流行,严重地影响了DVH的控制[7]。而目前不仅缺乏DVH 1A血清型疫苗,而且1B和1C血清型毒株的培育刚刚起步,尚未见显著进展。因此,研制DHV-1单价或多价疫苗以控制不同血清型的DHV感染显得异常紧迫。除此之外,已有通过反向遗传学技术进行弱毒疫苗的研究[12-13],方便了对DHV抗原的分子修饰,并使得研制DHV多种血清型嵌合的弱毒疫苗成为可能。
[1] 范卫国,杜佳慧,曹瑞兵,等.Ⅰ型鸭肝炎病毒概述[J].动物医学进展,2009,30(11):110-114.
[2] 黄建芳,张知良,丁 铲.鸭病毒性肝炎防治方法研究初报[J].中国家禽,1990(3):21-25.
[3] 王桂英,朱明霞,王 岳.Ⅰ型鸭肝炎病毒的分离与鉴定[J].动物医学进展,2009,30(10):66-68.
[4] Ding C Y,Zhang D B.Molecular analysis of duck hepatitis virus type 1[J].Virology,2007,361(1):9-11.
[5] Kim M C,Kwon Y K,Joh S J,et al.Differential diagnosis between type-specific duck hepatitis virus type 1(DHV-1)and recent Korean DHV-1-like isolates using a multiplex polymerase chain reaction[J].Avian Pathol,2008,37(2):171-177.
[6] Kim M C,Kwon Y K,Joh S J,et al.Molecular analysis of duck hepatitis virus type 1 reveals a novel lineage close to the genus Parechovirus in the family Picornaviridae[J].J Gen Virol,2006,87(11):3307-3316.
[7] Kim M C,Kwon Y K,Joh S J,et al.Recent Korean isolates of duck hepatitis virus reveal the presence of a new geno-and serotype when compared to duck hepatitis virus type 1 type strains[J].Arch Virol,2007,152(11):2059-2072.
[8] Tseng C H,Tsai H J.Molecular characterization of a new serotype of duck hepatitis virus[J].Virus Res,2007,126(1-2):19-31.
[9] Tseng C H,Knowles N J,T sai H J,et al.Molecular analysis of duck hepatitis typeⅠindicates that it should be assigned to a new genus[J].Virus Res,2007,123(2):1902-1903.
[10] Fu Y,Pan M,Wang X,et al.Molecular detection and typing of duck hepatitis A virus directly from clinical specimens[J].Vet Microbiol,2008,131(3-4):247-257.
[11] Jin X,Zhang W,Gu C,et al.Identification and molecular analysis of the highly pathogenic duck hepatitis virus type 1 in Hubei province of China[J].Res Vet Sci,2008,85(3):595-598.
[12] Liu G,Wang F,Ni Z,et al.Genetic diversity of the VP1 gene of duck hepatitis virus type I(DHV-I)isolates from southeast China is related to isolate attenuation[J].Virus Res,2008,137(1):137-141.
[13] Yun T,Ni Z,Liu G Q,et al.Generation of infectious and pathogenic duck hepatitis virus type 1 from cloned full-length cDNA[J].Virus Res,2010,147(2):159-165.