淋球菌孔蛋白基因与脂寡糖表位融合基因原核表达载体的构建及表达
2011-03-07赵莉群陈中伟王希良于三科
赵莉群,陈中伟,张 伟,王希良,于三科*
(1.西北农林科技大学动物医学院,陕西杨陵712100;2.军事医学科学院微生物流行病研究所病原微生物生物安全国家重点实验室,北京100071)
淋病奈瑟菌(Neisseria gonorrhoeae,Ng)又称淋球菌,是淋病的病原体。近年来由于新型耐药菌株的不断出现[1-2],使得本菌感染率呈上升趋势。孔蛋白(porin PI)是淋球菌主要外膜蛋白,占外膜蛋白总量的60%以上,在淋病的发病机制中有重要作用。孔蛋白相对于淋球菌其他表面抗原成分有很大的优势,如持续表达、相对保守、可诱导机体产生保护性抗体且能在恢复期患者阴道分泌液和血清中检出、能激活补体介导的杀菌活性,还能保护上皮细胞免受淋球菌的侵袭[3-4];除此以外,孔蛋白还具有免疫佐剂活性,已成为淋球菌疫苗研制的首选对象[5]。根据多肽的定位和对蛋白酶的敏感性不同,可将PI分为PIA和PIB两类,PIA和PIB由同一等位基因编码,其氨基酸序列在不同分离株间的相似性为65%~80%[6]。
脂多糖(lipopolysaccharide,LPS)是淋球菌表面唯一的碳水化合物抗原,由于缺少重复O抗原,又称为脂寡糖(lipid oligosaccharide,LOS),有资料显示在正常人血清中存在能与淋球菌脂寡糖结合的抗体[7]。由于LOS具有强烈的毒性,加之其与宿主碳水化合物有部分相似性,要将纯化的淋球菌LOS用于疫苗研究是比较困难的。Gulati等鉴定出淋球菌LOS的保守表位,因可以被Mab2C7识别,又称为2C7表位[8]。2C7表位是由Hep1、Hep2及与其相连的半乳糖链构成的,Mab2C7可以识别不同淋球菌菌株的LOS。Ngampasutadol等通过大肠埃希菌随机肽库筛选了7个能与Mab2C7结合的短肽并证明其中之一PEP1能够产生由正常人血清介导的补体杀伤作用[9]。本课题组通过人工合成技术合成上述7个短肽,经抗体效价及杀菌活性检测筛选出保护性较好的3个短肽(表位),分别命名为PEP1PEP2PEP7[10]。
本研究克隆淋球菌孔蛋白(PIA、PIB)基因,通过重叠PCR技术将其与筛选的LOS 2C7优势表位连接,导入原核表达载体pET32a,转化大肠埃希菌BL21(DE3),IPTG诱导融合蛋白表达,以期为孔蛋白生物活性的研究提供依据也为淋球菌融合蛋白疫苗的研制奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株、培养基和质粒 淋球菌标准株CMCC29400和CMCC29403均购自中国药品生物制品检验检定所,并按其要求配制淋球菌巧克力培养基及肉汤保存液;E.coil DH5a、E.coil BL21(DE3)、pET32a(+)由军事医学科学院微生物流行病研究所免疫学研究室保存;PEP1-PEP2-PEP7-PUC57基因由上海生工生物工程技术服务有限公司合成。
1.1.2 主要试剂 蛋白Marker(low)、DNA Marker DL 2 000、DL 15 000、各类工具酶、pMD-18T vector、胶回收试剂盒以及质粒提取试剂盒均购自宝生物工程(大连)有限公司。
1.1.3 引物 引物由上海生工生物工程技术服务有限公司北京合成部合成,共设计5条引物:

P1、P2为PIA、PIB共用上下游引物,其中PIA为907 bp,PIB为970 bp;P5、P6为表位引物,片段大小为485 bp;P1、P4、P5、P6为融合基因PIA-表位及PIB-表位共用引物,其中PIA-表位为1 392 bp,PIB-表位为1 455 bp,P1为PIA、PIB上游引物,P6为表位下游引物,P4、P5为PIA/PIB与表位重叠部分引物。下划线部分分别是BamHⅠ和HindⅢ酶切位点,粗体部分为引物的重叠部分。
1.2 方法
1.2.1 细菌的培养与收获 将淋球菌划线接种于巧克力琼脂平板,置37℃、体积分数为5%的CO2温箱内培养24 h~48 h,每一平板的菌落刮入600 μ L的肉汤保存液中,滴加20%~30%甘油于—70℃保存。
1.2.2 PI基因及PI-表位融合基因的扩增 取—70℃保存的淋球菌菌液为模板。PIA、PIB PCR反应体系均为25 μ L,其中上游引物P1 10 pmol,下游引物P210 pmol,dNTP 0.4 nmol,10×Ex Buffer 2.5 μ L,Ex Taq 1 U,菌液1 μ L,ddH2O 17 μ L,反应参数为,94℃5 min,94℃1 min,64℃1 min,72℃90 s,循环29次,72℃7 min。通过重叠PCR技术[11]构建PIA-表位、PIB-表位融合基因,所用引物为P1、P4、P5、P6,反应体系、参数同PIA、PIB。扩增产物经10 g/L琼脂糖凝胶电泳检测,纯化回收PCR产物。将扩增片段分别与克隆载体pMD-18T连接,送上海生工生物工程技术服务有限公司北京分公司完成测序。
1.2.3 原核表达载体的构建 用BamHⅠ和HindⅢ双酶切pMD18T-PIA、pMD18T-PIB、pMD18T-PIA-表位、pMD18T-PIB-表位及pET32a后胶回收各片段,所得PIA、PIB、PIA-表位、PIB-表位与pET32a在T 4 DNA连接酶作用下连接,连接产物转化感受态细胞DH 5α,经氨苄青霉素平板、双酶切、PCR鉴定得阳性重组表达质粒,送上海生工生物工程技术服务有限公司北京分公司测序。
1.2.4 蛋白的诱导表达 将阳性pET32a-PIA、pET32a-PIB、pET32a-PIA-表位、pET32a-PIB-表位重组表达质粒转化表达宿主菌BL21(DE3),随机挑选单个白色菌落接种于5mL Amp+LB液体培养基中,37℃、200 r/min振荡培养12 h~16 h。取少量菌液质粒提取,PCR、双酶切鉴定。取鉴定正确的菌液50 μ L加入5 mL Amp+LB液体培养基中,37℃200 r/min振荡培养至OD660为0.6~0.8,加IPTG至终浓度为0.5 mmol/mL,以未加IPTG的菌液作对照,30℃、220 r/min振荡培养4 h,离心收集菌体,SDS-PAGE初步鉴定。
2 结果
2.1 PI、表位基因及PI-表位融合基因的获得
扩增获得PIA、PIB表位基因及PIA-表位、PIB-表位及融合基因。琼脂糖凝胶电泳显示两条介于900~1 000 bp的条带,与PI预期的片段大小相符;两条1 000~2 000 bp的条带,与融合基因PI-表位预期的片段大小相符;一条450 bp~500 bp的条带,与表位片段大小相符(图1)。

图1 PIA、PIB、PIA-表位、PIB-表位基因及表位PCR产物琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of PCR products of PIA,PIB,PIA-epitope,PIB-epitope and epitope
2.2 原核表达载体的构建
纯化的PCR产物与pMD-18T载体连接,取阳性克隆测序,对所得序列进行比对分析证实无密码子突变或缺失。pMD18T-PIA、pMD18T-PIB、pMD18T-PIA-表位、pMD18T-PIB-表位经BamHⅠ、HindⅢ双酶切后与经同样双酶切的pET32a连接,PCR、双酶切均能得到预期的目的片段(图2)。结果表明pET32a-PIA、pET32a-PIB、pET32a-PIA-表位、pET32a-PIB-表位原核表达载体构建成功。

图2 PIA、PIB、PIA-表位、PIB-表位基因双酶切检测图Fig.2 Enzyme digestion products of PIA,PIB and PIA-epitopes and PIB-epitopes
2.3 蛋白的诱导表达
经IPTG诱导表达,SDS-PAGE电泳分析。结果显示,在40 ku左右出现一条目的条带,与PIA蛋白大小一致(图3);在43 ku左右出现一条目的条带,与PIB蛋白大小一致(图4);在63 ku左右出现一条目的条带,与PIA-表位融合蛋白大小一致(图5);在66 ku左右出现一条目的条带,与PIB-表位融合蛋白大小一致(图6)。
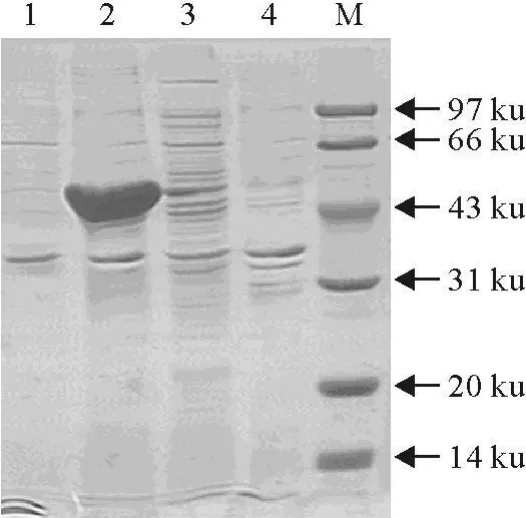
图3 PIA超声波破碎蛋白SDS-PAGE图Fig.3 SDS-PAGE analysis of ultrasonic PIA proteins
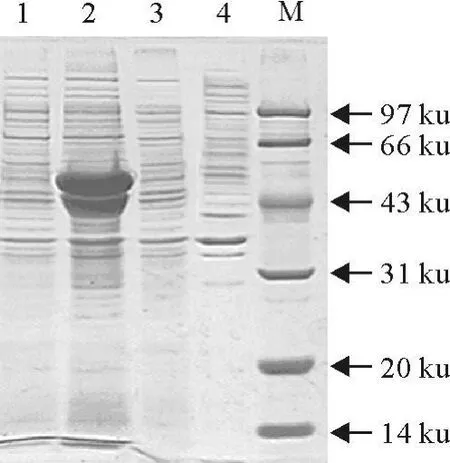
图4 PIB超声波破碎蛋白SDS-PAGE图Fig.4 SDS-PAGE analysis of ultrasonic PIB proteins

图5 PIB-表位超声波破碎蛋白SDS-PAGE图Fig.5 SDS-PAGE analysis of ultrasonic PIB-epitope proteins

图6 PIA-表位超声波破碎蛋白SDS-PAGE图Fig.6 SDS-PAGE analysis of ultrasonic PIA-epitope proteins
3 讨论
选择合适的抗生素治疗对于控制淋病来说是个很重要的措施,而近10年来,淋球菌对多种抗生素的耐药性不断增强[12,13]。在美国,曾用氟喹诺酮及阿奇霉素等口服类抗生素进行治疗,而现在已不被推荐使用,原因是考虑到药物的耐药性及临床治疗中的不足[14]。疫苗接种无疑是预防及控制淋病最为有效的措施。然而,淋球菌抗原的高度变异性一直是阻挠疫苗研制的一大难题,那些仅能激发机体保护性免疫同时又高度保守的淋球菌抗原是解决这一难题的关键所在,孔蛋白就是这样一种具有应用前景的候选抗原。本研究从淋球菌标准菌株中扩增出孔蛋白基因PIA、PIB,通过重叠PCR技术将PEP1-PEP2-PEP7基因串联构建在PIA、PIB上形成融合基因PIA-表位、PIB-表位,导入克隆载体pMD-18T,经PCR鉴定、核苷酸测序证实融合基因构建成功。测序结果与GenBank中已知序列进行比较,同源性为100%,表明扩增的PIA和PIB基因序列相当保守。在表达载体方面,我们选择pET32a载体是因为其是以自身所带起始密码子ATG与6个组氨酸和外源基因表达为融合蛋白的,并且含有可以改善目的蛋白的溶解性及正确折叠的硫氧还蛋白标签(T rx-tag),为了方便目的蛋白分离及纯化,pET32a载体还带有His°Tag与S°Tag两个标签蛋白。在本研究中,pET32a与目的基因连接后,经酶切分析、PCR鉴定及核苷酸测序证实原核表达载体构建成功,这为后续的蛋白纯化奠定了很好的基础。在蛋白表达方面,我们对IPTG浓度、诱导时间、温度等条件进行了一系列摸索,但PIA、PIB始终以包涵体形式表达且在30℃、IPTG为0.5 mmol/mL的情况下诱导4 h表达量最大,而融合蛋白PIA-表位、PIB-表位无论在何种条件下,上清中均有表达,但在30℃、IPTG为0.5 mmol/mL的情况下诱导4 h时上清中表达量最大,沉淀中几乎没有,这种情况的出现可能与加入表位后引发的PIA、PIB蛋白质空间构象发生改变,从而形成可溶性的融合蛋白PIA-表位、PIB-表位有关。
综上所述,本研究成功构建了淋球菌外膜蛋白PI和脂寡糖优势表位融合基因的原核表达载体,并能有效表达PI-表位融合蛋白,为后续的包涵体变性复性、蛋白纯化及动物免疫原性评价奠定基础,也为淋球菌亚单位疫苗的研制提供依据。
[1] Plante M,Jerse A,Hamel J.Intranasal Immunization with gonococcal outer membrane preparations reduces the duration of vaginal colonization of mice by Neisseria gonorrhoeae[J].Infect Dis,2000,82(3):848.
[2] 邵长庚,梁国钧,龚向东,等.中国性病监测的回顾和展望[J].中国性病艾滋病防治,2002,8(4):248.
[3] Massari P,Ram S,Macleod H,et al.The role of porins in neisserial pathogenesis and immunity[J].Trends Microbiol,2003,11(2):87-93.
[4] Ngampasutadol J,Ram S,Blom A M,et al.Human C4b-binding protein selectively interacts with Neisseria gonorrhoeae and results in species-specific infection[J].Proc Natl Acad Sci USA,2005,102(47):17142-17147.
[5] Dyet K H,Simmonds R S,Martin D R.Evaluation of porB PCR-amplicon restriction endonuclease analysis as a method to determine porB variable-region sequences in nonseroty peable meningococci[J].J Clin Microbiol,2004,42(4):1731-1733.
[6] McKnew D L,Ly nn F,Zenilman J M,et al.Porin variation among clinical isolates of Neisseria gonorrhoeae over a 10-year period,as determined by Por variable region typing[J].J Infect Dis,2003,187(8):1213-1222.
[7] Yamasaki R,Maruyama T,Yabe U,et al.Normal human sera contain bactericidal IgGthat binds to theoligosaccharide epitope expressed within lipooligosaccharides of Neisseria gonorrhoeae[J].J Biochen,2005,137(4):487-494.
[8] Gulati S,Ngampasutadol J,Yamasaki R,et al.Strategies for mimicking Neisseria saccharide epitopes as vaccines[J].Int Rev Immunol,2001,20:229-250.
[9] Ngampasutadol J,Rice P A,Walsh M T,et al.Characterization of a peptide vaccine candidate mimicking an Oligosaccharide epitope of Neisseria gonorrhoeae and resultant immune responses and function[J].Vaccine,2006,24(2):157-170.
[10] 张 伟,刘 坤,姜德玉,等.淋球菌LOS 2C7表位筛选及其与HBc融合蛋白的原核表达[J].免疫学杂志,2010,266:498-501.
[11] 陈 丹,王 宏,朱中松,等.VEGF189基因合成、原核表达及鉴定[J].免疫学杂志,2009,25(4):469-472.
[12] Tapsall J W.Antibiotic resistance in Neisseria gonorrhoeae[J].Clin Infect Dis,2005,41(Suppl 4):S263-268.
[13] Workowski K A,Berman S M,Douglas J M Jr.Emerging antimicrobial resistance in Neisseria gonorrhoeae:urgent need to strengthen prevention strategies[J].Ann Intern Med,2008,148:606-613.
[14] Workowski K A,Berman S M.Sexually transmitted diseases treatment guidelines[J].MMWR Recomm Rep,2006,55:1-94.
