猪瘟病毒NS2 3′端基因的克隆与原核表达*
2011-03-07杨幼聪张彦明汤智慧张三东
杨幼聪,张彦明,康 恺,向 华,汤智慧,张三东
(西北农林科技大学动医学院,陕西杨陵712100)
猪瘟病毒(classical swine fever virus,CSFV)属于黄病毒科瘟病毒属成员,为单股正链RNA病毒[1]。CSFV基因组含有一个大的读码框,编码4种结构蛋白(Cp(14)、Erns(gp48)、E1(gp33)和E2(gp53))和7种非结构蛋白(Npro、P7、NS2-3(p125)、NS4A、NS4B、NS5A、NS5B)。Lackner T等[2]发现CSFV NS2蛋白具有自身蛋白酶(autoprotease)活性,其与宿主细胞中的分子伴侣Jiv90相互作用后,NS2蛋白发挥蛋白酶活性,将NS2-3切割为NS2和NS3。NS2蛋白的表达诱导宿主细胞阻滞于S期,能够促进Cyclin A蛋白被蛋白酶体快速降解而抑制细胞的增殖[3]。CSFV NS2蛋白也能够引起宿主细胞内质网应激反应,激活核转录因子NF-к B信号通路[3]。研究发现CSFV在血管内皮细胞中的增殖良好,NS2蛋白主要分布在细胞质中,而且CSFV的感染能够显著上调血管内皮细胞表面黏附分子integrin β3的表达,NS2蛋白在其中起着重要的作用[4]。CSFV NS2蛋白通过激活NF-к B的活性上调趋化因子IL-8和抗凋亡蛋白Bcl-2的表达,同时NS2蛋白的表达能够对抗蛋白酶体抑制剂MG132对NF-к B的活性和IL-8表达的抑制作用,并能够对抗MG132诱导正常血管内皮细胞的凋亡效应,这种抗凋亡作用与NS2蛋白能够上调宿主细胞中抗凋亡蛋白Bcl-2及integrin β3的表达相关[5]。西北农林科技大学动物医学院畜禽疫病防治与畜产品安全实验室也以CSFV NS2-C363为诱饵蛋白通过酵母双杂交方法,从猪血管内皮细胞cDNA文库中筛选到12个与猪瘟病毒NS2蛋白互作用的阳性克隆。
本试验构建CSFV NS2-C363基因的原核表达载体,并对其表达情况进行了研究,以期为下一步制备NS2蛋白的单克隆抗体奠定基础,同时为进一步研究NS2蛋白与宿主细胞蛋白之间的相互作用提供基础材料。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 E.coli DH5α、BL21菌株、原核表达载体pET-32a和CSFV石门株NS2真核表达载体,均由西北农林科技大学动物医学院畜禽疫病防治与畜产品安全实验室保存。
1.1.2 主要酶及试剂 限制性内切酶HindⅢ、Bam HⅠ、T4 DNA连接酶以及PCR反应试剂、胶回收试剂盒等购自宝生物工程(大连)有限公司;ECL发光试剂盒为上海炎炎彬化工科技有限公司产品;兔抗His单抗、羊抗兔IgG-HRP为北京博奥森生物技术有限公司产品;其他试剂均为国产分析纯。
1.2 方法
1.2.1 引物合成 根据CSFV石门株的基因序列(AF092448),用Primer Premier 5.0软件设计了NS2 3′端的基因扩增的特异性引物,上下游引物5′端分别引入了HindⅢ、BamHⅠ限制性酶切位点(下划线部分)。上游引物P1:为5′-CATATGGGATCCTTGGT TGGCTTAGTCAAGGC ,下游引物P2:为5′-CAT TTAAAGCTT TCTAAGCACCCAGCCAAGG。引物由南京金斯瑞生物科技公司合成。
1.2.2 PCR反应 以CSFV石门株NS2真核表达质粒为模板,使用特异性引物P1和P2进行扩增。反应条件为:95℃5 min;95℃30 s,65℃40 s,72℃30 s,共35个循环;72℃延伸10 min。产物用10 g/L琼脂糖凝胶电泳分析。
1.2.3 原核重组表达质粒pET-32a的构建及鉴定将目的基因进行PCR扩增、胶回收后,与pET-32a表达载体分别用HindⅢ和BamHⅠ双酶切,然后用T4 DNA连接酶连接,转化到DH5α感受态细胞中,挑取白色单克隆于含氨苄霉素抗性的LB培养液中37℃振荡过夜,提取质粒进行酶切及测序鉴定。
1.2.4 CSFV石门株NS2-C363基因在大肠埃希菌中的表达 将pET-NS2-C363转化到感受态大肠埃希菌BL21,涂布于含Amp+(100 μ g/mL)的LB平板上,37℃培养过夜,次日挑取单菌落,于5 mL LB液体培养基中,37℃摇床振荡(200 r/min)过夜培养。
1.2.5 NS2-C363蛋白的诱导表达与可溶性分析
1.2.5.1 不同浓度的IPTG对NS2-C363蛋白的诱导表达分析 将菌液按1∶100接种于6 mL含有Amp+100 μ g/mL)抗生素的LB液体培养基中,37℃振荡培养至OD600为0.4~0.6时,加入IPTG至终浓度分别为0.25、0.5、0.75、1.0 mmol/L,37℃诱导表达4 h~5 h,收获细菌,然后进行SDSPAGE分析。
1.2.5.2 不同时间对PET-NS2-C363蛋白的诱导表达分析 将冻存菌液按1∶100扩大接种于6 mL含有Amp+(100 μ g/mL)抗生素的LB液体培养基中,37℃振荡培养至OD600为0.4~0.6时,加入IPTG至终浓度0.5 mmol/L,37℃诱导表达3、4、5、6、7 h,收获细菌,然后进行SDS-PAGE分析。
1.2.5.3 表达产物的可溶性分析 将冻存菌液按1∶100扩大接种于6 mL含有Amp+(100 μ g/mL)抗生素的LB液体培养基中,37℃振荡培养至OD600为0.4~0.6时,加入IPTG至终浓度0.5 mmol/L,37℃诱导表达7 h,收获细菌,以PBS重悬菌体,超声破菌。分别收集上清和沉淀,取上述各样品做SDS-PAGE电泳检测表达情况。
1.2.6 Western blot检测 表达蛋白的电泳同
1.2.5。电泳结束后用Bio-Rad电转移装置将其转印于PVDF膜上(半干转膜法100 V,1.5 h),转印结束后,按常规方法进行Western blot,一抗为鼠源抗His标签的抗体(1∶3 000倍稀释),二抗为辣根过氧化物酶标记的羊抗鼠IgG(体积比1∶4 000倍稀释),最后用DAB显色。
2 结果
2.1 CSFV石门株NS2 3′端基因的PCR扩增
扩增片段长度约为363 bp(图1),与预期的基因片段大小相符。
2.2 重组原核表达载体pET-NS2-C363的鉴定
重组原核表达载体pET-NS2-C363经限制性内切酶HindⅢ、BamHⅠ双酶切,获得5 900 bp和363 bp的片段,与预期大小相符(图2)。将酶切鉴定正确的阳性菌株送至南京金斯瑞生物科技公司测序。结果表明,序列完全正确,无突变,无缺失。
2.3 不同浓度IPTG对PET-NS2-C363蛋白的诱导表达分析
加入IPTG至终浓度分别为1.0、0.75、0.5、0.25 mmol/L,37℃诱导表达4 h收菌,然后进行SDS-PAGE分析。可见试验范围内IPTG的浓度对蛋白表达没有显著影响(图3)。
2.4 不同诱导时间对PET-NS2-C363蛋白的诱导表达分析
加入IPTG至终浓度0.5 mmol/L,37℃诱导表达3、4、5、6、7 h后收获细菌,然后进行SDS-PAGE分析。可见诱导7 h后目的蛋白的表达量达高峰(图4)。
2.5 PET-NS2-C363蛋白的可溶性分析
重组质粒经IPTG诱导后分别收集上清和沉淀,经SDS-PAGE检测,融和蛋白主要以包涵体形体存在于沉淀中,上清中也有少量的融和蛋白(图5)。
2.6 融合蛋白pET-NS2-C363蛋白的Western blot检测
融合蛋白pET-NS2-C363的Western blot检测结果见图6。

图1 NS2 3′端基因PCR扩增电泳图Fig.1 Electrophoresis of PCR products for 3'end of NS2 gene
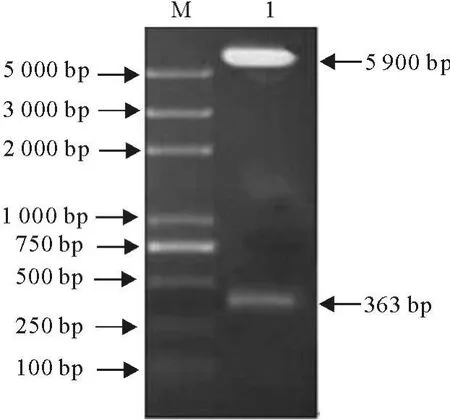
图2 重组质粒pET-NS2-C363的酶切鉴定 Fig.2 Identification of recombinant plasmid pET-NS2-C363 by enzyme digestion
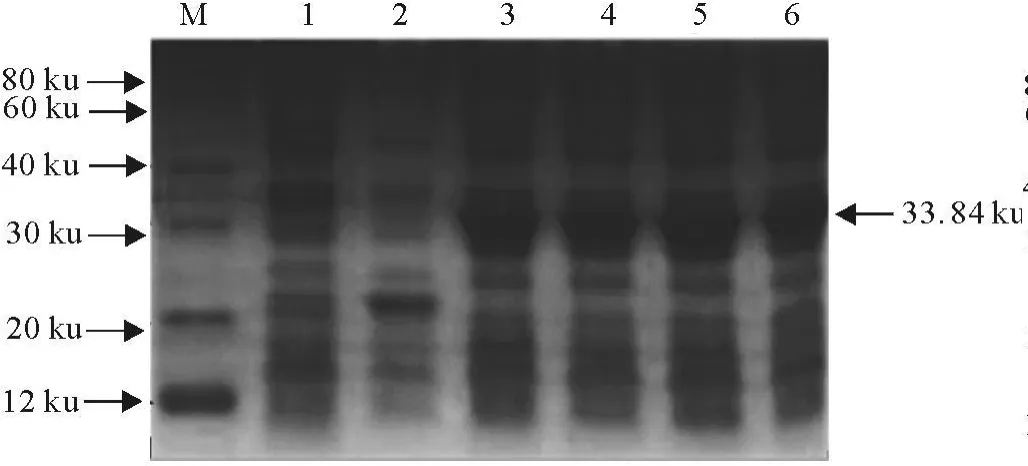
图3 SDS-PAGE检测pET-NS2-C363的在不同IPTG浓度情况下的表达Fig.3 Detection of pET-NS2-C363 expression induced with IPTG of different concentrations by SDS-PAGE

图4 SDS-PAGE检测pET-NS2-C363在不同时间 下的表达Fig.4 Detection of pET-NS2-C363 ex pression in different time by SDS-PAGE

图5 PET-NS2-C363蛋白的可溶性分析Fig.5 Solubility analysis of PET-NS2-C363 protein

图6 pET-NS2-C363重组蛋白Western blot检测Fig.6 Fusion protein pET-NS2-C363 detection by Western blot
3 讨论
CSFV NS2基因全长为1 371 bp,共编码457个氨基酸,蛋白的分子质量约为53 ku,研究表明CSFV NS2蛋白定位于细胞的内质网上,至少含有2个内部信号肽序列、4个跨膜区。目前普遍认为NS2仅具有自身蛋白酶活性在NS2/NS3蛋白的自我酶解过程发挥作用,这一过程病毒的复制至关重要[5-6]。唐青海等人的研究表明,CSFV NS2蛋白能够诱导细胞周期阻滞于S期[3],对猪血管内皮细胞(SUVEC)的增殖活性具有一定的抑制作用,能够上调SUVEC表面黏附分子integrin β3、趋化因子IL-8、抗凋亡蛋白Bcl-2的表达。同时CSFV NS2蛋白能够引起宿主细胞内质网应激反应,激活核转录因子NF-к B信号通路。CSFV NS2蛋白不仅对病毒的复制具有间接辅助作用,而且其在病毒诱导的炎症反应中也扮演中重要角色,该蛋白在CSFV的持续感染中亦可能具有重要作用。其是病毒与宿主的相互关系、病毒编码蛋白与宿主细胞内分子之间的相互作用网络、病毒编码蛋白和宿主分子对病毒生活周期的调控机制等方面的研究才刚刚起步。以上问题的解决需要应用抗NS2的抗体,然而,由于NS2蛋白极易降解,而且其对细菌具有毒性,所以,目前还没有针对NS2蛋白的商品化的单克隆抗体[7],这给进一步研究带来的一定的困难。所以本研究并没有用NS2全长只选取了NS2基因C端的一部分作为原核表达。
我们实验室以CSFV NS2-C363为诱饵蛋白通过酵母双杂交方法从猪血管内皮细胞cDNA文库中筛选到12个与CSFV NS2-C363蛋白互作用的阳性克隆。鉴于酵母双杂交系统的假阳性,需要进一步的验证具体哪些蛋白与NS2-C363蛋白相互作用。故需要NS2-C363蛋白作为研究材料对相互作用的蛋白进行下一步的验证。
重组蛋白经Western blot检测证明,目的蛋白能与标签蛋白结合并与特异性抗体结合,具有良好的抗原性,为下一步制备抗体和纯化NS2-C363蛋白奠定了基础。
[1] Francki R,Fauguet C M,Knudson D,et al.Flaviviridae[J].Arch Virol Suppl,1991,2:223-233.
[2] Lackner T,Thiel H J,Tautz N.Dissection of a viral autoprotease elucidates a function of a cellular chaperone in proteolysis[J].Proc Natl Acad Sci U S A,2006,103(5):1510-1515.
[3] Tang Q H,Zhang Y M,Fan L,et al.Classic swine fever virus NS2 protein leads to the induction of cell cycle arrest at S-phase and endoplasmic reticulum stress[J].J Virol,2010,7:4.
[4] Tang Q H,Zhang Y M,Xu Y Z,et al.Up-regulation of integrin beta 3expression in porcine vascular endothelial cells cultured in vitro by classical swine fever virus[J].Vet Immunol Immunopathol,2010,113:237-242.
[5] Agapov E V,Murray C L,Frolov I,et al.Uncleaved NS2-3 is required for production of infectious bovine viral diarrhea virus[J].J Virol,2004,78(5):2414-2425.
[6] Moulin H R,Seuberlich T,Bauhofer O,et al.Nonstructural proteins NS2-3 and NS4A of classical swine fever virus:essential features for infectious particle formation[J].Virology,2007,365(2):376-389.
[7] Lackner T,Thiel H J,Tautz N.Dissection of a viral autoprotease elucidates a function of a cellular chaperone in proteolysis[J].Proc Natl Acad Sci U S A,2006,103(5):1510-1515.
[8] Peter K,Karl-Josef D.Identification of DNA-binding proteins and protein-protein interactions by yeast one-hybrid and yeast two-hybrid screen[J].Methods Mol Biol,2010,639:171-192.
[9] 孔 建,沈君豪,黄 勇,等.甲型H1N1流感病毒非结构蛋白NS1与人CPSF30结合拮抗剂筛选模型的建立及药物筛[J].药学学报,2010,45(3):388-394.
[10] Pajunen M,Poussu E,Turakainen H,et al.Application of Mu in vitro transposition for high-precision mapping of protein-protein interfaces on a yeast two-hybrid platform[J].Methods,2009,49(3):255-262.
[11] Ilya S.Yeast two-hybrid system for studying protein-protein interactions-stage 1:Construction and characterization of a bait protein[J].Cold Spring Harb Protoc,2010(5):5429.
