人IL-1Ra基因的克隆及原核表达的研究
2011-03-07矫洪涛刘忠华向文胜
双 宝,李 明,李 慧,矫洪涛,王 晴,刘忠华,向文胜*
(1.东北农业大学生命科学学院,哈尔滨 150030;2.东北农业大学司法鉴定中心,哈尔滨 150030)
白细胞介素-1(IL-1)是最早被发现的细胞因子之一,人们对它的认识已有三十多年了[1]。随着分子生物学和现代免疫学的发展,人们对IL-1的认识也在不断加深。目前认为IL-1不仅仅具有十分重要的免疫调节作用,而且和许多疾病的发生、发展有着十分密切的关系。特别是作为炎症反应中的一个关键因子,它在各类炎性疾病中的作用更不容忽视。大量的研究结果表明,人类的许多疾病都伴有局部或全身的IL-1水平升高[2-5]。IL-1Ra是第一个被发现的天然存在的细胞因子拮抗剂,是体内天然存在的拮抗IL-1生物活性的一种糖蛋白,由152个氨基酸组成,具有与IL-1Beta相似的结构,但结合于IL-1受体后不会引起IL-1效应[6]。它为人类进一步了解细胞网络的调节机制提供了新的思路。而其独特的生物学活性,为人类征服由于IL-1异常升高而导致的各类疾病提供了新的治疗手段。
本试验克隆、表达了IL-1Ra,为IL-1Ra重组菌的高密度发酵提供了菌株,为IL-1Ra的进一步研究应用奠定了基础。
1 材料与方法
1.1 胎盘组织
取新鲜的胎盘组织(由哈尔滨医科大学提供),总量200 mg。取出后置-70℃保存,一周内使用。
1.2 菌株和质粒
pGEM-T vector(购于Promega公司);pBV220质粒载体和菌株E.coli XL1-Blue及E.coli DH5α是本实验室保存。
1.3 工具酶和试剂
总RNA提取试剂盒TRIzol Reagent、RT-PCR一步反应试剂盒(购自GIBCO-BRL公司);DEPC(购自Invitrogen公司);DNAmarker DL2000(购自大连宝生物);pp20-低分子质量蛋白质marker II(购自Tiangen博迈德生物);其他试剂均为Sigma公司或国产分析纯生化试剂。
1.4 PCR引物
根据已报道的人IL-1Ra基因序列gi:32576的成熟肽设计PCR引物,引物在上海生工合成。其中5′引物中导入Eco RⅠ酶切位点,3′引物中导入PstⅠ酶切位点(划线部分)。
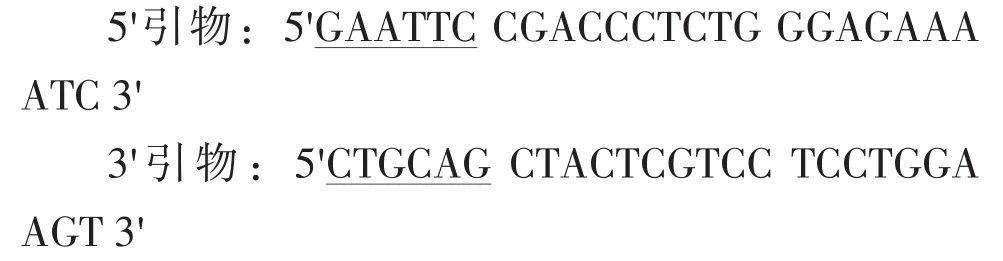
1.5 胎盘组织总RNA的制备
取胎盘组织100 mg放入1.5mL EP管中,加入1mL TRIzol溶液,冰浴中匀浆数次后静置5 min,2~8 ℃ 12000 r·min-1离心10 min,取下层匀浆液移至新EP管中加入200μL氯仿,快速震荡15 s后室温放置3 min,2~8 ℃ 11000 r·min-1离心15 min,吸取水相,加入500μL异丙醇,混匀后室温放置10 min,2~8 ℃ 11000 r·min-1离心10 min,75%乙醇1mL洗涤沉淀,2~8 ℃ 7500 r·min-1离心5 min,弃乙醇真空抽干,溶于20μL无RNA酶的水中,-20℃保存备用。
1.6 逆转录-聚合酶链式反应(RT-PCR)
取5μL所提取的胎盘组织总RNA为模板,利用RT-PCR一步反应试剂盒进行RT-PCR。
RT-PCR反应体系(50μL):2×Reaction Mix 25μL、 5'引 物(10μmol·L-1)1μL、 3'引 物(10μmol·L-1)1μL、RT/Taq Mix 1μL、模板 5μL、加水到50μL。
反应步骤:50℃反应20 min;94℃2 min后进入以下程序:变性94℃15 s,退火55℃30 s,72℃延伸45 s,扩增35个循环后72℃延伸15 min。
1.7 RT-PCR产物回收
依照鼎国生物工程公司DNA片段快速回收试剂盒操作说明进行。
1.8 测序质粒构建
将获得的人IL-1Ra基因PCR回收产物连入测序载体中。
连接反应体系(10μL):pMD18-T Vector 1μL、纯化的IL-1Ra PCR产物4μL、SolutionⅠ 5μL。以上连接体系16℃反应30 min后转化XL1-Blue感受态细菌,37℃培养过夜。
1.9 表达质粒的构建
分别将测序正确的pGEM-IL-1Ra质粒和大肠杆菌pBV220载体质粒用Eco RⅠ、PstⅠ进行双酶切,37℃酶切过夜,回收片断,进行片断连接;转化XL1-Blue感受态细胞后提取质粒,通过PCR和Eco RⅠ-PstⅠ双酶切鉴定。
1.10 重组蛋白诱导表达
将经PCR和Eco RⅠ-PstⅠ双酶切鉴定正确的pBV220-IL-1Ra阳性克隆转化到大肠杆菌DH5α感受态细胞中,挑取单克隆分别接种含100μg·mL-1氨苄青霉素(Amp)的液体LB培养基中,30℃振荡培养6 h后,42℃继续培养4 h。SDS-PAGE检测蛋白的表达情况。阴性对照为在同等条件下30℃培养的菌体,具体制样过程见1.11。
1.11 SDS-PAGE样品的制备
取0.6mL诱导后及对照的菌悬液,12000 r·min-1离心收集菌体,弃上清,用0.05mL的蒸馏水悬浮菌体,加入等体积的2倍上样缓冲液,轻轻混匀,沸水浴10 min,瞬时离心,取上清用作上样样品。
2 结果与分析
2.1 人IL-1Ra基因的克隆
以人胎盘组织中所提取的总RNA为模板逆转录后进行PCR反应,扩增产物经1%琼脂糖凝胶电泳后出现一条长度约460bp的DNA扩增产物,与预期大小相符(见图1)。回收RT-PCR产物,与pGEM Vector连接,转化感受态大肠杆菌XL1-Blue,中间载体命名为pGEM-IL-1Ra。采用PCR(见图2)和Eco RⅠ-PstⅠ酶切(见图3)方法鉴定,取1个含有插入片断的阳性克隆。
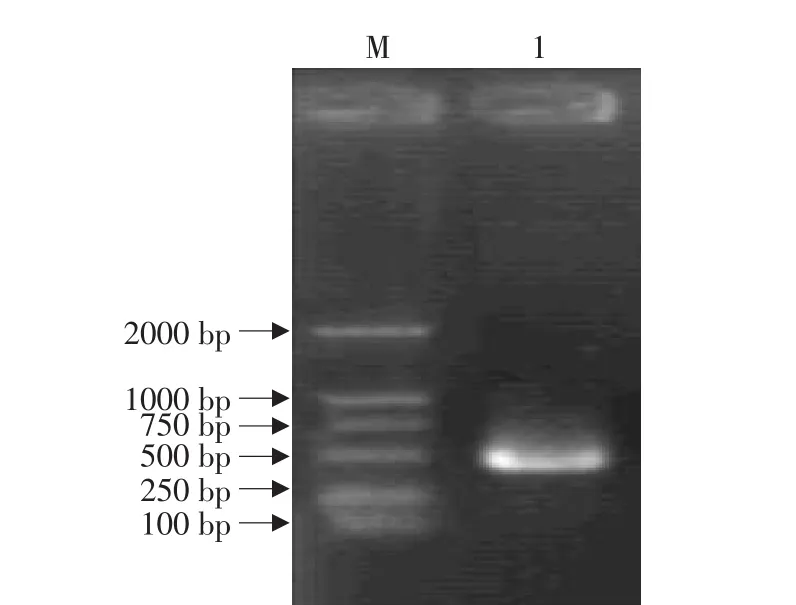
图1 RT-PCR的结果Fig.1 Result of RT-PCR

图2 重组质粒的PCR鉴定Fig.2 PCR assay of recombinant plasmid
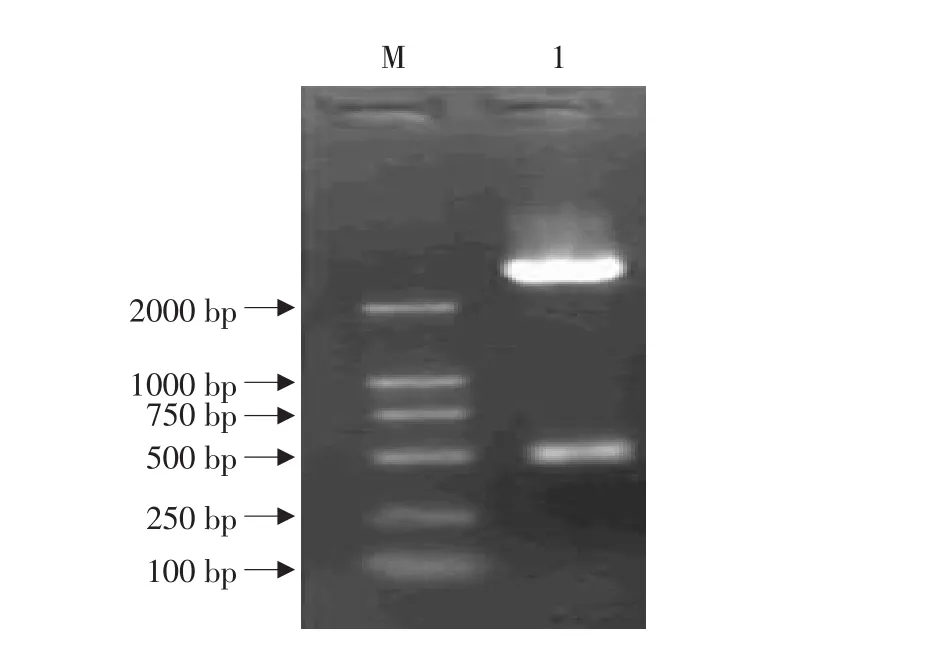
图3 重组质粒的双酶切鉴定Fig.3 Digest assay of recombinant plasmid by Eco RⅠ-PstⅠ
2.2 测序得到的结果及软件预测
用pGEM Vector的上游通用M13-47引物进行测序(由上海生工完成),结果见图4。
测序结果与基因序列gi:32576完全一致。该基因可编码152个氨基酸的蛋白质序列,通过软件DNAmaN预计蛋白质分子质量为17 ku。总氨基酸数:152,分子质量=17089 ku,最大开放阅读框起始于152氨基酸(456碱基)氨基酸位点1(或DNA位点1)。

图4 测序结果Fig.4 Sequence result
2.3 原核表达重组质粒的构建
将pGEM-IL-1Ra和表达载体pBV220用Eco RⅠ-PstⅠ消化后胶回收,连接、转化,重组载体命名为pBV220-IL-1Ra。PCR鉴定出阳性质粒pBV220-IL-1Ra两个(见图5),再用双酶切鉴定确定了这2个确为阳性质粒(见图6)。
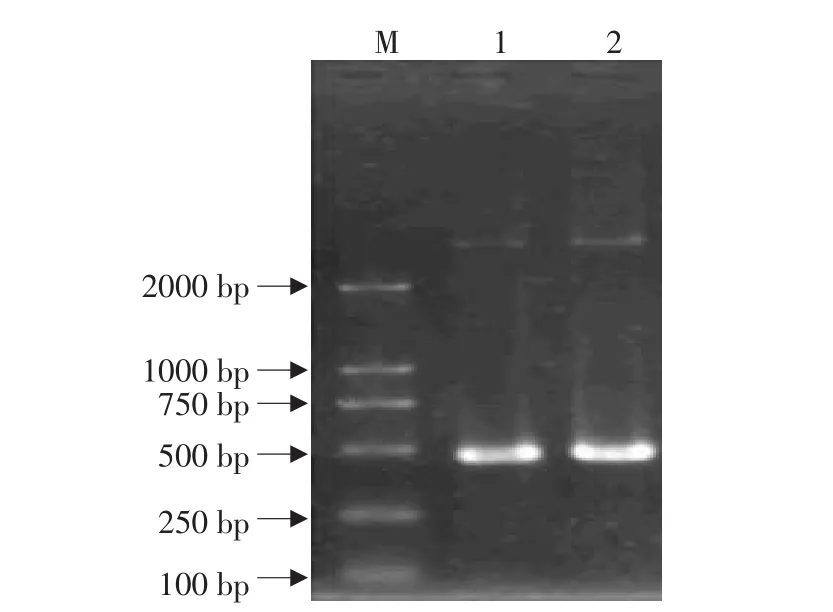
图5 重组质粒的PCR鉴定Fig.5 PCR assay of recombinant plasmid
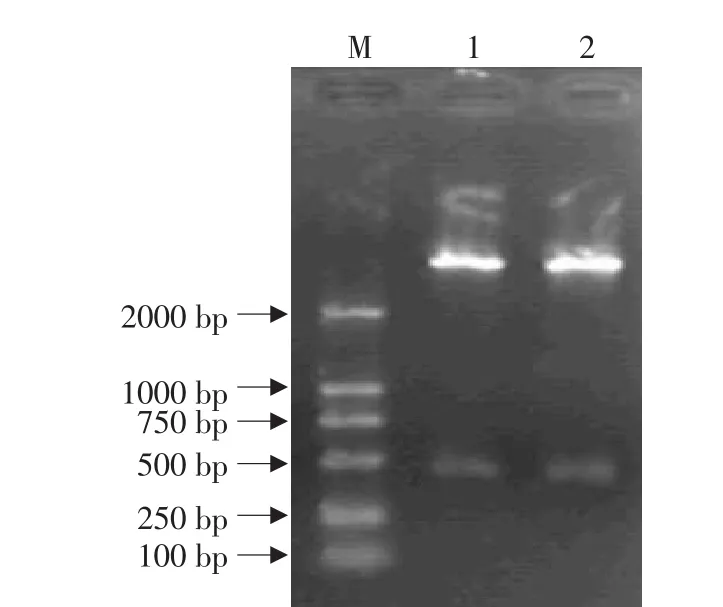
图6 重组质粒的双酶切鉴定Fig.6 Digest assay of recombinant plasmid by Eco RⅠ-PstⅠ
2.4 重组人IL-1Ra蛋白在大肠杆菌DH5α中的表达
将质粒pBV220-IL-1Ra转化大肠杆菌DH5α感受态细胞,挑取单克隆接种到含100μg·mL-1氨苄青霉素(Amp)的LB液体培养基中,30℃振荡培养6 h后,42℃继续培养4 h。SDS-PAGE检测蛋白的表达情况,鉴定表达产物。阴性对照为在同等条件下30℃培养的菌体。通过SDS-PAGE检测目的蛋白占菌体总蛋白的情况。由图6可知,诱导后的菌体蛋白在分子质量18 ku左右处有一特异性表达带,与预期的17 ku相符,而未经诱导的菌体蛋白在相应位置上没有特异性蛋白条带,说明我们将目的基因在原核生物中成功表达。再通过成像系统的灰度分析,我们得出,表达的目的蛋白占总蛋白的20%左右。
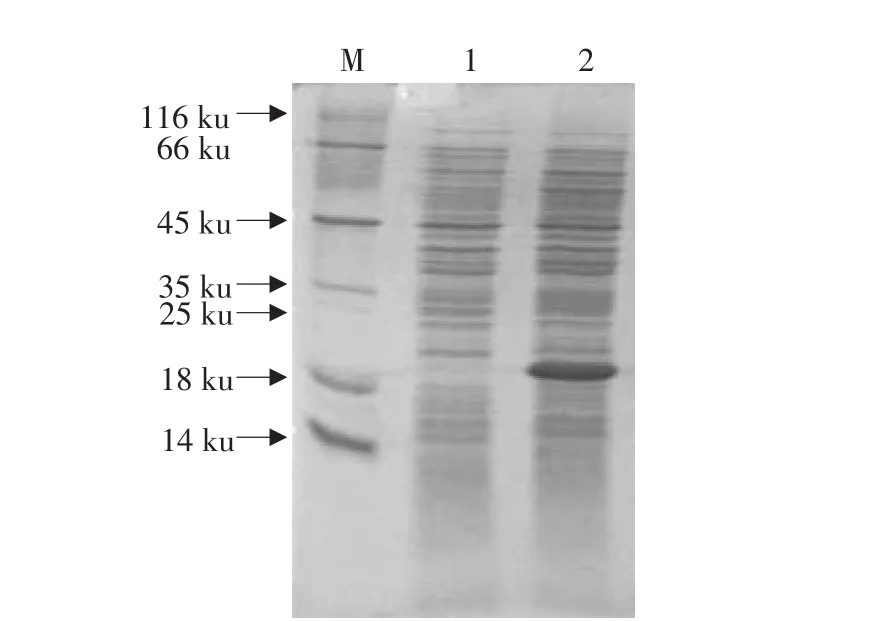
图7 表达蛋白SDS-PAGE分析Fig.7 SDS-PAGE analysis of expression protein
3 讨论
细胞因子一直是人们研究的热点。2009年朱慧萌等研究了人白细胞介素17及其家族[7]。同年,姜文博等研究了鸡IL-18基因的克隆表达[8]。IL1-Ra可以与IL1竞争受体从而缓解炎症反应,有望成为治疗类风湿性关节炎,结膜炎以及其他各种炎症的新型药物。所以摸索出一套大量制备IL1-Ra从而用于临床试验的方法十分重要。在国内,许多学者都对IL1-Ra进行了大量研究。李逸松等研究了人白细胞介素-1受体拮抗剂基因转染人颞颌关节软骨细胞的基因表达[9],发现转有白细胞介素-1受体拮抗剂基因的细胞与正常细胞相比有一定差异,但是关于该蛋白在真核细胞中的表达量和表达后对细胞的具体意义却缺乏探讨。李树刚等对人白细胞介素-1受体拮抗剂蛋白进行了初步的分离纯化及包涵体的变复性[6],结果得到了有部分活性的蛋白,然而他们对菌株的信息和诱导的方法描述不够。张学述对人白细胞介素-1受体拮抗剂进行和克隆和表达,但是蛋白的表达量不是很理想[10]。
本研究采用RT-PCR技术人从胎盘组织提取总RNA,克隆到了人IL1-Ra cDNA,序列分析显示与其他学者的研究结果相同。构建了表达质粒pBV220-IL1-Ra。将阳性质粒转化大肠杆菌DH5α感受态细胞,经30℃培养,42℃诱导,SDS-PAGE检测所获得的目的蛋白与预期一致,目的蛋白的表达效率在20%以上,得到了IL1-Ra高产菌株。这就为IL1-Ra的大量制备提供了前提。虽然原核表达的真核蛋白缺少一些特定位点的糖基化,但是只影响蛋白部分的活性[6],所以本研究结果为通过高密度发酵大量制备IL1-Ra以及IL1-Ra的进一步研究和应用奠定了基础。
4 结论
本文以人胎盘组织为材料,以从中所提取的总RNA为模板,通过RT-PCR克隆了IL1-Ra成熟肽的编码基因,总大小为456bp,其测序结果与基因序列gi:32576完全一致。将该基因重组表达于大肠杆菌中后,得到了大小约为18 ku的蛋白质,与推测的17 ku相符,经灰度比较发现该蛋白约占菌体总蛋白的20%左右。
说明我们成功的在大肠杆菌中高效表达了IL1-Ra,为IL-1Ra的进一步研究及应用奠定了基础。
[1]毕爱华.医学免疫学[M].北京:人民军医出版社,1995:68-70.
[2]Leonardi A,Borghesan F,DePaoli M,et al.Procollagens and infla-mmatory cytokine concentrations in tarsal and limbal vernal kera-toconjunctivitis[J].Exp Eye Res,1998,67(1):105-112.
[3]Sotozono C,He J,matsumoto Y,et al.Cytokine expression in the alkali-burned cornea[J].Cull Eye Res,1997,16(7):670-676..
[4]Shams N B,Reddy C V,Watanabe K,et al.Increased interleukin-1 activity in the injured vitamin A-deficient cornea[J].Cornea.1994,13(2):156-166..
[5]Black R A,Kronheim S R,Sleath P R.Activation of interleukin-1 beta by a co-induced protease[J].FEBS Lett.1989,247:386-390.
[6]李树刚,邓小燕,赵洪,等.用包涵体复性的方法制备重组人白细胞介素-1受体拮抗剂[J].生物医学工程学杂志,2007,24(5):1128-1132.
[7]朱慧萌,李德山.白细胞介素17及其家族[J].东北农业大学学报,2009,40(11):137-140.
[8]姜文博,孙进华,单安山.鸡IL-18基因的克隆表达及对新城疫疫苗诱导的HI抗体变化的研究[J].东北农业大学学报,2009,40(5):75-79.
[9]李逸松,田卫东,李声伟,等.人白细胞介素-1受体拮抗剂基因转染人颞颌关节软骨细胞的基因表达[J].华西口腔医学杂志,2006,24(4):300-302.
[10]张学述.人白细胞介素1受体拮抗剂cDNA克隆及其表达影响因素[J].微生物学免疫学进展,1999,27(2):25-27.
