植物生长素运输载体研究进展
2011-03-07陈晓阳谢文军罗海山罗红兵
陈晓阳,谢文军,罗海山,罗红兵*
植物生长素运输载体研究进展
陈晓阳1,谢文军2,罗海山1,罗红兵1*
(1湖南农业大学农学院,长沙 410128;2中国农业大学农学与生物技术学院,北京 100193)
生长素运输载体通过影响极性运输而作用于植物组织器官的形成、生长等过程。植物中存在三种类型生长素运输载体:AUX1(Auxin Resistant)蛋白、PIN (PIN-FORMED)蛋白家族和MDR/PGP(Multidrug-Resistant/ P-glycoprotein)蛋白家族。对拟南芥、玉米、水稻中生长素运输载体的最新研究进行了综述,并对未来可能研究领域提出了展望。
植物生长素;极性运输;运输载体
生长素是一类含有一个不饱和芳香族环和一个乙酸侧链的内源激素,主要在植物叶原基、幼叶、根以及发育的种子等部位合成[1]。它对植物的多个生长发育过程进行调控,包括株型形成[2,3],顶端优势,叶片发育[4]、微管束发育、胚胎发育等[5]。其运输方式与其它植物激素不同,为极性运输,即生长素在植物体内运输方向是单向的,只能从形态学上端向形态学下端运输。
生长素运输载体将生长素从植物体内的一个部位运输到另一个部位,从而形成了不同部位间生长素浓度差异。植物体内生长素运输载体类型很多,现已分离得到了多种生长素运输载体。研究表明,生长素运输载体通过介导其极性运输而影响植物正常生长与发育。笔者就拟南芥、水稻、玉米中生长素运输载体的最新研究进展进行简要综述。
1 拟南芥生长素运输载体
拟南芥由于基因组较小、生活周期短等特点,已成为植物分子生物学研究最佳模式作物。其体内生长素运输载体包括:AUX1蛋白、PIN家族蛋白和MDR/PGP蛋白家族。
1.1 输入载体AUX1
拟南芥AUX1蛋白是高等植物中第一个被报道的生长素输入载体,AUX1存在11个跨膜区域(图1)。对其等位基因研究发现,几乎全部功能缺失和无效等位基因簇都位于通透酶的中心区域,只有修饰外部的C末端区域,而错意突变扰乱了AUX1的活性[6]。AUX1能调节根中生长素的向基性运输和向顶性运输,引起不同部位间生长素浓度差异[7]。1999年,Marchant首次证明AUX1蛋白在根向地性反应中有重要作用,而这必须依赖于与输出载体的协同作用[8]。根系形成过程中,AUX1能促进生长素向叶片微管运输系统装载,加快从叶片合成部位输出的速度,同时也有利于生长素在主根顶部和侧根原基中卸载。突变将导致生长素源(叶片)、库(根)组织中生长素运输受破坏,引起根型发生改变[9]。在根细胞内部,质膜顶部和高尔基体复合体以及核内体都有AUX1分布,它们之间通过依赖于肌动蛋白的运输来相互联系,且其运输不受囊泡运输抑制剂布雷菲尔德菌素(BFA)和生长素输入抑制剂正辛胺(NOA)的影响,但被输出载体抑制剂2,3,5—三碘苯甲酸(TIBA)和对溴甲基异苯丙酸(PBA)阻挡。进一步研究表明,生长素运输抑制因子和质膜固醇能影响质膜中AUX1分布[10]。
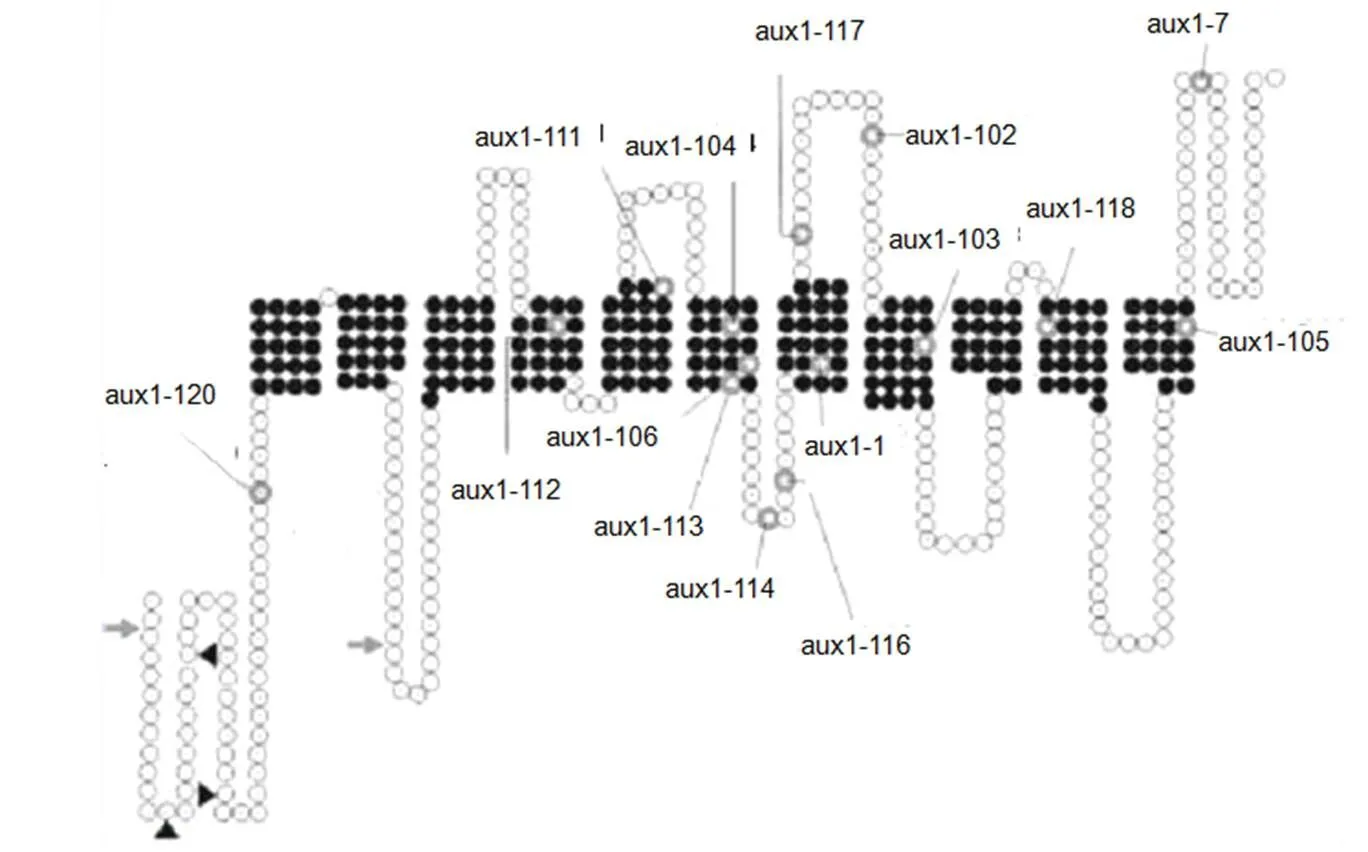
图1 AUX1二级结构预测图[6]
注:白色圈代表亲水区域;黑色圈环代表跨膜区域;白色圈加黑体外环代表15个aux1错配等位突变中的氨基酸替换点;黑色箭头代表N糖基化点
1.2 输出载体PIN蛋白家族
输出载体在细胞膜上的极性定位直接决定着生长素运输的方向。拟南芥PIN蛋白家族是研究得较好的一类输出载体蛋白,包括8个成员:PIN1~PIN8。所有PIN蛋白都是由两端疏水区和中间的亲水区构成。在疏水区C端与V2 区之间有一NPXXY (IM,图2)保守结构,它在PIN蛋白的内吞过程中有重要作用。在亲水区域,存在着糖基化位点和磷酸化位点[11]。用哺乳动物和酵母细胞对PIN蛋白功能研究中发现,PIN蛋白在不添加任何特殊植物因子下同样可以调节生长素输出。与输出载体PGP不同,PIN蛋白在生长素输出过程中具有限速功能,而且对生长素输出抑制因子敏感[12]。

图2 PIN蛋白的预测结构
H1,H2:疏水区域;C1, C2, C3:亲水环保守区域;V1, V2:亲水环可变区域;Gly/P:糖基化和磷酸化位点;IM:内吞作用调节点;N,C:蛋白的氨基端和羧基端。
是第一个从拟南芥中分离到的PIN家族突变体。AtPIN1在维管组织中负责生长素极性运输到细胞基部,突变将形成“针形”花序,侧生器官发育异常,这与用生长素运输抑制剂处理过后的表型相似[13,14]。在拟南芥突变体中,下胚轴细胞基部PIN1积累受到破坏,生长素横向运输增大,从而引起幼苗向地性和向光性增强[15]。这些结果表明PIN1对生长素的运输发挥着中心作用[16]。
AtPIN2在根皮层细胞中向顶分布,在根表皮细胞中向基分布。合理的膜固醇类物质组成对PIN2在根细胞内极性分布至关重要。在固醇合成突变体()中,固醇的组成、PIN2的内吞和根的向地性反应都发生了改变;细胞分裂完成后,野生型PIN2蛋白首先定位在新形成膜的两极,然后在某一极消失;而突变体中PIN2始终定位在膜的两极[17],说明固醇的组成可能是通过影响PIN2的内吞作用而调节它的极性定位。突变体表现为根向地性丧失,根中PIN2蛋白和生长素不对称分布被破坏[18]。Abas等[19](2006)深入研究了PIN2介导的根向地性发现:在重力刺激下,无论是用內源启动子还是异源启动子,PIN2在根上、下部都会形成不平衡分布,其上部有更多的PIN2蛋白被降解。这说明PIN2重新排布是由于转录后水平导致的。此外,胞内运输和蛋白酶体抑制剂能破坏PIN2的胞内定位、丰度、泛素化和不同细胞间的转运;突变体中PIN2蛋白重新分布和降解受到干扰,生长素的分配被破坏,造成根向重力性表型缺失。同时还发现生长素自身也能对PIN2的丰度进行调控。光照对PIN2的胞内运输有重要作用。光能促进PIN2在膜上定位,无光照条件下PIN2在囊泡隔间定位,定位部位改变主要是通过光调控的内吞运输完成的。内吞运输过程也受泛素26S蛋白酶体的影响,蛋白酶体抑制剂能损害这一过程[20]。上述研究说明具有分配与根向地生长有关生长素的功能,且其质膜定位和胞内运输受多种因素调节。
在感受重力刺激组织中表达,在细胞侧面大量积累。在正常生长过程中,PIN3蛋白均匀地分布于细胞质膜两侧。在重力刺激下,肌动蛋白能迅速调节PIN3质膜和囊泡之间运输,在细胞内重新定位PIN3,从而改变生长素流的运输,引起不对称生长;而突变体的生长则减弱,丧失向地和向光反应[21]。这些现象说明PIN3是横向生长素运输系统中一个重要组成部分。
PIN4分布于根分生组织中,介导生长素下沉至根尖生长点静止中心以下的浓度中心的过程。突变体胚根和幼苗根中,內源生长素梯度缺失,根型被破坏[22]。PIN5是一类非典型的生长素运输载体,分布于内质网上,控制生长素由胞液向内质网腔运输[23],因而对胞内生长素的稳定和代谢具有调控作用。PIN7定位在基部细胞质膜的上表面,调节胚轴的形成和根中生长素的向顶式运输[24]。
1.3 输出载体MDR/PGP蛋白家族
拟南芥输出载体除了PIN蛋白家族外,最近研究发现多重抗药性/磷酸糖蛋白家族(Multidrug-Resistant/P-glycoprotein,MDR/PGP)也参与了生长素极性运输。它是ATP结合盒(ATP—binding cassette,ABC)转运蛋白超级家族中的一个亚家族,其中,主要研究对象为PGP1(ABCB1)、PGP4(MDR4)和PGP19(MDR1/ABCB19)[25]。典型的ABC转运蛋白包含4个区域(两个膜结合区域,两个ATP结合区域),它们之间有6种结合形式[26]。
AtMDR1与AtPGP1高度同源,在突变体和双突变体中,向基性生长素运输活性受到了很大损害,导致突变体叶子形状发生了变化,顶端优势减弱。和基因能编码一种与生长素运输抑制剂萘基邻氨甲酰苯甲酸(NPA)紧密并特异性结合蛋白,这种蛋白对生长素正常分布和植物发育必不可少[27]。Wu、Lewis等发现MDR1在拟南芥根生长发育中具有重要作用。拟南芥突变体中,21%的侧根生长原基未进入伸长阶段,导致突变体中侧根数目减少;进入伸长阶段的侧根生长原基伸长速度也比野生型慢50%。报告基因分析表明,侧根中生长素向顶运输降低了40%,导致侧根根尖中生长素严重缺乏。用生长素运输抑制剂处理后表型与突变型相似,施用生长素能使突变体伸长减慢表型得以恢复。MDR1蛋白定位于主根和侧根中与向顶性运输有关的组织[28]。这些结果证明MDR1通过介导生长素向顶运输而调节拟南芥根系发育。正常生长条件下,突变体根产生比野生型大三倍弯曲,但重力刺激下向地性几乎无变化[29],说明生长素向顶性运输是保持根直立生长所必要的,但对向地性影响较小。
在拟南芥根冠和根表皮细胞中强烈表达,在根冠细胞中无极性定位,在根部其它细胞中存在极性定位。突变体主根明显变短,从茎到根的生长素向基运输显著减少,相应的根尖到根基的生长素向基运输强度也有所减少;而过量表达的植株从茎到根的生长素向基运输以及从根尖到根基的向基运输都增加到对照的2倍多[30],说明PGP4在根茎向基性运输中发挥作用。同时过表达植株还表现为根毛缩短,施用生长素或生长素输出抑制剂能使过表达表型恢复,暗示着PGP4是一种生长素输出载体,能使根毛细胞中生长浓度降低,从而抑制根毛的伸长[31]。将转入哺乳动物细胞,过量表达细胞的[3H]IAA与对照相比明显升高[30],证明PGP4可能有生长素输入载体功能。突变对根向地性也有影响,但不同研究者所获结果却不一致。Lewis认为突变体重力性增强[29],而Terasaka所获结果相反[30]。MDR/PGP4作为具有双重运输载体功能的蛋白,对它进行深入研究,将丰富我们对载体蛋白介导的生长素极性运输机理的了解。
PGP19能和PIN1在质膜上结合并相互作用,增加生长素输出的特异性和速率[32]。最近研究表明[33],定位于内质网上的TWD1亲免蛋白能破坏MDR/PGP蛋白质膜定位。
2 水稻、玉米生长素运输载体
近年来,应用生物信息学结合遗传学的方法,在水稻、玉米发现了许多与生长素运输有关的载体。张俊红等利用已经分离的小麦生长素()基因的保守序列为检索序列, 在TIGR的全基因组注释数据库中筛选得到8条水稻基因非冗余序列。水稻中有12个基因具有编码生长素输出载体蛋白的功能,其中只有一个基因与拟南芥家族基因没有同源性[34]。RT-PCR和GUS实验结果表明,它们大部分基因表达具有组织特异性[35,36]。是水稻中已克隆且影响生长素输出的基因,它在维管组织和根原基表达。在RNAi转基因株系里,不定根的发生和发育被显著抑制,表现出类似于野生型植株被生长素抑制剂NPA处理后的表型。萘乙酸(α-NAA)处理可以回复RNAi转基因植株的表型。过量表达或抑制表达,会导致转基因植株分蘖数目和根冠比发生变化[37]。这些充分说明在依赖生长素的不定根和分蘖发生的过程中起着重要的作用。
应用与拟南芥同源的玉米cDNA,分离得到了ZmAUXI。氨基酸序列分析表明,ZmAUX1和AtAUX1中73%序列相似,推测其有7~10个跨膜区域。同时能在所有类型根的根尖中表达,在主根中表达时具有较高的组织特异性[38]。玉米中存在3种拟南芥PIN家族同源蛋白:,,,分别定位于第9,5和4号染色体。编码601个氨基酸,编码595个氨基酸,分别与具有70.4%和70.9%的同源性。在B73植株不同组织和不同发育阶段,和都能显示出不同的表达特性,但两者之间没有明显区别。ZmPIN1a和ZmPIN1b蛋白主要定位于表皮下的分生组织层,基因编码蛋白能影响它们的形成和定位[39]。在玉米籽粒发育过程中,首先在胚乳中表达;对ZmPIN1蛋白研究发现,其极性定位与细胞和组织分化有关[40]。能使拟南芥植株生长素极性运输破坏表型得以恢复,进一步证明具有生长素极性运输载体的功能[41]。
BR2是一种从玉米中分离出来并与AtPGP1同源的MDR/PGP蛋白。突变体表现为茎下部节间变短,微管系统的结构、数量,叶片形态改变。生长素、赤霉素、细胞分裂素都不能使突变表型恢复,暗示着BR2没有参与这些生物调节因子生物合成过程。基因表达分析实验表明在茎秆节内表达,节间不表达。进一步研究发现突变体细胞伸长和体内生长素运输都受到抑制,特别是从节到节间的生长素运输[42,43]。是一种与同一类型突变体,双突变体比突变体株高更矮,幼苗和胚胎发育都发生了不同程度的变异。基因表达分析表明,能上调表达[44]。这些结果表明在生长素运输中发挥着重要作用。
3 展 望
多年来,人们对生长素运输载体及其对植物生长发育的作用机制有了进一步认识。但对某些载体蛋白(如PIN6、PIN8)的功能知之甚少。生长素通过运输载体完成运输过程,但各载体如何协调生长素运输以及生长素在胞内具体运输过程了解有限。载体定位对生长素运输方向至关重要,载体定位机理和影响载体定位的因素有待进一步研究。
生长素在茎叶等幼嫩组织形成后,形成经中央维管组织由茎向下部的向基运输;在根部,生长素存在两种运输方式:一是生长素通过中柱向根尖的向顶运输,二是根尖生长素经表皮和皮层细胞回运的向基运输[45]。生长素在根茎运输方式的差异,主要是由于运输载体组织表达差异和极性定位差异造成的。在根中,PIN1和PIN4共同完成生长素向顶运输,PIN2和PIN3完成向基运输[46]。人们通过大量实验已获知根部运输载体中任何一个突变都会造成根异常表型,且对它们影响根生长发育机理有了较深的认识。而在茎中,这些方面所获得的结果还较少。因此,通过分离相关突变体,对茎部运输载体介导生长素极性运输及其与茎生长发育关系进行研究,将丰富对茎中生长素运输和茎发育机制的了解。
目前,通过T-DNA插入、Mu突变和化学诱变等手段,鉴定和分离了多种类型拟南芥生长素运输载体,并对其功能和内部运输机制进行了验证,而其它类作物的研究十分有限。由于生长素合成、运输和信号转导在双子叶和单子叶植物之间存在一定的保守性[5],因此我们可以利用同源克隆等方法,从禾谷类作用中分离更多的运输载体,结合分子生物学等现代技术对其进行研究,对全面认识生长素运输载体和植物生长发育内部机理具有十分重要的意义。
[1] 刘士平,王璐,王继荣,等.高等植物的PIN基因家族[J].植物生理学通讯,2009,45(8):833-841.
[2] Wang YH,Li JY.Molecular basis of plant architecture [J].Annu Rev Plant Biol,2008,59:253-279.
[3] 王冰,李家洋,王永红.生长素调控植物株型形成的研究进展[J].植物学通报,2006,23(5):443-458.
[4] 李林川,瞿礼嘉.生长素对拟南芥叶片发育调控的研究进展[J].植物学通报,2006,23(5):459-465.
[5] McSteen P.Auxin and monocot development[J].Cold Spring Harb Perspect Biol,2010,(2):1-18.
[6] Swarup R,Kargul J,Marchant A,et al. Structure-function analysis of the presumptive Arabidopsis auxin permease AUX1[J].Plant Cell,2004,16:3069-3083.
[7] Swarup R,Friml J,Marchant A,et al.Localization of the auxin permease AUXI suggests two functionally distinct hormone transport pathways operate in theroot apex[J].Genes Dev,2001,15:2648-2653.
[8] Marchant A,Kargul J,May ST,et al.AUX1 regulates root gravitropism inby facilitating auxin uptake within root apical tissues[J].EMBO J,1999,18:2066-2073.
[9] Marchant A,Bhalerao R,Casimiro I,et al.AUX1 promotes lateral root formation by facilitating indole-3- acetic acid distribution between sink and source tissues in the Arabidopsis seedling[J].Plant Cell,2002,14:589-597.
[10] Kleine-Vehn J,Dhonukshe P,Swarup R,et al.Subcellular trafficking of theauxin influx carrier AUX1 uses a novel pathway distinct from PIN1[J].Plant Cell,2006,18:3171-3181.
[11] Zazimalova E,Krecek P,Skupa P,et al.Polar transport of the plant hormone auxin the role of PIN-FORMED (PIN) proteins[J]. Cell Mol Life Sci,2007,64:1621-1637.
[12] Petrásek J,Mravec J,Bouchard R,et al.PIN proteins perform a rate-limiting function in cellular auxin efflux[J].Science,2006,312:914-918.
[13] Okada K,Ueada J,Komaki MK,et al.Requirement of the auxin polar transport system in early stages offloral bud formation[J].Plant Cell,1991,(3):677-684.
[14] Gaiweiler L,Guan C,Muiier A,et al.Regulation of polar auxin transport by AtPIN1 invascular tissue[J].Science,1998,282:2226-2230.
[15] Noh B,BandyOpadhyay A,Peer WA,et al.Enhanced gravi-and phototropism in plant mdr mutants mislocalizingthe auxin efflux protein PIN1[J].Nature,2003,423:999-1002.
[16] Geldner N,Friml J,Stierhof YD,et al.Auxin transport inhibitors block PIN1 cycling and vesicle trafficking[J]. Nature,2001,413:425-428.
[17] Men S,Boutté Y,Ikeda Y,et al.Sterol-dependent endocytosis mediates post-cytokinetic acquisition of PIN2 auxin efflux carrier polarity[J].Nature Cell Biology,2008,10:237-244.
[18] 潘建伟,叶晓帆,王超,等.拟南芥PIN2介导的生长素极性运输调控植物根向地性[J].浙江师范大学学报:自然科学版,2010,33(1):1-6.
[19] Abas L,Benjamins R,Malenica N,et al.Intracellular trafficking and proteolysis of theauxin-efflux facilitator PIN2 are involved in root gravitropism[J].Nature Cell Biology,2006,(8):249-256.
[20] Laxmi A,Pan J,Morsy M,et al.Light plays an essential role in intracellular distribution of auxin efflux carrier PIN2 inthaliana[J].ONE,2008,3(1): 1510.
[21] Friml J,Wisniewska J,Benkova E,et al.Lateral relocation of auxin efflux regulator PIN3 mediates tropism in[J].Nature,2002,415:806-809.
[22] Friml J,Benkova E,Blilon I,et al.AtPIN4 mediates sink driven auxin gradients and patterning inroots[J].Cell,2002,108:661-673.
[23] Mravec J,Skůpa P,Bailly A,et al.Subcellular homeostasis of phytohormone auxin is mediated by the ER-localized PIN5 transporter[J].Nature,2009,459:1136-1140.
[24] Friml J.Auxin transport- shaping the plant[J].Current Opinion In Plant Bio1ogy,2003,6:7-12.
[25] 李运合,孙光明,吴蓓.植物生长素的极性运输载体研究进展[J].西北植物学报,2009,29:1714-1722.
[26] Higgins CF.ABC transporters: physiology,structure and mechanism an overview[J].Res Microbiol,2001,152:205-210.
[27] Noh B,Murphy AS,Spalding EP.Multidrug resistance- like genes ofrequired for auxin transport and auxin-mediated development[J].Plant Cell,2001,13:2441-2454.
[28] Wu G,Lewis DR,Spalding EP.Mutations inmultidrug resistance-like ABC transporters separate the roles of acropetal and basipetal auxin transport in lateral root development[J].Plant Cell,2007,19:1826-1837.
[29] Lewis DR,Miller ND,Splitt BL,et al.Separating the roles of acropetal and basipetal auxin transport on gravitropism with mutations in twomultidrug resistance- like ABC transporter genes[J].Plant Cell,2007,19: 1838-1850.
[30] Terasaka K,Blakeslee JJ,Titapiwatanakun B,et al.PGP4,an ATP binding cassette P glycoprotein,catalyzes auxin transport inthaliana roots[J].Plant Cell,2005,17:2922-2939.
[31] Cho M,Lee SH,Cho HT.P-Glycoprotein 4 displays auxin efflux transporter like action inroot hair cells and tobacco cells[J].Plant Cell,2007,19: 3930-3943.
[32] Titapiwatanakun B,Blakeslee JJ,Bandyopadhya A,et al. ABCB19/PGP19 stabilises PIN1 in membrane microdomains in[J].Plant J,2009,57:27-44.
[33] Wu G,Otegui MS,Spalding EP.The ER-Localized TWD1 immunophilinis necessary for localization of multidrug resistance-like proteins required for polar auxin transport inroots[J].Plant Cell,2010,22: 1057-1073.
[34] 张俊红,孟成生,张彩英,等.小麦和水稻基因家族的生物信息学比较分析[J].华北农学报,2009,24(6):15-19.
[35] Miyashita Y,Takasugi T,Ito Y.Identification and expression analysis of PIN genes in rice[J].Plant Science,2010,178:424-428.
[36] Wang JR,Hu H,Wang GH,et al.Expression of PIN genes in rice (L.):tissue specificity and regulation by hormones[J].Molecular Plant,2009,(2):823-831.
[37] Xu M,Zhu L,Shou H,et al.A PIN family gene,OsPIN1,involved in auxin dependent adventitious root emergence and tillering in rice[J],Plant Cell Physiol,2005,46:1674-1681.
[38] Frank H,Dörte W,Katrin R,et al.Tissue-specific expression of AUX1 in maize roots[J].Journal of Plant physiology,2000,157:315-319.
[39] Carraro N,Forestan C,Canova S,et al.ZmPIN1a and ZmPIN1b encode two novel putative candidates for polar auxin transport and plant architecture determination of maize[J].Plant Physiol,2006,142:254-264 .
[40] Forestan C,Meda S,Varotto S.ZmPIN1-mediated auxin transport is related to cellular differentiation during maize embryogenesis and endosperm development[J].Plant Physiol,2010,152:1373-1390.
[41] Gallavotti A,Yang Y,Schmidt RJ,et al.The relationship between auxin transport and maize branching[J]. Plant Physiol, 2008,147:1913-1923.
[42] Multani DS,Briggs SP,Chamberlin MA,et al.Loss of an MDR transporter in compact stalks of maize br2 and sorghum dw3 mutant[J].Science,2003,302:81-84.
[43] Knoller AS,Blakeslee JJ,Richards EJ,et al. Brachytic2/ZmABCB1 functions in IAA export from intercalary meristems[J].Journal of Experimental Botany,2010,61(13):3689-3696.
[44] Cassani E,Villa D,Durante M,et al.The brachytic 2 and 3 maize double mutant shows alterations in plant growth and embryo development[J].Plant Growth Regulation,2010,64(2):185-192.
[45] 李俊华,种康.植物生长素极性运输调控机理的研究进展[J].植物学报,2006,23(5):466-477.
[46] 刘进平.生长素运输机制研究进展[J].中国农学通报,2007,23(5):432-433.
责任编辑:曾凡盛
Advances on Carriers of PlantTransport
CHEN Xiao-yang1, XIE Wen-jun2, LUO Hai-shan1, LUO Hong-bing1*
(1 College of Agronomy, Hunan Agricultural University, Changsha, Hunan 410128, China; 2 College of Agriculture and Biotechnology, China Agricultural University,Beijing 100193, China)
Auxin transport carriers modulate organogenesis and growth by affecting polar auxin transport. Three types of auxin transport carriers have been identified: AUX1 (Auxin Resistant) protein、PIN (PIN-FORMED) protein families and MDR/PGP(Multidrug-Resistant/P-glycoprotein) protein families.Recent advances ontransport carriers in Arabidopsis, Maize,Rice are summarized,and research perspectives in this field are discussed in this review.
Plant; Polar transport; Transport carriers
Q945;Q789
A
1001-5280(2011)06-0604-06
10.3969/j.issn.1001-5280.2011.06.21
2011-07-28
陈晓阳(1985—),男,湖南湘潭人,硕士研究生,Email:cxy759020@163.com。
,Email:hbluo48@sohu.com。
2010年湖南省研究生科研创新项目(CX2010B305)。
