降浊化瘀合剂对2型糖尿病合并非酒精性脂肪肝大鼠糖脂代谢和胰岛素敏感性的影响*
2011-03-01彭继升杨晋翔高彦彬
彭继升,杨晋翔,高彦彬
胰岛素抵抗(IR)在2型糖尿病(T2DM)和非酒精性脂肪肝(NAFLD)的发病机制中占据着重要地位,可以说是IR将二者联系起来。血糖和血脂的代谢紊乱是糖尿病的重要特征,而NAFLD正是由于脂质代谢紊乱而引起的肝脏脂肪变性,血糖的异常也必然影响到脂代谢的紊乱。本实验观察了降浊化瘀合剂对T2DM合并NAFLD大鼠糖脂代谢和胰岛素敏感指数(HOMA-IR)的影响。
1 材料与试剂
1.1 动物及饲料
清洁级雄性 SD大鼠40只,体重150g~190g,由北京维通利华实验动物技术有限公司提供;动物饲料由北京科澳协力饲料有限公司提供,改进高脂饲料构成比为2%胆固醇,0.5%胆酸钠,0.2%丙硫氧嘧啶,5%蔗糖,10%猪油,82.3%基础饲料;普通高脂饲料构成比为2%胆固醇,10%猪油,88%基础饲料。
1.2 主要试剂
链脲佐菌素(STZ)由美国 Sigma公司提供,临用时以0.1mol/L柠檬酸钠-柠檬酸缓冲液 pH 4.4配成1%STZ溶液;马来酸罗格列酮(文迪雅)由葛兰素史克(天津)有限公司生产,规格 4mg/片;降浊化瘀合剂(由柴胡、枳实、茵陈、泽泻、熟军、全栝楼、丹参等按一定比例组成),由北京中医药大学东方医院制剂中心提供,用煎煮法浸提浓缩至稠膏状,以蒸馏水稀释成2g生药/ml的浓度;游离脂肪酸(FFA)酶联免疫试剂盒由美国GBD公司提供;胰岛素放免检测试剂盒由解放军总医院科技开发中心放免研究所提供。
2 方法
2.1 造模方法及分组处理
将40只雄性SD大鼠适应性饲养基础饲料7d后,按体重随机分为2组,正常组8只,高脂组32只。正常组喂养基础饲料,高脂组喂养改进高脂饲料,高脂组大鼠喂养4周后随机处死2只,取肝脏组织进行HE染色,观察肝脏组织形态学改变(见图1、图2)。3d后各组大鼠禁食12h,高脂组给予一次性腹腔注射 STZ 30mg/kg,正常组给予同等体积的枸橼酸缓冲液腹腔注射。注射48h后,各组大鼠禁食12h后断尾取血,测空腹血糖(FPG)、空腹胰岛素水平(FINS)。以空腹血糖高于7.8mmol/L作为T2DM诊断的血糖标准,并计算胰岛素敏感指数(HOMA-IR),以判定胰岛素抵抗状态诱导成功。高脂组大鼠肝脏形态学符合NAFLD病理改变(见图1、图2),血糖全部符合 T2DM诊断标准,且 FINS、HONA-IR均明显高于正常组(见表1),全部符合造模要求,至此T2DM合并NAFLD大鼠造模过程结束。
将造模成功大鼠按1∶1∶1比例随机分为模型组、中药组和西药组。中药组给予降浊化瘀合剂10ml/kg/d(生药20g/kg/d)灌胃,西药组给予文迪雅2mg/kg/d灌胃,模型组和正常组灌服蒸馏水10ml/kg/d。正常组仍给予基础饲料喂养,模型组、中药组、西药组给予高脂饲料喂养,连续给药观察8周。末次给药后空腹过夜,以0.4%水合氯醛腹腔注射进行麻醉,经腹主动脉取血,收集血清用于指标的测定,取肝备用,HE染色,进行病理学观察。
2.2 检测方法
空腹血糖(FPG)、血清三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)和高密度脂蛋白(HDL-C)经全自动生化仪(日立7600)检测;空腹胰岛素(FINS)用放免法,FFA采用酶联免疫法,均严格按试剂盒说明书进行。胰岛素抵抗指数计算(HOMA-IR)=FINS×FBG/22.5。
2.3 统计学方法
应用SAS 8.0统计软件包进行,计量资料以珋x±s表示;2组间比较用 t检验,多组间比较采用方差分析,两两比较用q检验。治疗前后比较采用配对t检验,组间比较采用one-way ANOVA检验;计数资料用χ2检验,等级资料用Wilcoxon秩和检验。
3 结果
3.1 T2DM合并NAFLD大鼠模型的建立
3.1.1 肝脏组织HE染色 喂养4周后,正常组肝小叶结构清晰完整,肝细胞索以中央静脉为中心呈放射状排列,肝细胞形态正常;肝窦正常,连接成网状(见图1)。高脂组肝细胞内出现大量大小不一的脂肪空泡,符合NAFLD病理改变(见图2)。

图1 正常组肝组织(HE染色×200)

图2 高脂组肝组织(HE染色×200)
3.1.2 胰岛素抵抗情况 表1显示,大鼠高脂饲料喂养加小剂量STZ注射后,第5周所测血糖结果全部符合 T2DM诊断标准;其 FBG、FINS明显高于正常组(P<0.01),HOMA-IR也明显高于正常组大鼠(P<0.01)。

表1 FBG、FINS和HOMA-IR的比较(珋x±s)
3.2 药物干预后
3.2.1 对FPG、FINS和HOMA-IR的影响 表2显示,与正常组大鼠相比较,模型组大鼠 FPG、FINS明显升高,HOMA-IR也升高(P<0.01)。与模型组大鼠比较,西药组FBG与HOMA-IR降低(P<0.05),实验结果与马来酸罗格列酮改善IR、降糖的作用相一致;中药组FPG虽无明显变化,但HOMAIR低于模型组大鼠(P<0.05),提示中药降浊化瘀合剂具有改善IR的作用。

表2 FPG、FINS和HOMA-IR的比较(珋x±s)
3.2.2 对血脂的影响 表3显示,与正常组大鼠相比较,模型组大鼠血清 TG、TC、LDL-C、FFA水平均明显升高(P<0.01)。与模型组大鼠相比较,中药组、西药组大鼠的血清TG、TC水平均显著降低(P<0.01);2组血清LDL-C与模型组比较无差异(P>0.05);中药组血清FFA显著低于模型组(P<0.05),西药组血清FFA与模型组比较无明显变化(P>0.05)。中药组血清 TG、FFA水平显著低于西药组(P<0.01)。
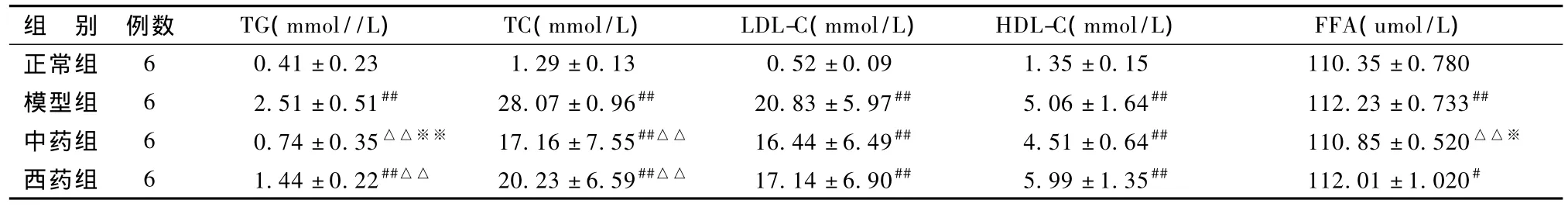
表3 结果血脂水平的比较(珋x±s)
4 讨论
4.1 T2DM合并NAFLD大鼠模型的建立
NAFLD是T2DM的常见并发症,常与肥胖、高脂血症等心脑血管病危险因素一起出现,且发病率越来越高。为对T2DM合并NAFLD的发病机制和治疗等进行深入研究,建立一个理想的动物模型尤为重要。
目前T2DM的动物模型多采用遗传因素占主导作用或STZ诱导的方法,有学者提出长期高脂饮食加小剂量STZ建立更为符合人类T2DM特点的动物模型;NAFLD最常用的动物模型是通过高脂和/或高胆固醇饲料喂养制备。可以看出,高脂饮食是T2DM、NAFLD动物成模的重要因素。鉴于以上认识并参考文献[1-2],我们采用改良高脂饲料(在普通高脂饲料中加入少量蔗糖、胆酸盐和丙基硫氧嘧啶),结合小剂量STZ处理,建立T2DM合并NAFLD的大鼠模型。
本法在饲料中加入蔗糖,可增加长链脂肪酸的合成而使TG的合成增加,且当血糖升高时,促使由乙酰酶A转变成的胆固醇也增加[3]。饲料中加入少量胆酸盐和抗甲状腺药物丙基硫氧嘧啶,可干扰脂代谢,诱发高脂血症,促进脂肪肝的形成。然后以STZ剂量30mg/kg一次性腹腔注射,在一定时间内破坏适量的胰岛β细胞,引起糖代谢紊乱。本建模方法以肝脏形态学改变、血糖、胰岛素敏感指数作为大鼠建模成功的观测指标,成功建立模型时间仅用5周。
从实验结果看,本造模方法成模率高、死亡率低、造模周期短,且模型符合人类 T2DM合并NAFLD的发病特点,是研究T2DM并NAFLD比较理想的动物模型。
4.2 降浊化瘀合剂对T2DM合并NAFLD大鼠的影响
T2DM患者常易并发NAFLD。流行病学资料显示,21%~78%的2型糖尿病患者中存在脂肪肝。目前对于二者的发病机制尚未完全明确,但一致认为IR是二者共同的发病基础,且糖脂代谢紊乱在发病中发挥着重要作用。在T2DM患者中,高血糖合并脂质代谢紊乱颇为常见,其典型的脂谱表现为血清TC、TG、FFA及 LDL-C增高,其机制主要为 IR和高血糖对脂代谢的影响,促进TC的沉积和高TC血症的形成[4]。肝脏是脂类物质消化、吸收、代谢等过程中的重要器官,当肝脏中脂质的生成超过肝脏的转运能力时,便造成肝脏中脂质的累积和脂肪肝的形成。
随着研究的深入,发现脂质代谢紊乱对细胞存在着毒性作用,即所谓“脂毒性”,其与T2DM及并发症的发生和发展密切相关[5]。本次实验采用高脂饲料诱导IR和NAFLD的产生,即可看作是“脂毒性”的作用。注射STZ使T2DM模型建立后,IR及INS分泌不足的状况又进一步加重了脂代谢紊乱的程度。而血液中过高浓度的FFA所产生的“脂毒性”,又可使β细胞功能进一步下降,IR进一步加剧,加重了T2DM,如此形成恶性循环。因此,T2DM合并NAFLD的治疗打破这种恶性循环尤为重要。
降浊化瘀合剂是导师杨晋翔和高彦彬教授治疗T2DM合并NAFLD的有效方剂。我们认为,T2DM合并NAFLD的发生,多由先天不足、饮食不节、嗜食肥甘厚味,加之嗜卧少动,日久导致脾失运化、精微不化、酿湿生痰、郁于肝中而成,日久可由实致虚、脏腑失调、变证百出,故倡导早期治疗。病变早期以肝脾为中心,肝气郁滞、痰瘀阻络为主要证候,治疗以疏肝理气、化痰通络为法。降浊化瘀合剂中柴胡、枳实疏肝理气,茵陈、泽泻、熟大黄、全栝楼化痰降浊,丹参活血通络,共奏疏肝理气、化痰通络之效,临床应用取得良好疗效。
从本实验中可以看出,模型组大鼠血清 TC、TG、LDL-C和 FFA明显高于正常组,且 FBG、FINS升高,HOMA-IR显著升高,证实 T2DN合并非酒精性脂肪肝大鼠血脂代谢紊乱和 IR的存在;模型组HDL-C较正常组升高,可能是高 TC血症所引起。与模型组比较,中药治疗组TG、TC、FFA明显改善,且TG、FFA改善程度优于西药组。中药组FBG较模型组虽无变化,但HOMA-IR降低,证实降浊化瘀合剂有改善IR的作用。
综上所述,我们成功建立了T2DM并NAFLD的大鼠模型,降浊化瘀合剂治疗T2DM合并NAFLD有改善IR和脂代谢的作用,有利于改变IR与脂代谢紊乱相互影响的恶性循环。
[1] 王 倩,管小琴.大鼠非酒精性脂肪肝造模方法的改进[J].世界华人消化杂志,2007,15(11):1219-1224.
[2] 胡爱民,肖凤英,郑 云.2型糖尿病并脂肪肝实验性大鼠模型的建立及评价[J].中国中西医结合消化杂志,2006,14(3):156-159.
[3] Li z,Soloski MJ,Diehl AM.Dietary factors alter hePatic innate immune system in mice with nonaicoholic fatty liver disease[J].Hepatology 2005,42:880-885.
[4] Samuel VT,Liu ZX,Qu X,et al.Mechanism of hepatic insulin resistance in non-alcoholic fatty liver disease[J].J Biol Chem,2004,279:32345-32353.
[5] Ginsberg HN,Zhang YL,Hemandez-Ono A.Regulation of plasma triglycerides in insulin resistance and diabetes[J].Arch Med Res,2005,36:232-240.
