发酵类生物反应器参数在线监控技术
2011-02-27于颖张小惠
于颖 张小惠
(中国药科大学,江苏 南京 210009)
发酵技术(广义上称生物反应技术)是一种和我们的生活息息相关的技术,人们日常生活中的酵母、啤酒、味精,以及各种抗生素药物、氨基酸等都离不开发酵。近年来,随着生物科学技术的迅速发展,发酵工业越来越多的引起人们的重视。生化反应器的体积从几m3,直至几百m3。二次代谢产物的生产(抗生素的生产)、通过微生物的培养来获得有机物质的转化(如:类固醇)、工业污水处理以及酶制剂、实用蛋白、饲料添加剂等生产,发展迅速。面对生物反应工程的发展,生物反应过程的参数测量、自动控制、优化操作与控制、在线监控成为生物反应工业工程发展中面临的重要问题。另一方面,计算机技术的飞速发展为测量、分析、反馈控制、在线监测生化工程提供了先进的自动化工具。与国际先进的生物反应工程的在线检测及控制技术相比,我国生物反应工程技术无论是发酵工艺,还是自动化控制及在线监测方法,仍然处于一个较低的水平,传统的操作方式是开环的,尽管对环境参数,如:pH值、发酵温度、溶氧浓度等都可以控制得很好,但由于微生物生长过程,一些关键变量还是不可在线测量,使发酵过程控制问题依然很复杂,并且控制效果不理想,发酵工业的闭环控制滞后于一般的工业生产过程控制。因此,在加强对发酵工艺研究的同时,提高发酵自动化控制技术及在线监控技术已成为一个刻不容缓的课题。
1 基本概念
1.1 发酵罐
发酵罐是一种最为常见的生物反应器,它由圆柱形罐体和各种检测传感器组成。发酵罐的罐体一般为玻璃或钢结构,实验用发酵罐以玻璃结构较多,而且容积一般都小于10L。发酵罐有很多类型,如:鼓泡式、气升式、机械搅拌式、喷射自吸式等。其中,机械搅拌式在实验室和生产中应用最为广泛,其利用机械搅拌器的作用,使气和发酵液充分混合,提高发酵液的溶解氧,供给微生物生长繁殖代谢所需的氧气。在发酵罐上装配有搅拌电机和进行温度调节的加热和冷却装置,配有温度、溶氧、pH值等检测传感器及HPLC在线分析仪等可以对发酵参数进行在线检测,并根据发酵各参数的变化情况进行反馈控制,实现在线监控功能。
1.2 生物反应工程概念
现代意义上的生物反应工程是指在一定条件下(合适的培养基、温度、pH值、通气量、搅拌等)进行培养发酵,利用微生物的某种特定功能,通过现代工程技术方法生产对人类有用的物质或直接把微生物应用于工业化生产的技术体系,其主要内容包括:工业生产菌株的选育、最佳发酵条件的选择和各测量参数的在线检测、控制与优化、生化反应器(发酵罐)的设计和产品的分离、提取和精制等过程。
2 生物反应过程参数的在线监控
生物反应过程参数的在线监控是生物反应工程至关重要的一个部分。发酵类生物反应器及其控制系统结构图[1]如图1所示。
由于发酵过程内部机理非常复杂,影响因素多,各因素参数之间相互作用,更增加了过程的复杂性。迄今为止,常见的生物发酵设备,检测的参数有温度、压力、pH值、溶氧、转速、空气流量、泡沫、液位、尾气中的氧气和二氧化碳等,能够控制的参数(功能)有温度、pH值、溶氧、转速、压力、空气流量、消泡、液位、补料、灭菌等,大多采用常规调节方法进行控制。事实上,由于发酵过程的复杂性和现场工程的限制性,试图通过系统辨识建立被控变量与控制手段之间的传递函数,进行系统解耦的方法往往并不理想[2]。
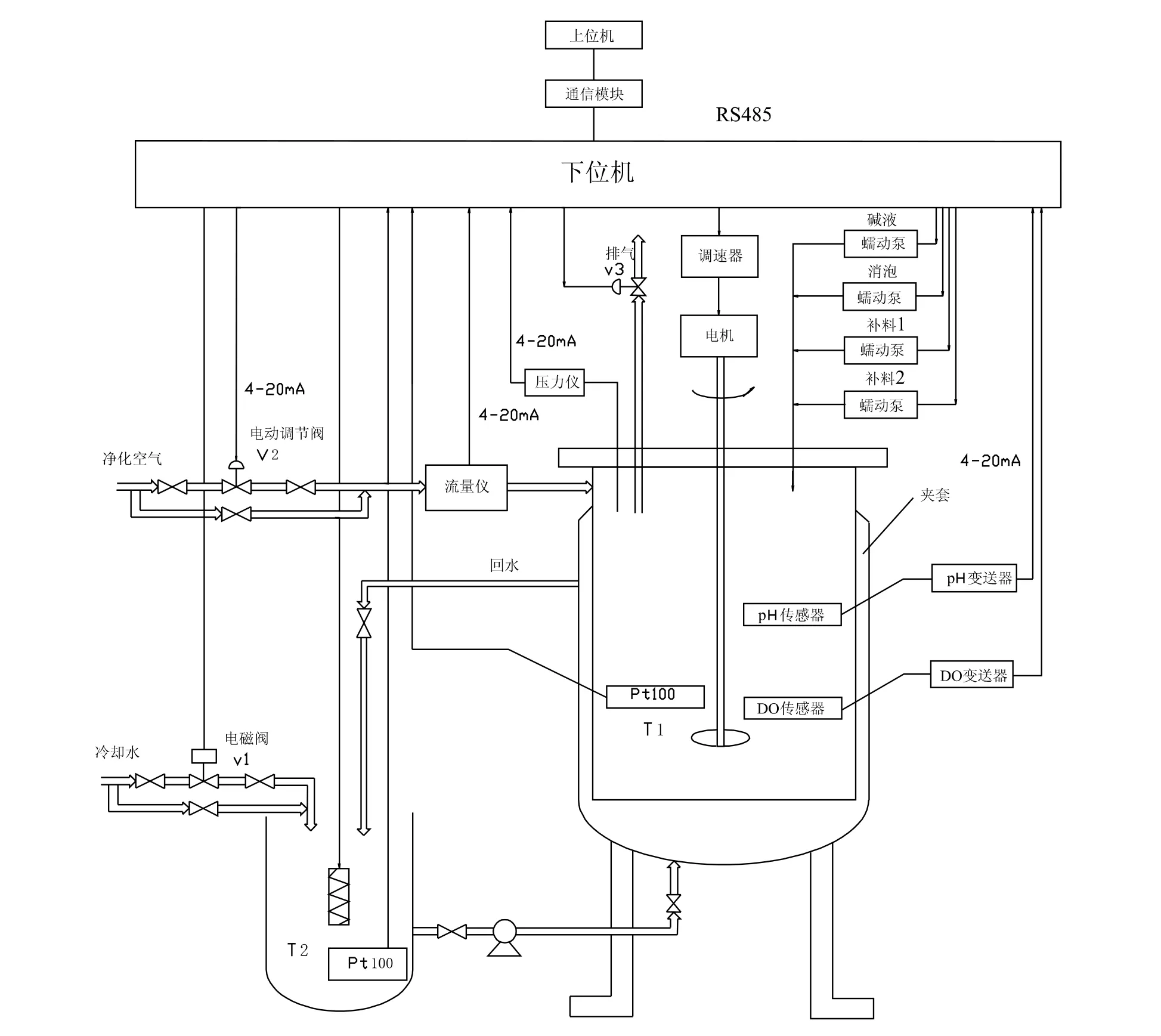
图1 生物发酵设备及其控制系统结构图
在发酵过程中,完全自动化的在线监测和控制系统的发展是非常重要的。发酵中,在线监测培养基和产品浓度通常是比较困难。由于要防止传感器污垢,并且原位消毒灭菌较难,发酵罐中所使用的传感器有所限制。与生物传感器相比,HPLC系统有利于同时分析发酵液中的多种组成成分。国外用于监测产物和次要产物青霉素以及头孢菌素的在线HPLC系统已发展成熟。自动化HPLC系统在杂种细胞培养中监测单克隆抗体产物也已发展成熟。其他基于HPLC的自动化在线系统也在重组E细胞的发酵,大肠杆菌机械化蛋白质产物中建立起来,系统中被特纳等人提议在HPLC之前,安装蒸汽灭菌和高速率的微型离心机,整个发酵液样品用离心法预处理,以获得清澈的样本,然后注入HPLC中。
但是,以控制为目的,将在线HPLC连接到发酵罐或者是生物反应器上,根据监测数据,进行反馈控制的报道还很少。大多数文献研究仅仅将基于HPLC的自动化系统致力于在线监测。特纳等人近来将在线HPLC系统应用于封闭的回路控制(馈送率控制)重组细胞E,大肠杆菌,反馈批发酵。此外,也有文献报道了一种低成本、基于个人电脑的监测和控制系统适用于微生物发酵[3]。该系统设计的软件采用VB4.0编制,在这个系统监管下,生物发酵过程的许多关键部分数据的获得、分析和反馈控制能同时进行,对生物发酵过程进行在线检测及控制。
2.1 过程参数控制
2.1.1 温度控制
温度是影响微生物生长发育及代谢活动的重要因素。发酵液温度通过调节夹套中冷却水或加热水流量来控制。考虑到发酵过程不同阶段产生热量的速度不同,过程模型参数变化较大,冷却水流量与温度关系无法精确测定,宜采用分段设定的自适应PID控制算法。另外,发酵过程有时温差较大,易产生超调和积分饱和,可采用积分分离的自适应PID控制算法[4]。
PID控制是工业上应用最广泛的一种控制方法,具有结构简单、稳定性好、可靠性高等优点,但适应性较差。在实际发酵过程控制中存在着时变性、非线性与模型不确定性,此时PID不能很好地控制,则可采用模糊控制方法。模糊控制是依赖于人和专家的经验进行控制,对时滞、非线性和时变的系统有良好的控制能力,但不具有积分环节,在变量分级不够多的情况下,在平衡点附近常出现振荡现象和稳态余差。
发酵过程温度控制中把模糊控制和PID控制结合起来,不仅具有较快的响应速度和抗参数变化的鲁棒性,而且可以对系统实现高精度控制。当温度偏差较小时,采用PID控制,提高控制精度;当温度偏差较大时采用模糊控制,以加快响应速度。两者的转换由事先程序给定的偏差范围自动实现。模糊PID温度控制系统的结构如图2所示。
2.1.2 pH值控制
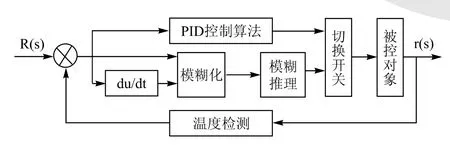
图2 模糊PID系统结构图
发酵液的pH值直接影响到菌体的生长繁殖和代谢产物的合成,菌体在培养过程中本身具有一定的调节环境pH值的能力。当外界条件发生变化时,pH将会产生波动。在生产过程中采用加酸、碱中和的办法来调节pH值。从控制模式看,发酵液的pH值也是一个大滞后、大惯性的控制对象。根据实际需要,肖应旺[5]等采用时间比例滴加方式,商建东[6]采用专家智能方法进行pH值的控制,王俊伟[7]给出了无模型自适应方法应用于pH控制中,梁斌[8]给出了前馈加反馈的控制方案,其控制原理如图3所示。对于分批发酵生产,发酵液的pH值调到一个定值,比如5、搅拌速度为120 rpm。控制程序为:①测试从pH电极输出的电压,把它转换为pH值;②将pH测量值和设定值比较,计算差值;③加入HCl(pH差值 > 0.05) 或 NaOH[pH差值 <-0.05,或者不加(-0.05 < pH差值< 0.05)];④每10s重复①到③的步骤。
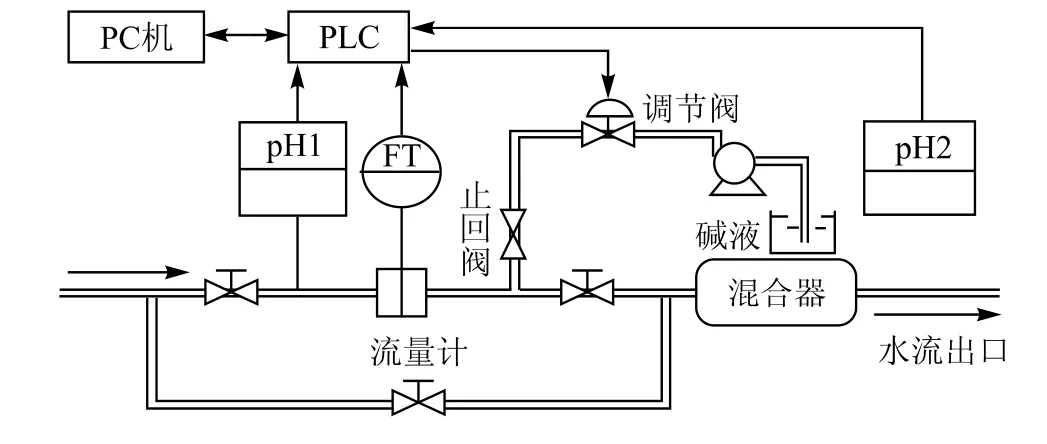
图3 pH 控制原理图
pH和进料流量则通过蠕动泵来控制,一个泵用来补给培养基溶液,另外两个泵分别用来投递HCl和NaOH,控制发酵罐溶液的pH值。如图1所示。
2.1.3 溶氧控制
溶解氧作为发酵过程中的一个重要的参数,必须精确控制。影响溶解氧的主要因素有:通气量、罐压、微生物需氧量、搅拌转速。一般搅拌转速是定值,根据发酵工艺而定。微生物需氧量在发酵的不同阶段值变化较大,很难确定;罐压一般要求尽可能稳定。因此,主要通过调节通气量来控制溶解氧。由于溶解氧具有很大的滞后性,采用常规PID控制,易产生振荡,超调也很大。管国强等[9]采用以溶解氧控制器为主控制器,通气量控制器为副控制器的串级控制系统。溶解氧控制器的输出作为确定通气量调节给定值的依据,从而达到根据溶解氧的需要来控制通气量的目的,方块图如图4所示。钱洁[1]采用了改变罐压、通气量所组成的溶解氧串级控制系统(如图5所示)。溶解氧、罐压、通气量调节器均为由计算机实现的数字调节器。其中,溶解氧调节器为主调节器,罐压和通气量调节器为副调节器。溶解氧调节器的输出作为确定罐压和通气量调节给定值的依据,以达到根据溶解氧的需要来控制罐压和通气量的目的。但该方案中,由于罐压由进气调节阀的开度控制,通气量由出气调节阀的开度控制,调节罐压将影响到出气流量,反之调节出气流量将影响罐压,两者之间有较紧密的藕合关系,采用常规PID控制,控制质量较差,难以稳定,易失控及振荡,有较大的超调,因此,在主回路中引入模糊控制概念,实现Fuzzy-PID串级控制,显著改善了系统的控制效果。
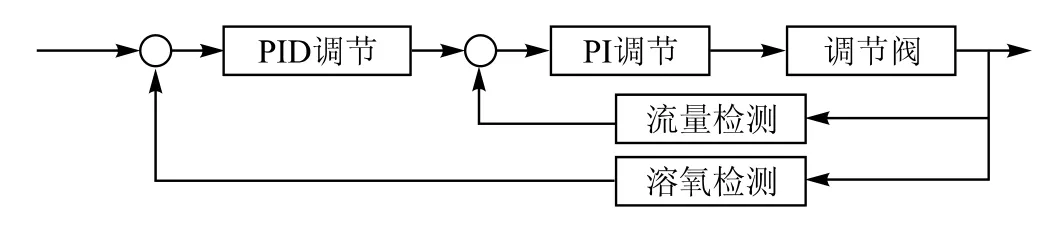
图4 溶氧方块图
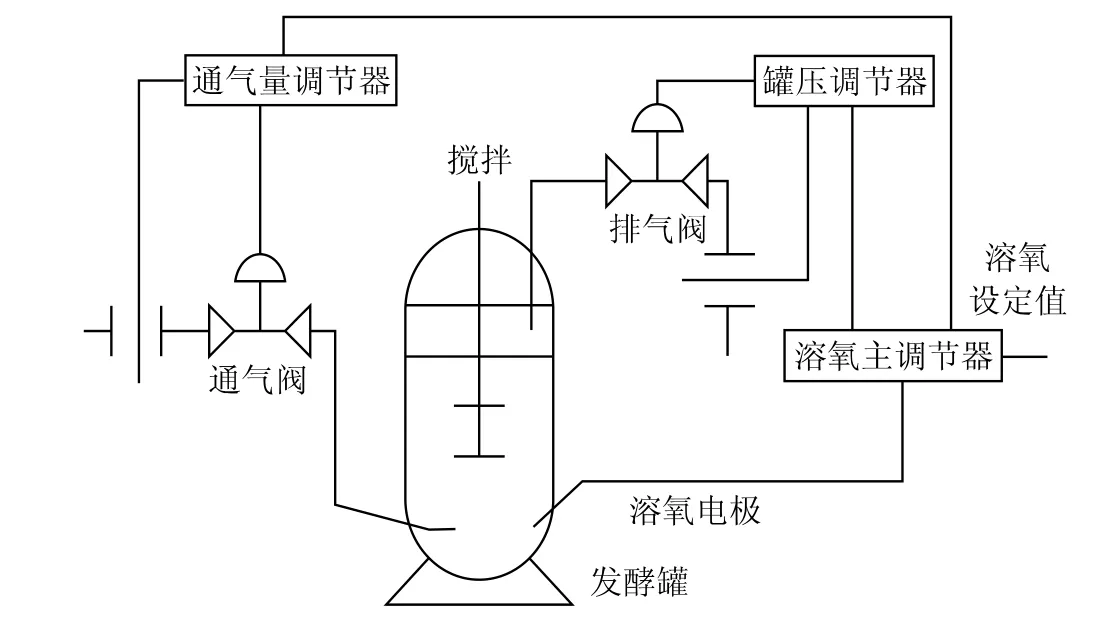
图5 溶氧量-罐压、通气量串级控制系统
由于罐压和通风量之间有一定耦合关系,而且压力和通气量调节都有一定的滞后性,所以,如果采用常规数字PID调节罐压,超调量会很大,稳定时间长,甚至容易产生振荡。采用Fuzzy-PID控制器,对罐压进行自动控制,很好的解决了这一问题,得到了满意的效果。如图6所示,基本控制思想是在大偏差范围内采用Fuzzy控制,在小偏差范围内转换成PID控制,两者的转换由微机程序根据事先给定的偏差范围自动实现。
2.1.4 消泡控制
在发酵前期,微生物生长旺盛,加入液料满载,搅拌马达全速开动,空气通入量达到最大,此时发酵液上浮很厉害,稍有不慎,就可能会产生逃液现象。此时,必须及时加入消泡剂,以减少泡沫,防止发酵液上浮。
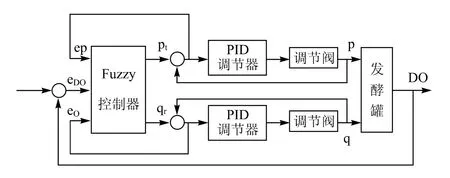
图6 发酵过程溶解氧的Fuzzy-PID串级控制框图
消除泡沫的方法很多,可将其分为机械消沫和消泡剂(化学消沫)两大类。机械消泡是一种物理作用,靠机械强烈振动,压力变化,促使气泡破裂。一般在搅拌轴的上层安装消泡桨,但消泡桨的效率不高,对粘性流态泡沫几乎不起作用。所以,在发酵过程中必须要加消泡剂。消泡剂的控制通常采用双位式的控制方法,以液位作为检测参数,当发酵液液面达到一定的高度时,自动打开消泡剂的阀门;当液面降回到正常时,自动关闭消泡剂阀门。如图7所示。在消泡控制中,过程响应较慢,所以,控制回路中加入时间延迟,防止加入过量的消泡剂。
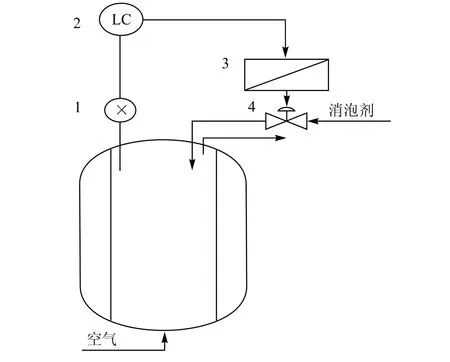
图7 消泡控制
2.1.5 自动补料控制
在半连续发酵过程中,微生物生长状态的生物代谢状况不断改变,要连续不断地补充营养物质,使微生物按照优化的生长轨迹生长,以获得高产的微生物代谢产物。由于微生物和代谢状况无法实时在线测量,使得这一补料控制极为困难。一般的发酵工业生产过程是根据实验室大量的试验研究结果得出的补料轨线来指导工业生产的补料,发酵工艺技术人员根据离线的化验室化验数据适当修正补料速率。东南大学戴先中提出的神经网络逆系统用于红霉素发酵生化参数的软测量方法[10],较好地解决了菌丝浓度、基质浓度、产物浓度等关键生化量无法在线测量的问题,为补料控制提供了很好的基础。
针对这种发酵过程的复杂性和信息的缺乏,发酵工艺技术人员与自动控制人员一起,共同研究,企图寻找出好的补料方法和策略。例如,基于出口气体二氧化碳的释放率来控制补料速率;有的用化学元素平衡的方法来调整补糖量;也有的用控制呼吸商的办法来控制补料等等[11]。也可根据培养基及溶液的在线浓度测量值,确定进料变化率,进行加料量的反馈控制。直至今日,如何控制生物发酵过程的在线检测及控制好中间补料,仍是有待解决的难题。
2.2 组分浓度的在线监控
对于过程中的组分,如:葡萄糖、乙醇含量等可采用HPLC等实现在线分析监测,并实现反馈控制。在线分析仪包括连接着发酵罐和HPLC的自动抽样系统,可实现发酵液中的培养基和产物(葡萄糖和乙醇)的HPLC在线预处理及在线分析。Burkhard Horstkotte[12]给出了HPLC在发酵过程中的在线检测的应用。图8发酵罐及其在线监测和控制的过程图。
发酵液每隔一段时间自动采样,将试料溶液中的细胞经0.5 μm的过滤注射筒滤过,滤液稀释后,自动注入HPLC中进行基质(如:葡萄糖)和溶液(如:乙醇)的浓度分析。
连续补料发酵中不仅要进行pH开关控制,也必须根据养料流量的变化,测试发酵罐中基质(如:葡萄糖)浓度的在线反馈控制。在连续补料发酵过程中,如果对葡萄糖浓度进行回馈控制,进料流量将依照在线HPLC测试的葡萄糖浓度和控制版上设定的葡萄糖浓度分布曲线的差别而变化,采用Rivera的产出预测模型[13],可进行进料流量随时间的设定。
为了控制进料流量,可以在安装盘上设置养料供给方式为进料速率。为了具体说明进料速度的变化,发酵时间设为每20 min为一间隔。最佳进料方式可使模型模拟与优化,可设定为进料方式。尽管如此,如果“反馈控制”这一分面版被选中,进料流量则自动随着软件控制系统而变化。例如,进料流量由于测定和设定的葡萄糖浓度不同而改变。这一进料流量的变化率是基于以下葡萄糖质量平衡:(设定葡萄糖浓度- 测量的葡萄糖浓度)×发酵体积=增加的流量×采样时间间隔×进料葡萄糖浓度。
2.3 数据采集、监测和控制系统
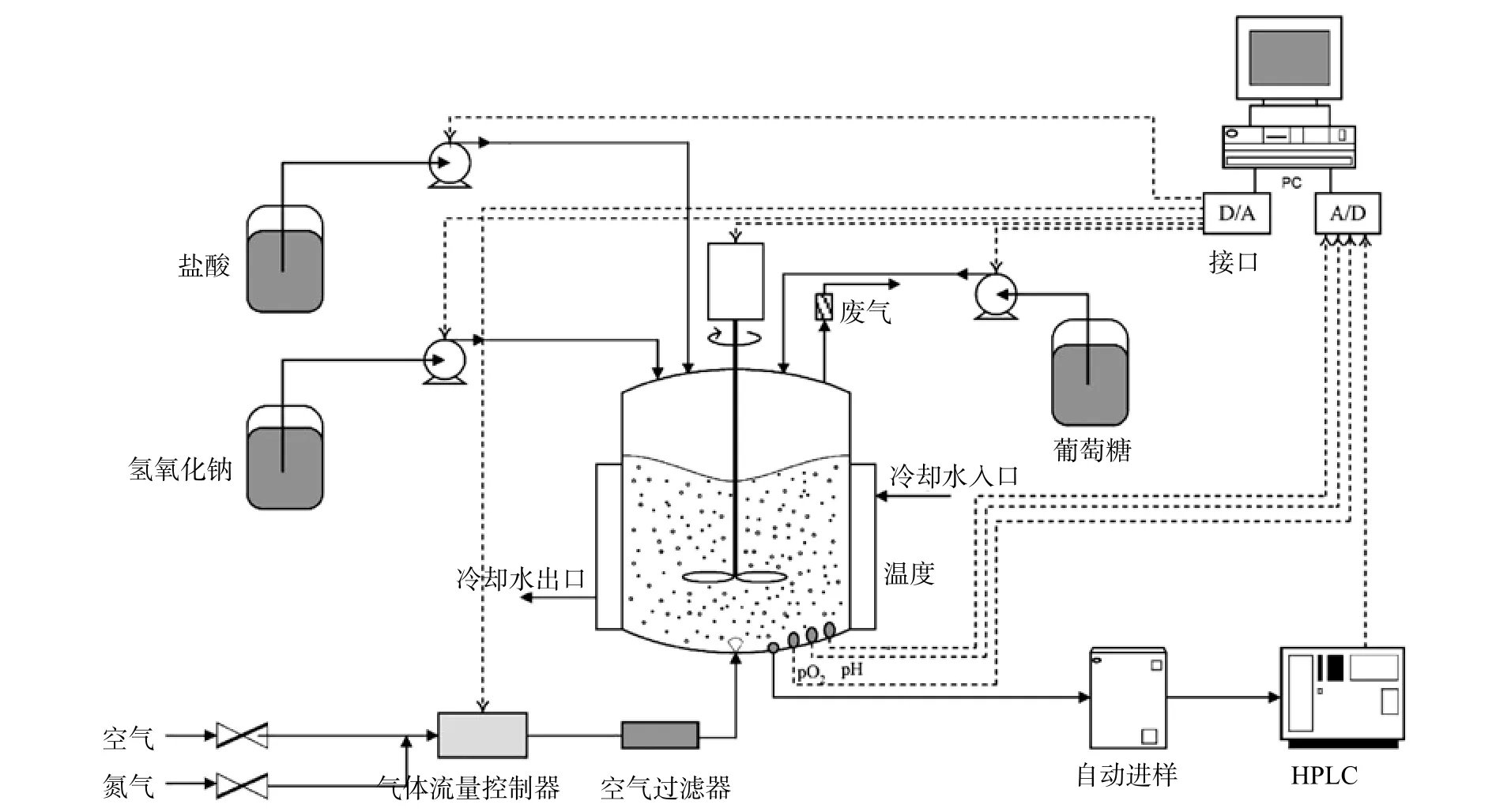
图8 包括自动取样设备、HPLC、电脑和控制仪表部件的在线监测和控制系统
热电阻输出的模拟信号、pH和电极,在转换到个人电脑之前,被接口卡收集,并转换为数码信号。从HPLC系统的RI探测器发出的模拟信号(电压),通过一个带有0.01 μF电容量和100Ω电阻的过滤器,在接口卡之前转换到PLC,利用Savitzky 和Golay提出的方法,采用电脑程序使电压信号的色谱峰平缓[3]。为了获得HPLC结果,可采用VB操作,在电脑屏幕上显示色谱和HPLC的结果。如图9所示的监测和控制系统的主小组显示的是几个设置选择,如图10所示的基于个人计算机监测和控制系统的软件结构。

图9 几个设置和分主面版的供料流量控制界面
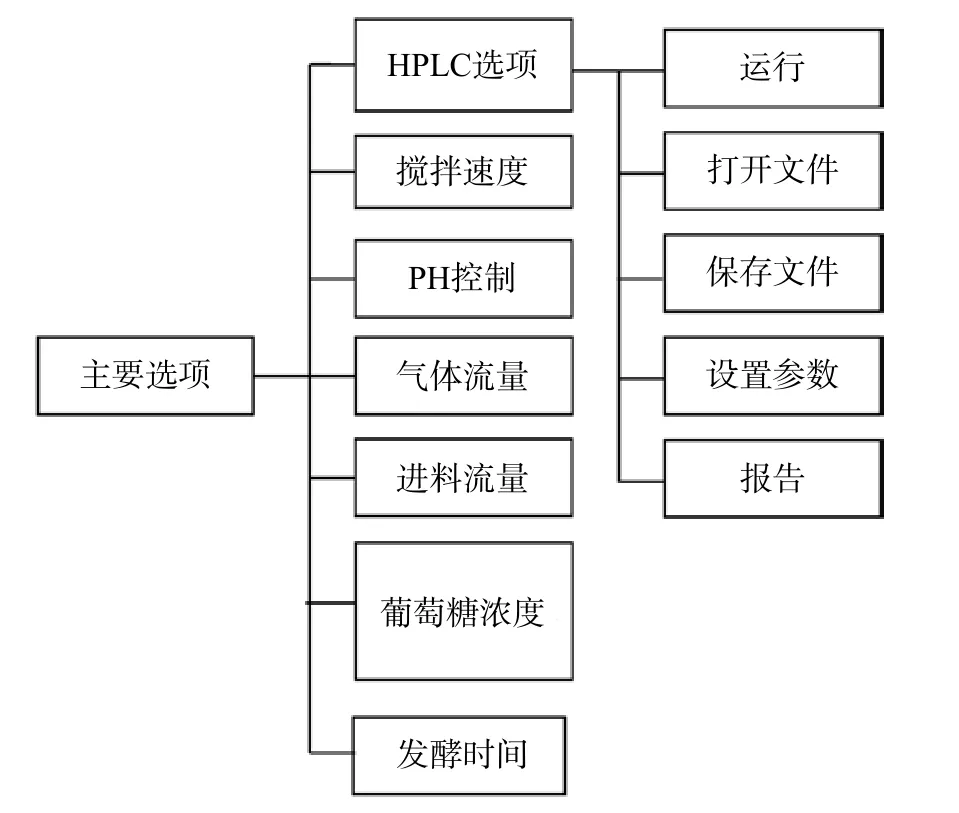
图10 监测和控制系统的软件结构
在这些选项屏幕中,可以设定控制发酵的基质(葡萄糖)浓度、pH、流量、气体流量、搅拌速度和时间,以及HPLC操作和发酵开始时间等。
2.4 在线色谱系统
在每次采样前,发酵液用BenchMate取样,取样溶液中的细胞被过滤器截留。滤液被自动稀释并注入到HPLC中。当电脑中的HPLC程序接收到注射的信号时,从RI探测器发出的输出信号被自动捕获并转换为数字信号,显示在控制版上。色谱层析得出结果后,峰的位置被识别,每个峰的面积被计算出来。然后,根据比较校准曲线和控制版上显示的峰面积差值,计算出基质(如:葡萄糖)和溶液(如:乙醇)的浓度。每次分析运行都自动生成并保存色谱结果。色谱的文件结果能在电脑屏幕上显示色谱和峰数据,如果图11所示。该色谱图是经硬件和软件的方法,实施平缓的处理过程,获得从RI探测器发射的色谱信号。
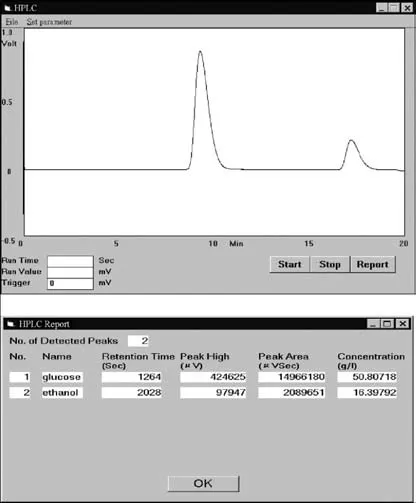
图11 显示器的色谱图和高效液相色谱分析结果
通过在线HPLC系统,能有效地测定发酵液中的基质(如:葡萄糖)和溶液(如:乙醇)的浓度。
这一在线监测和控制系统其中一个重要特征是实施自动采样的商业自动化设备。这一设备(BenchMate II)能从发酵罐中取出操作样本溶液进洗液管,经过滤样本,稀释样本,最后注入HPLC中进行组分浓度的测量。不需要循环取样,可通过自动化的程序设置,按步骤完成注入HPLC前的很多样本预处理工作。
此外,中红外及近红外技术也能应用于生物反应在线监控过程中同时在线分析多参数,图12为Payal Roychoudhury[14]等将中红外技术应用于生物反应的在线监控中;Karl Schu¨ gerl[15]综述了色谱、光谱仪器及生物传感器,模型建立、专家系统、图形分析等在生物反应过程在线监控过程中的应用。V. Vojinovi′c[16]等介绍了光谱、质谱、各种传感器在生物反应工程在线监控中的应用。这些国外的先进应用技术对我国生物反应工程在线监控技术的发展,提高了借鉴的思路。
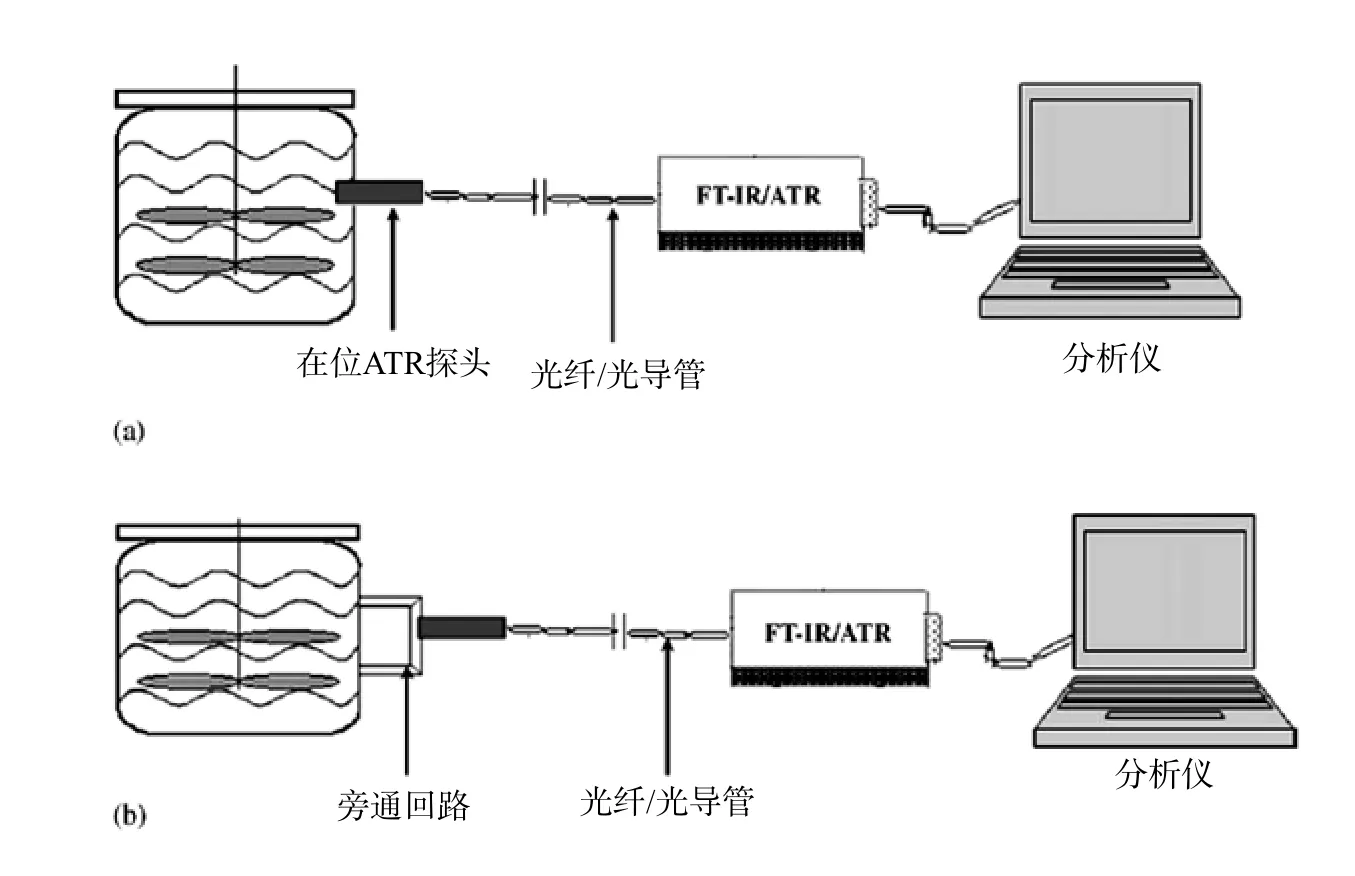
图12 中红外技术在生物反应过程中的应用
3 结论与展望
生物反应工程中各测量或控制参数随时间而动态地变化,为了对过程参数进行检测,国外研制了很多种类的传感器,用于检测反应过程中的温度、罐压、搅拌转速、搅拌功率、气体和液体流量、液面高度、液体粘度、蚀度、pH、溶解氧、氧化还原电位、葡萄糖浓度、氨氮浓度及某些关键性酶和产物的浓度等。上述传感器,有的已制成商品,并通过气动或电动控制仪表或微型计算机实现对参数的检测,在有条件的情况下进行反馈控制。若采用微机,还可对过程中的二次参数,如:氧传递系数、比生长速率、产品得率系数等进行在线检测,计算机还可根据过程优化数学模型对过程进行在线优化控制。
目前,生物发酵工程中在线检测及反馈控制技术的完善应用及研究正在起步,因生物反应过程的各种参数较多,目前发酵过程中组分的在线分析及反馈控制,由组分的在线分析建立起的进料量控制等技术的研究及应用,国内还处于研究阶段,包括生物传感器的研制、仪表和计算机系统立、数学模型的建立和优化控制的实施,生物反应器设计研发以及有关工程放大和生产控制等方面的课题,都有待于深入的加以研究,这对提高生物反应工程的整体水平,是至关重要的一个部分。生物反应器及其在线监控相关技术、优化控制技术也是笔者及研究团队的研究方向。
[1] 钱洁. 生物反应器控制系统的研究[M]. 江苏大学, 2007, 硕士论文.
[2] 胡真. 补料分批发酵过程计算机控制系统的开发和应用[J]. 化工自动化及仪表, 1999, 26 (5) :12–15.
[3] Yen-Chun Liu, Feng-Sheng Wang, Wen-Chien Lee. On-line monitoring and controlling system for fermentation processes. Biochemical Engineering Journal 7 (2001) 17–25.
[4] 乔晓艳,贾莲凤,田力丰. 微生物发酵过程计算机测控系统的开发设计[J]. 计算机测量与控制. 2002, 10( 10):649-650.
[5] 肖应旺, 徐保国. 补料分批发酵过程计算机控制系统的设计与应用[J]. 计算机测量与控制, 2004, 12 ( 6) :529-531.
[6] 商建东,陈康宁. 专家智能pH 控制器及其应用. 化工自动化及仪表, 1998, 25 (3) : 46- 48.
[7] 王俊伟, 尚群立. 无模型控制方法在泵式中和pH值控制中的研究[J].机电工程. 2008, 25(5): 97-99.
[8] 梁斌,杜道广,王兰程. 一种简便易行的pH控制方案[J].化工自动化及仪表, 2004, 31 (4): 64-65.
[9] 管国强,黄达明,吴春笃. 一种小型低成本发酵过程集散控制系统[J].江苏大学学报, 2002, 23 (1): 58-61.
[10] 戴先中. 多变量非线性系统的神经网络逆控制方法[M].南京.科学出版社, 2005.
[11] 石雪萍. 生物发酵过程的在线检测及控制[D].西北大学优秀硕士论文, 2008.
[12] Burkhard Horstkotte, Elisabeth Werner, Stefan Wiedemeier. Atline determination of formaldehyde in bioprocesses by sequential injection analysis[J]. Analytica Chimica Acta, 2006, 559: 248–256.
[13] S.L. Rivera. Neural networks and micro-genetic algorithms for state estimation and optimization of bioprocesses[D]. Ph.D. Dissertation, Colorado State University, Fort Collins, CO, 1992.
[14] Payal Roychoudhury, Linda M. Harvey, Brian McNeil. The potential of mid infrared spectroscopy (MIRS) for real time bioprocess monitoring[J]. Analytica Chimica Acta, 2006,571: 159–166.
[15] Joseph S. Alford. Bioprocess control: Advances and challenges[J]. computer and chemical engineering, 2006, 30: 1464–1475.
[16] V. Vojinovi′c, J.M.S. Cabral, L.P. Fonseca Real-time bioprocess monitoring Part I: In situ sensors[J] . Sensors and Actuators B, 2006, 114: 1083–1091.
