二维径向应变显像在心肌梗死诊断中的应用价值探讨
2011-02-27张少芹,刘霞,张芳等
有实验证明,冠状动脉血流阻断数秒钟后,会立即出现供血区室壁的运动异常,早于心电图改变[1]。心肌在缺血或梗死时,局部室壁运动异常是最早出现的特征性表现,此特征表现在超声心动图中体现得更为直观,但易受主观性的影响而出现假阳性和假阴性[2]。冠状动脉造影(CAG)是诊断冠脉有无狭窄的“金标准”,但属有创性检查,且价格较昂贵,使其普及受到限制。本研究采用二维应变技术分析心肌梗死患者左室径向运动指标-径向应变、应变率、位移,并与冠脉造影“金标准”相比较,旨在探讨如何更好地分析心肌梗死患者局部室壁的运动特征。
1 资料与方法
1.1 研究对象 经临床确诊的心肌梗死患者 34例(急性心肌梗死患者 25例、陈旧性心肌梗死患者 9例),男27例,女7例,年龄(56.5±6.7)岁。所有患者均以标准Judkins法于多方位、多角度做选择性左、右冠状动脉造影,然后将造影发现异常的所有冠脉根据其最大狭窄程度分为4个亚组:无明显狭窄组(<50%),轻中度狭窄组(50%~74%),高度狭窄组(75%~98%),次全及完全闭塞组(99%~l00%)。正常对照组:36例与之年龄匹配的健康志愿者,男23例、女13例,经体检、心电图及超声心动图检查证实无心脏疾病,年龄(54.7±8.5)岁。
1.2 仪器和方法 采用GE Vivid 7彩色多普勒超声显像仪,M 3S探头,频率为(1.7~3.4)MHz,并配有二维应变分析软件Echo PAC 7.0脱机工作站。记录受检者的一般临床资料,并保持受检者左侧卧位,平静呼吸,记录胸导连同步记录。
1.2.1 STI图像的获取 留取左室短轴(二尖瓣、乳头肌、心尖)三个水平连续6个心动周期的动态图像(帧频60~90帧/s)存储于工作站中,心内膜尽量显示清晰,左室短轴图像呈圆形,图像由有丰富经验的临床超声医师记录。
1.2.2 图像分析处理 将图像传输到Echo PAC工作站,进行脱机分析。在斑点追踪成像分析软件的环境下,首先选择分析的感兴趣区(region of interest, ROI),并调整感兴趣区的宽度,使其与心肌厚度一致,在心肌内膜3点、6点、9点、12点位进行描记。按美国超声心动图学会推荐的左室壁16节段划分法加后壁心尖段,前间隔心尖段共18个节段,二维应变软件自动给出每个节段室壁的分析结果。“V”表示该节段为有效追踪,“X”为无效追踪。系统接收追踪成功的节段后,自动显示每个节段的曲线图。观察并测量各平面的收缩期峰值径向应变(radial strain,SR)、收缩期峰值应变率(peak systolic strain rate,SRs)、收缩期峰值径向位移(radial displacement DR)。记录每一个心动周期的SR、SRs、DR并取3个心动周期的平均值作为该室壁的SR值、SRs值、DR值。
1.3 统计学处理 应用 SPSS13.0软件进行统计分析。计量资料用均数±标准差(±s)表示,心梗组与对照组相应节段比较,采用独立样本t检验,不同程度冠脉狭窄组的相应节段比较采用 One-way ANOVA分析,以P<0.05为差异有统计学意义,各指标与冠脉造影结果比较其灵敏度、特异度、阳性预测值、阴性预测值、Youden指数。
2 结果
2.1 心梗组和正常对照组一般资料比较 心梗组与正常对照组的组间年龄、性别、心率、短轴缩短率(FS)比较差异无统计学意义(P>0.05),左室舒张末期容积(LVEDV)、左室收缩末期容积(LVESV)、射血分数(EF)比较差异有统计学意义(P<0.05),见表1。
表1 心梗组和正常对照组一般资料比较(±s)

表1 心梗组和正常对照组一般资料比较(±s)
参 数正常组冠脉狭窄组t值P值年龄(岁) 54±8 56±7 -0.67 0.43 心率(/m in)0.58 LVEDV(m l) 112±17 155±40 -3.59 0.032 69±568±120.22LVESV (m l)0.042 EF(%) 61±4 54±11 2.40 0.002 33±974±36-3.45FS(%)32±429±71.320.37
2.2 冠脉造影结果 冠状动脉造影共检出狭窄程度50%~74%血管27支,其中前降支12支,回旋支6支,右冠9支;检出75%~98%血管43支,其中前降支21支,回旋支8支,右冠14支;检出狭窄程度为99%,甚至完全闭塞的梗死的相关血管39支,其中前降支17支,回旋支10支,右冠12支。
2.3 图像处理结果 34例心肌梗死患者,成功追踪并测得203个室壁运动异常,其中前间隔45个,前壁36个,侧壁20个,后壁25个,下壁36个,后间隔41个。36例正常对照者左室短轴部分图像欠清晰的不纳入本研究,最后共测得446个节段,并获得二维应变值。
2.4 心梗组和正常对照组的SR、SRs、DR比较 与正常对照组比较,心肌梗死患者梗死节段峰值SR、SRs、DR在二尖瓣水平、乳头肌水平均显著低于正常对照组,在心尖水平部分节段低于对照组,差异有统计学意义(P <0.05),见表2~4。
表2 心梗组梗死节段与正常对照组的相应节段二尖瓣水平SR、SRs、DR比较(±s)
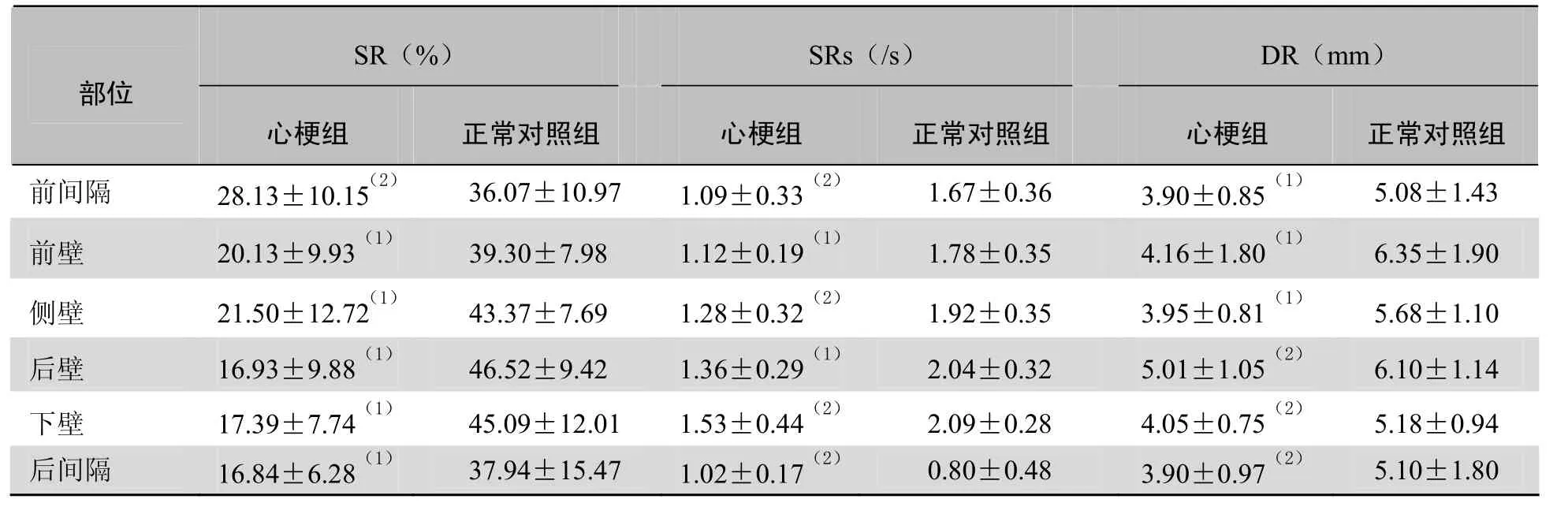
表2 心梗组梗死节段与正常对照组的相应节段二尖瓣水平SR、SRs、DR比较(±s)
注:与正常对照组的相应节段比较,(1)P<0.01,(2)P<0.05
SR(%)SRs(/s)DR(mm)部位心梗组正常对照组心梗组正常对照组心梗组正常对照组前间隔 28.13±10.15(2) 36.07±10.97 1.09±0.33(2) 1.67±0.36 3.90±0.85(1) 5.08±1.43 前壁6.35±1.90侧壁 21.50±12.72(1) 43.37±7.69 1.28±0.32(2) 1.92±0.35 3.95±0.81(1) 5.68±1.10 20.13±9.93(1)39.30±7.981.12±0.19(1)1.78±0.354.16±1.80(1)后壁6.10±1.14下壁 17.39±7.74(1) 45.09±12.01 1.53±0.44(2) 2.09±0.28 4.05±0.75(2) 5.18±0.94 16.93±9.88(1)46.52±9.421.36±0.29(1)2.04±0.325.01±1.05(2)后间隔16.84±6.28(1)37.94±15.471.02±0.17(2)0.80±0.483.90±0.97(2)5.10±1.80
表3 心梗组梗死节段与正常对照组的相应节段乳头肌水平SR、SRs、DR比较(±s)
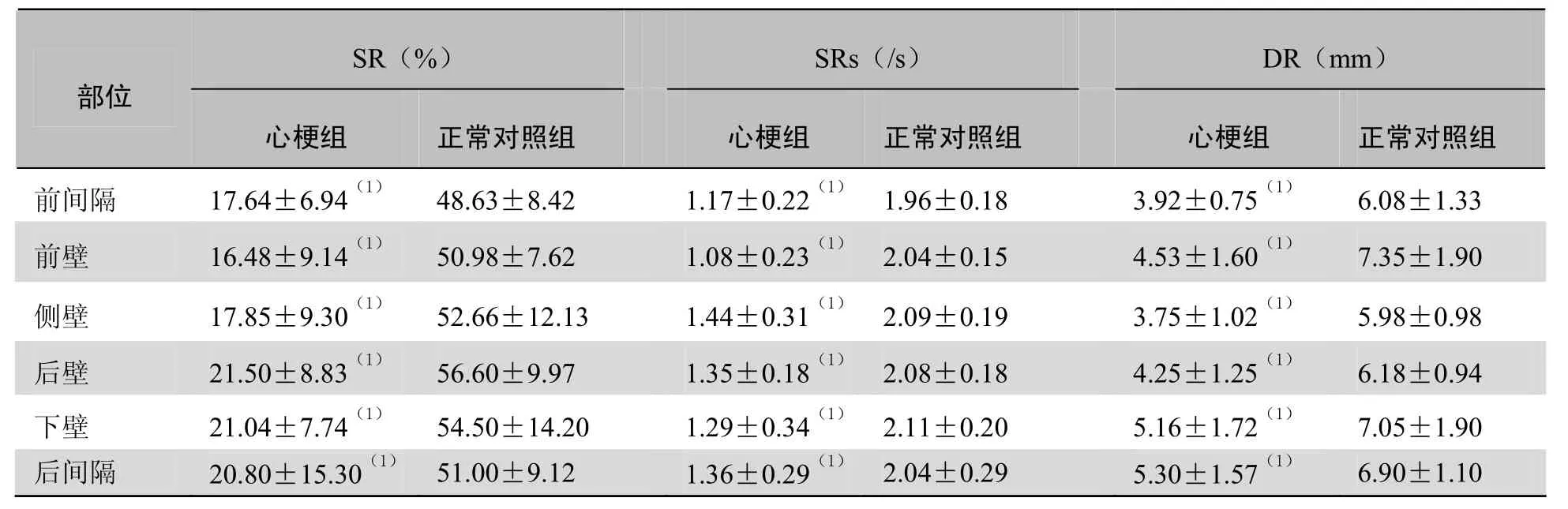
表3 心梗组梗死节段与正常对照组的相应节段乳头肌水平SR、SRs、DR比较(±s)
注:与正常对照组相应节段比较,(1)P<0.01
SR(%)SRs(/s)DR(mm)部位心梗组正常对照组心梗组正常对照组心梗组正常对照组前间隔 17.64±6.94(1) 48.63±8.42 1.17±0.22(1) 1.96±0.18 3.92±0.75(1) 6.08±1.33 前壁7.35±1.90侧壁 17.85±9.30(1) 52.66±12.13 1.44±0.31(1) 2.09±0.19 3.75±1.02(1) 5.98±0.98 16.48±9.14(1)50.98±7.621.08±0.23(1)2.04±0.15 4.53±1.60(1)后壁6.18±0.94下壁 21.04±7.74(1) 54.50±14.20 1.29±0.34(1) 2.11±0.20 5.16±1.72(1) 7.05±1.90 21.50±8.83(1)56.60±9.971.35±0.18(1)2.08±0.184.25±1.25(1)后间隔20.80±15.30(1)51.00±9.121.36±0.29(1)2.04±0.295.30±1.57(1)6.90±1.10
表4 心梗组梗死节段与正常对照组的相应节段心尖水平SR、SRs、DR比较(±s)
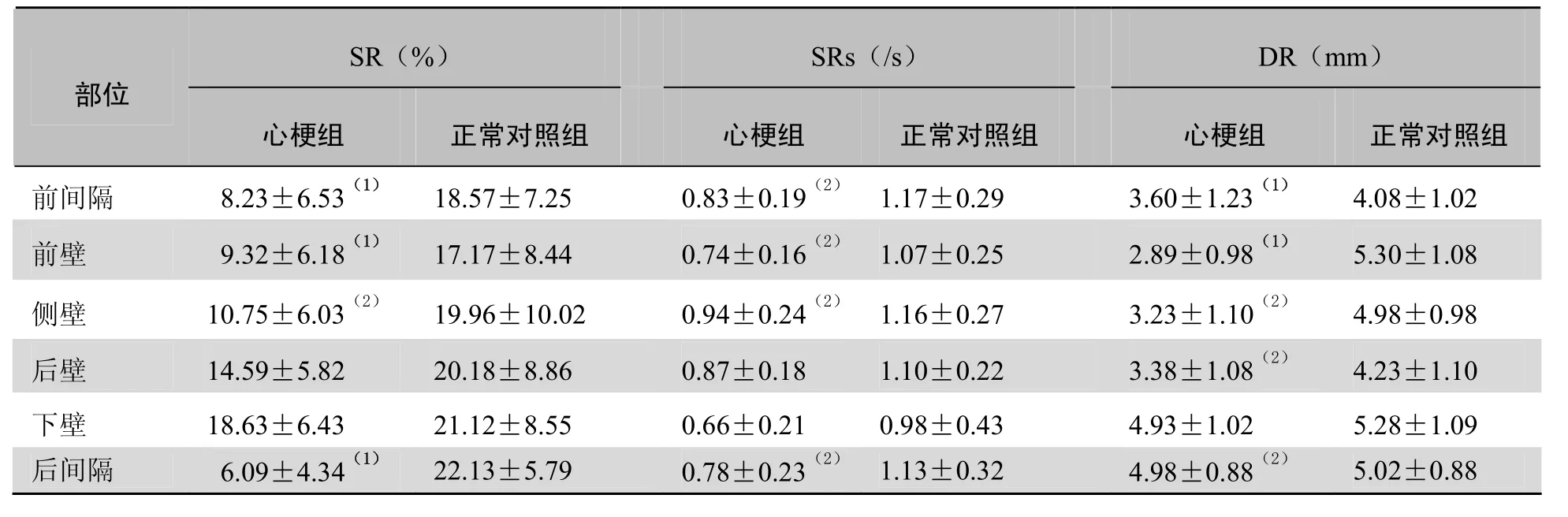
表4 心梗组梗死节段与正常对照组的相应节段心尖水平SR、SRs、DR比较(±s)
注:与正常对照组相应节段比较,(1)P<0.01,(2)P<0.05
SR(%)SRs(/s)DR(mm)部位心梗组正常对照组心梗组正常对照组心梗组正常对照组前间隔 8.23±6.53(1) 18.57±7.25 0.83±0.19(2) 1.17±0.29 3.60±1.23(1) 4.08±1.02 前壁5.30±1.08侧壁 10.75±6.03(2) 19.96±10.02 0.94±0.24(2) 1.16±0.27 3.23±1.10(2) 4.98±0.98 9.32±6.18(1)17.17±8.440.74±0.16(2)1.07±0.25 2.89±0.98(1)后壁4.23±1.10下壁 18.63±6.43 21.12±8.55 0.66±0.21 0.98±0.43 4.93±1.02 5.28±1.09 14.59±5.8220.18±8.860.87±0.181.10±0.223.38±1.08(2)后间隔6.09±4.34(1)22.13±5.790.78±0.23(2)1.13±0.324.98±0.88(2)5.02±0.88
2.5 不同程度冠脉狭窄组的SR、SRs、DR比较 不同程度冠脉狭窄组的SR、SRs、DR比较,差异有统计学意义(P<0.01),见表5。
表5 不同程度冠脉狭窄SR、SRs、DR结果比较(±s)
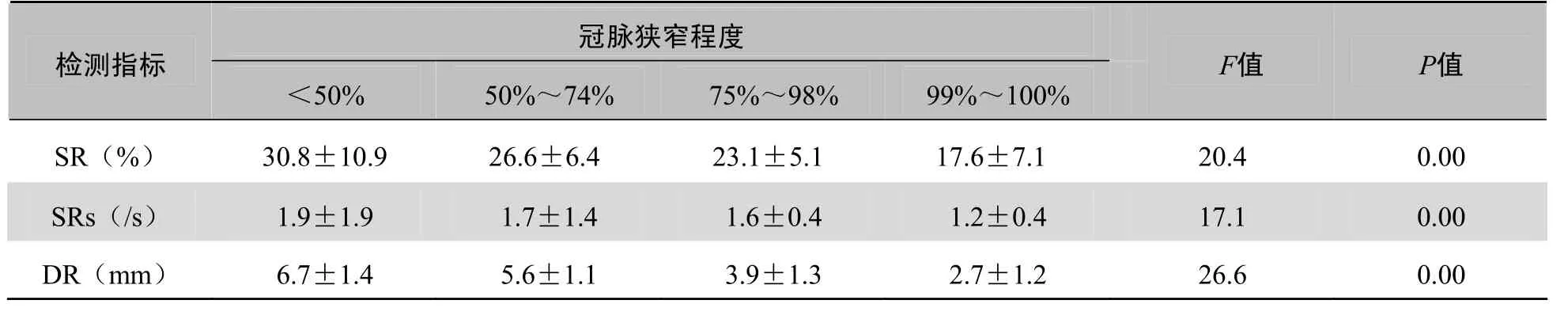
表5 不同程度冠脉狭窄SR、SRs、DR结果比较(±s)
冠脉狭窄程度检测指标F值P值<50%50%~74%75%~98%99%~100% SR(%) 30.8±10.9 26.6±6.4 23.1±5.1 17.6±7.1 20.4 0.00 0.00 DR(mm) 6.7±1.4 5.6±1.1 3.9±1.3 2.7±1.2 26.6 0.00 SRs(/s)1.9±1.91.7±1.41.6±0.41.2±0.417.1
2.6 SR、SRs、DR与冠脉造影结果对照 选择内径狭窄≥50%冠状动脉所支配区域作为阳性诊断标准,以SR、SRs、DR分别以低于正常-1/2s为阳性诊断标准,与冠状动脉造影检查的结果作为对照(图1~4),结果见表6~9。

表6 收缩期峰值径向应变(SR)与冠脉造影结果对照

表7 收缩期峰值径向应变应变率(SRs)与冠脉造影结果对照

表8 收缩期峰值径向位移(DR)与冠脉造影结果对照
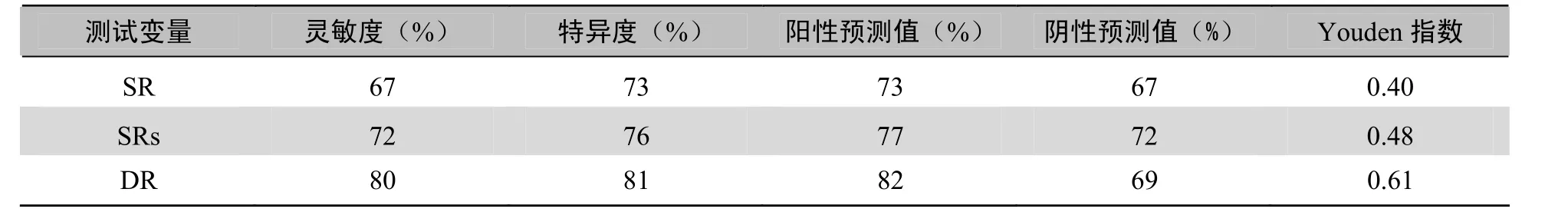
表9 SR、SRs、DR与冠脉造影结果各指标对照
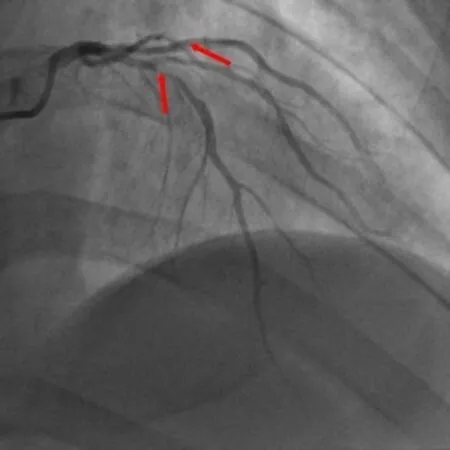
图1 前降支中段95%狭窄,第二钝缘支近段85%狭窄
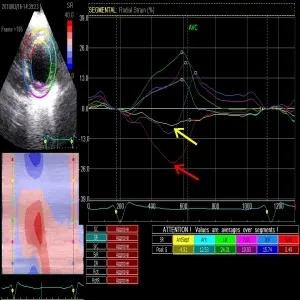
图2 同一患者乳头肌水平径向应变曲线
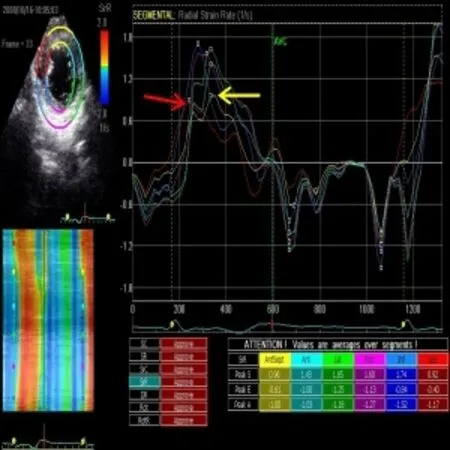
图3 同一患者乳头肌水平径向应变率曲线
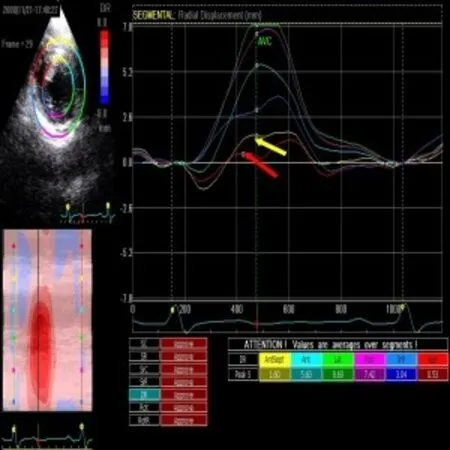
图4 同一患者乳头肌水平径向位移曲线
3 讨论
目前临床对心肌梗死的诊断多结合患者的临床情况(年龄、病史、症状)、心电图、生化检查、超声心动图等作出诊断。理论上,冠状动脉的血液供应与相应的室壁呈节段性一一对应关系, 冠状动脉分支的供血与室壁节段关系按Schiller等[3]的研究结果。通过观察运动异常的节段室壁可推测冠状动脉的某支血管病变,冠脉造影是诊断冠脉有无狭窄的“金标准”,利用冠脉造影的结果与二维径向应变显像(2D-STI)检测结果进行比较分析,来评判2D-STI检测结果的准确性。
径向运动指辐射状向心运动,是心脏短轴方向上所特有的心肌运动方式。收缩期径向应变指心肌在短轴方向上的增厚程度,反映了心肌的变形能力。收缩期峰值应变率指应变率-时间曲线上位于基线上方的收缩峰,反映了局部心肌的变形速度。收缩期径向位移反映了心肌在短轴方向上移动的距离。三个量化指标均可定量分析室壁的节段性运动异常,反映心肌的局部收缩功能[4、5]。W inter等[6]研究表明,急性缺血心肌的径向应变、位移及达峰时间均显著低于正常心肌。崔明亮等[7]研究发现径向位移曲线重复性好,冠心病组绝大部分心肌缺血节段径向位移显著低于对照组。
本研究中我们发现:心肌梗死患者的梗死节段心肌径向形变(SR)、形变速度(SRs)、位移(DR)较正常对照组减低(表2~4),在乳头肌水平心梗组与对正常照组的相应节段表现差异较大,而心尖水平则有部分节段低于正常对照组,考虑这种平面的差异性与心肌纤维的螺旋排列方式及心肌特有的运动方式有关。梗死节段曲线形态变化差异大,部分节段波峰低平,部分节段峰值消失,甚至波峰倒置,与文献报道一致[8、9],由于冠脉狭窄程度不同,SR、SRs、DR峰值表现则不同,随冠状动脉狭窄程度加重峰值均逐渐降低(表5)。可见2D-STI对心肌梗死患者的梗死节段与缺血节段有一定的诊断能力,尤其对冠状动脉狭窄程度较轻、常规超声心动图检查室壁运动尚正常的缺血节段心肌,仍能提供局部心肌收缩功能受损的信息,从而,弥补了传统超声心动图的不足。在与冠脉造影结果对照中,判断诊断价值的基本指标灵敏度、特异度、Youden指数DR>SRs>SR(结果见表9),其中Youden指数又称正确诊断指数,其值越接近“1”,说明该指标的诊断价值越高。在本研究中DR的Youden指数最高,说明DR能够较准确定地位缺血心肌,可作为判断冠状动脉的病变情况的良好指标。本研究中三个指标均有假阴性和假阳性,考虑出现假阳性的原因为:①病变节段心肌主动收缩力下降或丧失而相邻存活心肌牵拉作用而影响正常心肌的运动;②冠脉痉挛引起心肌的一过性收缩障碍。出现假阴性的原因:①部分患者冠状动脉狭窄的过程是缓慢、渐进的,可能已形成较为丰富的侧支循环使心肌的供血得以恢复,但在冠脉造影中冠脉狭窄已经存在;②如果毗邻的正常心肌收缩特别有力,牵拉缺血心肌随之被动运动,而导致假阴性。
本研究中在对心肌节段进行分组时,只是笼统地将其归为前降支供应前间隔、前壁;回旋支供应侧壁、后壁;右冠脉供应下壁、后间隔,未考虑个体间血管走行差异和冠脉侧支循环。
SR、SRs、DR从不同方面评价心肌径向收缩功能,通过评价心肌缺血、坏死的程度,为临床治疗提供可靠信息,在心肌缺血、梗死的无创诊断中发挥积极的作用。在本研究中三者对心肌缺血的诊断价值略有不同,我们认为它们是互为补充的关系,在实际分析心肌缺血时要进行综合评价,使临床诊断更科学、更客观。
[1] Genevieve D. Doppler tissue imaging quantitates regional wall motion during myocardial ischem ia and reperfusion. Circulation,1998, 97: 1970-1977.
[2] 熊莉, 邓又斌, 申屠, 等.超声斑点追踪技术对心肌梗死患者室壁运动的二维应变研究.中国医学影像技术, 2007, 23(7): 990-993.
[3] Schiller NB, Shah PM, Craw ford M, etal. Recommendation for quantitation of the left ventricle by Two-Dimensional Echocardiography. J Am Soc Echocardiography, 1989, 2 (5): 358-367.
[4] Amundsen BH, Helle-Valle T, Edvardsen T, et al. Noninvasive myocardial strain measurement by speckle tracking echocardiography: validation against sonomicro- metry and tagged magnetic resonance imaging. J Am Coil Cardiol, 2006, 47 (4): 789-793.
[5] LangelandS, Wouters PF, Claus P, et al. Experimental assessment of a new research tool for the estimation of two-dimensional myocardial strain. Ultrasound Med Biol, 2006, 32 (10): 1509-1513.
[6] W inter R, Jussila R, NowakJ, et al. Speckle tracking echocardiography is a sensitive tool for the detection of myocardial ischemia: apilot study from the catheterization laboratory during percueous coronary intervention. J Am Soc Echocardiogr, 2007, 20 (8): 974-981.
[7] 崔明亮, 钱蕴秋, 刘丽文, 等. 斑点追踪成像技术对冠心病心肌运动的初步研究. 中华医学超声杂志:电子版, 2009, 6(4): 698-702.
[8] Perk G, Tunick PA, Kronzon I. Non-Doppler two-dimensional strain imaging by echocardiography2from technical considerations to clinical applications. J Am Soc Echocardiography, 2007, 20(3): 234 - 243.
[9] Popovic ZB, Benejam C, Bian J,et al. Speckle-tracking echocardiography correctly identifies segmental left ventricular dysfunction induced by scarring in a rat model of myocardial infarction. Am J Physiol Heart Circ Physiol, 2007, 292 (6): H2809 - H2816.
