湿地松种子萌发对模拟水分胁迫的响应
2011-02-13张聃,曹昀,2,郑林,2
张 聃,曹 昀,2,郑 林,2
(1.江西师范大学 地理与环境学院,南昌 330022;2.江西师范大学 鄱阳湖湿地与流域研究教育部重点实验室,南昌 330022)
种子萌发是植物生活史的重要阶段,是植物种群自然更新的基础[1]。在沙漠地区以水分对沙地植物种子萌发的影响最为突出,雨量大小、降雨频率及土壤湿度是决定沙地植物种子萌发的重要生态因子[2]。开展水分胁迫对沙生植物种子萌发的影响研究,有助于深入理解沙生植物地理分布及其对沙漠环境的适应策略,同时对沙地生态系统保护和植被生态恢复具有重要意义。
湿地松(P.elliottii)原产于美国东南部暖热潮湿的低海拔地区,属常绿乔木,在我国南方分布较广[3]。因其耐旱、耐贫瘠和固沙能力强等特性适合作为沙化土地生态系统重建的先锋植物[4]。目前有关湿地松的研究主要集中在生理生态[3-5]、生长因子[6]、群落调控[7-9]和菌根应用[10-11]等方面,干旱胁迫下湿地松种子的生长研究亦有少量报道[12],而关于湿地松种子萌发对水分的生态响应及萌发特性还尚未涉及。
本文采用聚乙二醇(PEG-6000)高渗溶液试验模拟干旱胁迫的方法,分析湿地松种子萌发对不同水分胁迫的响应,探求其萌发率、萌发特性及耐旱极限值,从而为其抗旱机理的研究提供依据,同时也为沙地生态系统保护和植被生态恢复提供理论基础。
1 材料与方法
1.1 试验材料
湿地松种子由江西省南昌市林业局提供,于2010年4月采集于广东,千粒重为30.79g。选取大小均匀、饱满、无病虫的湿地松种子室温下储藏备用。渗透调节剂采用的PEG-6000(化学纯CP)由上海青析化工科技有限公司生产。
1.2 试验方法
1.2.1 种子预处理 湿地松种子在30℃温水中浸泡24h后,去除浮在水面的坏种子和部分杂质后浸入75%的酒精溶液中消毒处理20min,再用蒸馏水冲洗干净后阴处晾干。
1.2.2 PEG-6000处理 采用 Michel和 Kaufmann方法[13]配制渗透势梯度分别为-0.2MPa(C1)、-0.4MPa(C2)、-0.6MPa(C3)、-0.8MPa(C4)、-1.0MPa(C5)、-1.2MPa(C6)的 PEG-6000溶液,以蒸馏水作为对照CK对湿地松种子进行水分胁迫处理。采用培养皿纸上法进行种子萌发,每个培养皿(9cm)中都放3张吸水纸后再铺上2张滤纸制成培养床。放入经过预处理后的种子,然后分别注入等量各渗透梯度的PEG-6000胁迫溶液使得吸水纸饱和,铺上湿布后置于LRH-250-GSⅡ人工气候箱中培养(湿度为58%RH,温度为25℃,光周期为8h光照/16h黑暗)。每个处理4次重复,每处理50粒种子。以后每天都要将培养皿中的吸水纸用相应浓度的PEG-6000溶液冲洗,以保持各自的溶液浓度恒定。每3天更换吸水纸,以防吸水纸霉变。1.2.3 生长指标测定 每天定时进行观察测定,以胚芽露出种皮为标准,当4个重复中有1个种子萌发时,即记录为该种子萌发开始时期,以后每日要统计萌发数,计算萌发率,并把已经萌发的种子移植在其他同样的环境中继续观察,当连续5d无新种子萌发作为萌发终止时期。同时以湿地松完全脱离种皮为标准认为其进入幼苗生长阶段。主要选取以下生理指标作为研究内容:(1)萌发率(%)=(萌发终止时期全部正常萌发的种子数/供试种子数)×100%;(2)相对发芽率(%)=(各处理发芽率/对照发芽率)×100%;(3)发芽势(%)=(规定时间内种子发芽数/供试种子数)×100%;(4)发芽指数(Gi(=∑Gt/Dt,Gt:在时间t日的发芽数;Dt:相应的发芽日数;(5)幼苗高度(cm);(6)根长(cm);(7)生物量(g/株),随机选取各处理发育完全的幼苗,用电子天平测其鲜重取平均值。1.2.4 数据处理 试验数据采用SPSS 11.5统计分析软件进行差异显著性检验,Excel 2003软件制图。
2 结果与分析
2.1 水分胁迫对湿地松种子萌发时间的影响
水分胁迫对湿地松种子萌发时间有不同程度的影响。CK的湿地松种子在第5天开始萌发,在第8~10天出现萌发高峰期,在第12天萌发基本完成。C1与CK的萌发时间基本相似,在第7~8天的萌发数反而超过CK,而后其萌发时间一直与CK保持相似,且累计萌发数和CK无显著差异(p>0.05)。但是随着PEG-6000溶液浓度的升高,其余各处理的初始萌发时间逐步推迟。轻中度胁迫处理(C2、C3)与CK相比初始萌发时间仅推迟1d,重度胁迫处理(C4、C5)分别比CK的初始萌发时间推迟了4d和8 d(图1)。
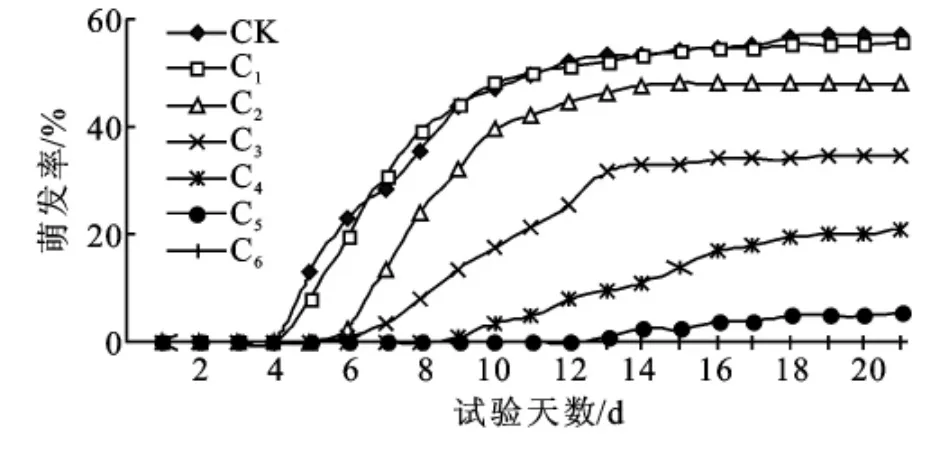
图1 湿地松种子逐日萌发率
已有研究表明,发芽势或发芽指数比发芽率更能灵敏地反映种子发芽速度和出苗整齐度[14]。在试验第10天统计各处理发芽势,在轻度水分胁迫下,C1、C2与CK相比不存在显著性差异(p>0.05),C1的发芽势甚至比CK略高。但是随着水分胁迫的加重,发芽势急速下降,C4的发芽势仅为3.5%,相当于CK的1/13,而且在C5时发芽势就降至为0(图2)。说明水分胁迫对湿地松种子萌发初期的影响较大。

图2 湿地松种子发芽势
各处理的发芽指数与CK相比均有不同程度的下降,且存在显著性差异(p<0.05),呈现明显的负相关关系(图3)。由此表明:各浓度的PEG-6000溶液处理会不同程度的延缓湿地松种子萌发的初始时间和降低萌发速度,在水分的轻中度胁迫下,推迟时间无差异或较短,随着溶液浓度的升高,推迟时间延长,直至种子无法萌发。
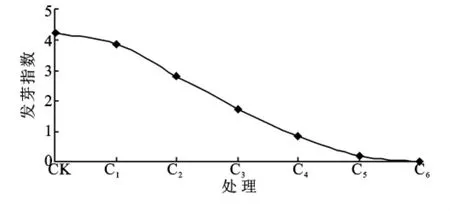
图3 湿地松种子发芽指数
2.2 水分胁迫对湿地松种子最终萌发率的影响
试验结束后,水对照处理(CK)、轻度胁迫处理(C1、C2)与中重度胁迫处理(C3、C4、C5、C6)存在显著差异或极显著差异(p<0.05或p<0.01)。C2是一个临界值,当溶液浓度小于或等于-0.4MPa,湿地松种子的萌发率与对照相比均差异不显著(p>0.05);当溶液浓度大于-0.4MPa,湿地松种子萌发率极度下降且均小于35%,重度胁迫处理C5仅为5.5%,相当于CK的1/11,而C6的萌发率甚至直接降至为0(图4)。以上结果表明:不同水分胁迫对湿地松种子的萌发均有不同程度的抑制作用,且萌发抑制程度随着PEG-6000溶液的浓度升高而增加,因此湿地松种子萌发率与PEG-6000溶液浓度呈明显的负相关。
为进一步了解湿地松种子萌发的耐旱范围,假设湿地松种子的萌发率分别为30%和0%,代入线性回归方程可以计算出种子萌发的耐旱临界值和耐旱极限值。通过计算可以得出湿地松种子萌发的耐旱临界值是-0.68MPa,耐旱极限值是-1.14MPa。

图4 水势对湿地松种子萌发率的影响
2.3 水分胁迫对湿地松幼苗高度和根长的影响
随着水分胁迫的加重,各处理湿地松幼苗高度呈下降趋势,水对照CK最大,为15.2cm,C1与CK相比无显著性差异(p>0.05),其余各处理间均成极显著性差异(p<0.01);而根长却呈现先增大再减小的趋势,轻度水分胁迫处理C1较CK有小幅增长,而后随着水分胁迫的加重,根长均下降明显(图5)。
根系是植物生长重要的器官,水分的亏缺必然会影响根系的生长[15]。轻中度水分胁迫处理的幼苗根长与高度的比值基本上都维持在50%左右,表明湿地松根系对水分胁迫的敏感性较小;轻度水分胁迫处理(C1、C2)均比CK大,表明轻度水分胁迫促进湿地松根的生长(图6)。沙生植物的一个普遍特点是通过发达根系增加与土壤的接触面和吸收面来吸取水分维持自身供给[16]。这就说明在水分胁迫下湿地松首先保证根系的发育来适应干旱环境,因此湿地松具有一定的抗旱性。
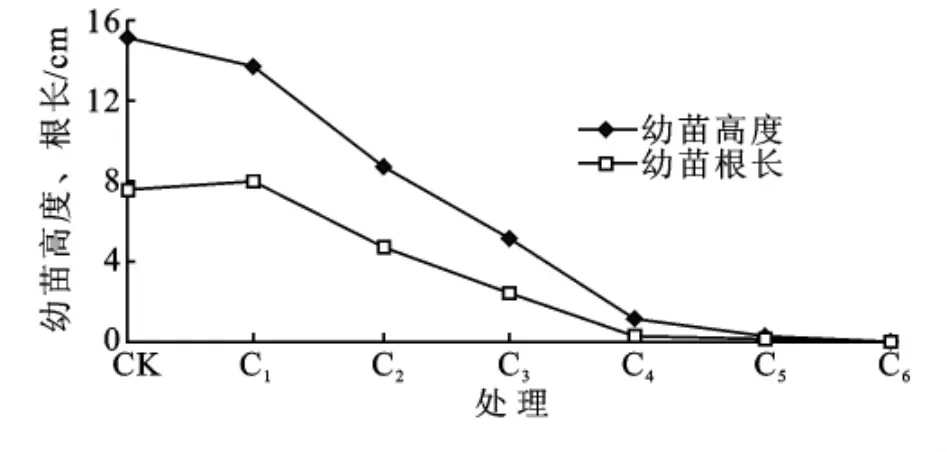
图5 湿地松幼苗高度和根长
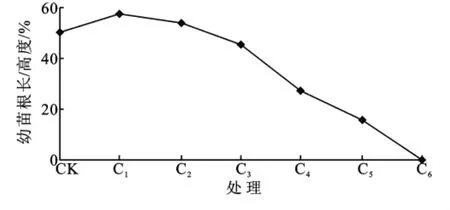
图6 湿地松幼苗根长/高度
2.4 水分胁迫对湿地松幼苗生物量的影响
轻中度胁迫处理(C1、C2、C3)的生物量均比CK低,但差别不大。随着水分胁迫的加剧,重度胁迫处理(C4、C5、C6)的生物量骤降至0(图7)。在 C4条件下湿地松种子仅能发芽,但是无法进入幼苗生长阶段,因此造成无法对其统计生物量。建立线性回归方程预测分析其在重度水分胁迫下的趋势,在-1.07 MPa下湿地松的生物量就降至为0,这与耐旱极限值基本一致。
造成该现象的主要原因是在水分胁迫条件下,湿地松幼苗根系无法吸收足够的水分来供给各器官的生长发育,导致其生物量的减少。重度胁迫处理(C4、C5、C6)的湿地松无法成苗也说明重度水分胁迫会对种子产生抑制作用迫使其进入浅度休眠状态来适应极度干旱环境,但是否可以再度复水萌发还有待进一步研究。

图7 湿地公幼苗生物量
3 结论
(1)水分胁迫抑制湿地松种子萌发,且抑制程度随着PEG-6000溶液的浓度升高而增加,其耐旱临界值是-0.68MPa,耐旱极限值是-1.14MPa。
(2)水分胁迫对湿地松萌发初期影响较大,会推迟其萌发时间,分别为1~8d不等。
(3)湿地松幼苗高度和根长会随着水分胁迫的加重而下降,但是幼苗的根系在轻中度水分胁迫下生长较为稳定,从而提高水分的吸收和利用效率,表现出对干旱的适应。
(4)水分胁迫抑制湿地松幼苗的生物量积累,在-0.8MPa时湿地松进入浅度休眠状态来适应极度干旱环境,线性回归方程预测在-1.07MPa下湿地松的生物量降至为0。
因此湿地松种子萌发阶段具有一定的抗旱性,是一种适合作为沙化土地生态系统重建的先锋植物。
[1]孙景宽,张文辉,张洁明,等.种子萌发期4种植物对干旱胁迫的响应及其抗旱性评价研究[J].西北植物学报,2006,26(9):1811-1818.
[2]张勇,薛林贵,高天鹏,等.荒漠植物种子萌发研究进展[J].中国沙漠,2005,25(1):106-112.
[3]张太平,任海,彭少麟,等.湿地松的生态生物学特征[J].生态科学,1999,18(2):8-12.
[4]何兴东.亚热带沙地湿地松造林的初步研究:以江西南昌市厚田和岗上地区为例[J].中国沙漠,1993,13(1):57-63.
[5]曾小平,赵平,彭少麟,等.三种松树的生理生态学特性研究[J].应用生态学报,1999,10(3):275-278.
[6]张欢,束庆龙,孙倩,等.安徽农业大学实验林场湿地松枯死原因的分析[J].安徽农业科学,2006,34(3):470-471.
[7]谭芳林,林捷,张水松.沿海沙地湿地松林地土壤养分含量及酶活性研究[J].林业科学,2003,39(1):169-173.
[8]陈建文.湿地松杉木混交林试验初探[J].江西农业大学学报,2001,23(5):167-169.
[9]周国模,金崇华,章伟成.马尾松、湿地松立体经营的试验研究[J].自然资源学报,1998,13(3):279-281.
[10]花晓梅,姜春前,刘国龙.我国南方松外生菌根资源调查[J].南京林业大学学报,1995,19(3):29-36.
[11]贾慧君,郑槐明,李江南,等.稳态营养与Pt菌根化在湿地松育苗中的应用[J].林业科学,2004,40(1):41-46.
[12]黄麟,叶建仁.保水剂对干旱胁迫下湿地松种子出苗的影响[J].江西农业大学学报,2007,29(3):404-408.
[13]Burlyn E M,Merrill R K.The Osmotic Potential of Polyethylene Glycol 6000[J].Plant Physiol,1973,51:914-916.
[14]马小卫,郭春会,罗梦.核壳、盐和水分胁迫对长柄扁长种子萌发的影响[J].西北林学院学报,2006,21(4):69-72.
[15]宋凤斌,戴俊英.玉米茎叶和根系的生长对干旱胁迫的反应和适应性[J].干旱区研究,2005,22(2):256-258.
[16]户连荣,郎南军,郑科.植物抗旱性研究进展及发展趋势[J].2008,36(7):2652-2654.
